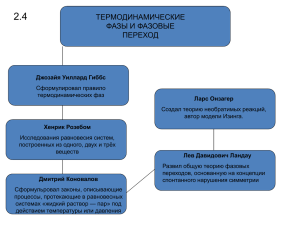
1. Биофизика как наука. Предмет, задачи и объект иссл-я биофизики. Философские проблемы биофизики. Биофизика — наука о наиболее простых и фундаментальных взаимодействиях, лежащих в основе биологических процессов. Теоретическое построение и модели биофизики основаны на физических понятиях энергии, силы, типов взаимодействия, на общих понятиях физической и формальной кинетики, термодинамики, теории информации. Эти понятия отражают природу основных взаимодействий и законов движения материи, что, как известно, составляет предмет физики — фундаментальной естественной науки. В центре внимания биофизики как биологической науки лежат биологические процессы и явления. Основная тенденция современной биофизики — проникновение в самые глубокие, элементарные уровни, составляющие молекулярную основу структурной организации живого. Общая Б.: Б. сложных систем ( –> кинетика и термодинамика живых систем), молекулярная Б. (–> строение и функционирование биол.макромолекул (белковые молекулы)). Частная Б.: отдельные процессы, клеточные процессы, б. мышечных тканей, радиационная б. Предмет Б. – Живые системы. Объект Б. – Живые системы в сравнении с неживыми объектами природы. Задача Б. – сведение биологических постулатов к физическим. Отличия живых и неживых систем: 1. Высокая упорядоченность живых систем: дискретность и целостность (целое – нечто большее, чем ∑ составных частей); многоуровневая организация (на каждом уровне приобретаются новые свойства). 2. Способность к самовоспроизведению. 3. Способность к развитию в направлении усложнения организации и увеличения упорядоченности. 4. Феномен информации (в ЖС) – обменная величина, получение кот. приводит к увеличению порядка у получателя; = обратная величина энтропии, то есть явл. отрицательной энтропией: I= -S. Условия: 1) источником информации м.б. только упорядоченная система 2) информация существует только при наличии получателя; а получатель – только упорядоченная структура 3) получение информации приводит к увеличению упорядоченности у получателя 5. Феномен целесообразности: любые структуры/процессы имеют свое назначение => функциональная упорядоченность. Философская проблема: О возможности сведения всех законов к законам физики. 1.Редукционизм. Все законы ЖС можно свести к законам физики. 2. Антиредукционизм, Витализм. Законы ЖС принципиально не сводятся к физическим. 3. Дополнительность. В основе лежат физические законы, но существуют процессы и явления пока не объяснимые с точки зрения физики и химии. 2. История становления биофизики как науки. Методы изучения в биофизике. История становления биофизики как науки. Большую роль в развитии биофизики сыграла школа Лёба (1906 г). В работе Лёба были выявлены физико-химические основы явл. партеногенеза и оплодотворения. Конкретную физико-химическую интерпретацию получило явление антагонизма ионов. Позже появ. классические иссл-я Шаде о роли ионных и коллоидных процессов в патологии воспаления. Эти иссл-я завершаются фундаментальным трудом «Физическая химия во внутренней медицине», кот. издаётся в России в 1911–1912 гг. Первая мировая война приостановила развитие биофизики как науки. Но уже в 1922 году в СССР открывается «Институт биофизики», которым руководит П.П. Лазарев. Здесь он разрабатывает ионную теорию возбуждения, кот. в это же время разраб-ся и Нернстом. Было установлено, что в явл. возбуждения и проведения решающая роль принадлеж. именно ионам. Вавилов занимается вопросами предельной чувствительности глаза. Чаговец разраб-ет ионную теорию возникновения биопотенциалов, Кольцов обосновывает роль поверхностного натяжения, ионов и рН в морфогенезе.Школа Кольцова сыграла видную роль в развитии биофизики в СССР. Ее ученики широко разрабатывали вопросы влияния физико-хим. факторов внешней среды на клетки и их структуры. Несколько позже (1934) Родионов С.Р. и Франк Г.М. открыли явление фотореактивации, Завойский (1944) метод электронного парамагнитного резонанса. Методы биофизических исследований: Рентгеноструктурный анализ – иссле-е атомной структуры в-ва, с помощью дифракции рентгеновских лучей. По дифракционной картине устанавливают распределение электронной плотности в-ва, а уже по ней можно определить, какие атомы содержатся в в-ве и как они расп.(иссл-е кристаллических структур, жидкостей и белковых молекул.) Колоночная хроматография – различное распределение и анализ смесей м/ду 2 фазами – подвижной и неподвижной. Она может быть связана с различной степенью в-ва абсорбции или к различной степени ионного обмена. Может быть газовой, либо жидкостной. Распределение в-в используют в капиллярах - капилярная, либо в трубках, заполненных сорбентом – колончатая. Можно проводить на бумаге, пластинках Спектральный анализ – качеств. и колич. опред-е в-ва по оптич. спектрам. В-во определяют либо по спектру испускания – эмиссионный спектральный анализ или по спектру поглощения – абсорбционный. Содержание в-ва определяется по относ. или абс. толщине линий в спектре. Также относят радиоспектроскопию – электронный парамагнитн. резонанс и ядерно-магнитный резонанс Изотопная индикация Электронная микроскопия Ультрафиолетовая микроскопия – иссл-е в УФ лучах биологич. объектов повышает контрастность изображения, особенно внутрикл. структур, позволяет иссл-ть клетки без предварительной окраски и фиксации препарата. 3. Термодинамические (ТД) системы. Параметры сост.-я. ТД система – совокупн-ть тел в опред. пространстве, кот. могут вз-ть м/ду собой и с др телами. Существует 3 типа ТД систем: изолированные – не обмениваются энергией и вещ-вом с окружающей средой; закрытые – обмен только энергией; открытые – обмен и вещ-вом, и энергией. Всякая система хар-ся ТД параметрами. Их совокуп-ть определяет ТД сост. системы, значит изменение хотя бы одного из параметров приводит к изменению ТД сост. системы в целом. Параметры сост.я - макроскопические (физические) переменные величины, с помощью кот. можно описать сост. конкретной ТД системы в данное время. Подразделяются на: Интенсивные - не зависят от общего кол-ва вещ-ва в сист. Носят силовой характер; могут приобретать разные значения в различ. точках системы. Наприм: Р – давление, Па (паскаль), Т – температура, К (кельвин), ρ – плотность , кг/м3, n – (молярная конц., моль) Экстенсивные - зависят от кол-ва вещ-ва в сист. Характеризует сист. как целое. Основное свойство - аддитивность – сумма отдельных частей сист по данному параметру = значение параметра для целой системы. Наприм: V – объем, м3 = 103 л, m – масса, кг, C – число молей в-ва в системе. ТД сост. системы – совокупн-ть физико-хим. параметров, кот. она обладает в данный момент времени.Любой вид затрачиваемой на соверш. работы энергии выражается ч/з произведение интенсивного (силового) параметра на экстенсивный. δA= pdV - работа упругого расширения – это произведение давления на изменение объема. 4. Внутренняя энергия, работа и тепло. Внутренняя энергия системы - сумма кинетической и потенциальной энергии всех молекул, составляющих систему. Общая энергия системы – ее общий запас, обусловленный всеми видами движений и взий составл. ее молекул, атомов, ионов, элементарных частиц. Формы передачи энергии: Работа /А ,[Джоуль]/. Теплота /Q , [Джоуль]/ - явл. энергией, переданной от одной системы др. из-за разницы их температур. Работа может совершаться над системой (при действии определённых сил) или в самой системе. Путь совершения работы может быть различным. В биологических системах совершаются различ. формы работы: механическая работа, выполняемая против механических сил осмотическая работа, состоящая в транспорте различ. в-в благодаря разности их концентраций электрическая работа, заключающаяся в ионном транспорте в электрическом поле Пути теплопередачи: Теплопроводность - процесс теплопередачи м/ду объектами при их непосредственном контакте. Конвекция - это процесс теплопередачи с одного объекта на др. движением жидкости или газа. Излучение, при кот.теплота передаётся электромагнитными волнами разной длины волны. *(вопрос 7) Первое начало термодинамики: кол-во теплоты, сообщаемой телу, идёт на Увелич. внутренней энергии и на соверш. телом работы 5. Обратимые и необратимые процессы. Равновесные (обратимые) процессы - это процессы, протекающие в системе таким образом, что вызванные ими изменения в состоянии системы могут произойти в обратной послед-ти без дополнительных изменений в окружающей среде. Необходимым и достаточным условием обратимости термодинамического процесса явл. его равновесность. ТД равновесие - это полностью стабильное сост., в кот.система может находиться в течение неограниченного периода времени. Неравновесные (необратимая) процессы – их протекания в обратном направлении сопровождаются остаточными изменениями в окружающей среде. Все реальные процессы неравновесны и необратимы. Всякий необратимый процесс в одном направлений (прямом) протекает самопроизвольно, а для осущ-я его в обратном направлении так, чтобы система вернулась в первоначальное сост., требуется компенсирующий процесс во внеш. телах, в рез-те которого сост.-я этих тел оказываются отличными от первоначальных. Напр., процесс выравнивания температур двух соприкасающихся различно нагретых тел идет самопроизвольно, т. е. не связан с необходимостью одновременного существ-я каких-либо процессов в других (внеш.), телах. Однако для осущ-я обратного процесса увеличения разности температур тел до первоначальной нужны компенсирующие процессы во внеш. телах, обусловливающие, Напр., работу холодильной машины. 6. Понятие термодинамического равновесия. Равновесные и неравновесные системы. Термодинамическое равновесие – это полностью стабильное сост., в кот.система может находиться в течение неограниченного периода времени. При выведении изолированной системы из равновесия, она стремится возвратиться к этому состоянию самопроизвольно (термос с горячей водой и кусочек льда). В состоянии термодинамического равновесия в системе не только все параметры постоянны во времени, но и нет никаких стационарных потоков за счет действия каких-либо внеш. источников. Для открытых и закрытых систем характерное стационарное сост. (параметры системы с теч. времени не изменяются). Равновесная система – параметры в разных частях системы одинаковы. Движущие силы отсутствуют. Если такая система изолирована, то она может находиться в состоянии равновесия неограниченно долго. Неравновесная система– их параметры различны в разных точках объема, что приводит к налич. постоянных градиентов и сил, и создаваемых ими потоков в-ва и энергии за счет поступления энергии из внешней среды. Если такая система изолирована, то она необратимо эволюционирует к состоянию ТД равновесия. 7. Первый закон термодинамики. История открытия. Формулировка, физический и биологический смысл. 7. Первый закон термодинамики. История открытия. Формулировка, физический и биологический смысл. Открытие первого закона термодинамики исторически связано с установлением эквивалентности теплоты и механической работы. Это открытие связано с имена Р. Майера и Д. Джоуля. Основная работа Майера, в кот. он подробно и систематически развил свои идеи, была опубликована в 1845 г. и называлась «Органическое движение в его связи с обменом в-в». Майер сразу же сформулировал первое начало термодинамики как принцип, которому подчиняются любые формы движения в природе. Он указывал, что источником механических и тепловых эффектов в живом организме явл. не жизненная сила, как утверждали виталисты, а те химические процессы, которые протекают в нем в рез-те поглощения кислорода и пищи. Джоуль пришел к установлению эквивалентности тепла и механической работы индуктивным путем, т.е. непосредственно экспериментальным измерением превращения механического движения в теплоту. 4 Первый закон термодинамики формулируется следующим образом: «Общая энергия в изолированной системе – величина постоянная и не изменяется во времени, а лишь переходит из одной формы в другую. Теплота ζQ, поглощенная системой из внешней среды идет на Увелич. внутренней энергии dU системы и соверш. работы ζА против внешних сил. Если теплота передается в систему, то ΔQ > 0. Если теплота передается системой, то ΔQ < 0. Работа, совершенная системой считается положительной. Работа, совершенная над системой – отрицательна. Первое начало термодинамики объясняет невозможность существования вечного двигателя первого рода, т.е. такого двигателя, который совершал бы работу без затрат энергии. В 19 веке было доказано, что первый закон термодинамики применим для живых систем. Это доказательство отражено в работе «О теплоте», 1873г. Лавуазье, Лаплас – ледяной калориметр, для определения количества выделенной теплоты. Смысл осуществления эксперимента заключался в том, что дыхание аналогично медленному горению (многоступенчатый процесс). Процесс дыхания служит источником тепла для живых организмов. Так же в опытах использовалась пневматическая установка, которая позволяла вычислить количество выделенного углекислого газа. При сжигании углеводов в калориметре C6H12O6 + 6O2= 6CO2+ 6H2O – углеводы окисляются до углекислого газа и воды. Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляется 4,1 кКал. Пути превращения продуктов питания в метаболических процессах в живых организмах и в хим. реакциях вне живой клетки являются эквивалентными с точки зрения суммарных тепловых эффектов. (Отсюда следствие из первого закона ТД – закон Гесса: тепловой эффект не зависит от его промежуточных этапов, определяется лишь начальным и конечным сост.-ями системы.) 8. Термодинамические функции сост.-я (термодинамический потенциал). Свободная энергия Гиббса. Примеры использования термодинамических представлений. Цель введения термодинамических потенциалов — использование такого набора естественных независимых переменных, описывающих сост. термодинамической системы, кот. наиболее удобен в конкретной ситуации, с сохранением тех преимуществ, кот. дает применение характеристических функций с размерностью энергии. В частности, убыль термодинамических потенциалов в равновесных процессах, протекающих при постоянстве значений соответствующих естественных переменных, равна полезной внешней работе. Термодинамические потенциалы были введены У. Гиббсом. Выделяют следующие термодинамические потенциалы: внутренняя энергия энтальпия свободная энергия Гельмгольца потенциал Гиббса большой термодинамический потенциал Свободная энергия (Гиббса G) биологической системы определяется наличием и величиной градиента: G = RT ln Ф1/Ф2 • R – универсальная газовая постоянная, • Т – термодинамическая температура по Кельвину • Ф1 и Ф2 – значения параметра, определяющего градиенты. Примеры: Первый закон термодинамики – закон сохранения энергии: Энергия не создается и не исчезает. Для любого химического процесса общая энергия в замкнутой системе всегда остается постоянной. Экология изучает связь м/ду солнечным светом и экологическими системами, внутри кот. происходят превращения энергии света. Энергия не создается заново и никуда не исчезает. Свет как одна из форм энергии может быть превращен в работу, теплоту или потенциальную энергию хим. в-в пищи. Из этого следует, что если какая-либо система (как неживая, так и живая) получает или затрачивает энергию, то такое же кол-во энергии должно быть изъято из окружающей ее среды. Энергия может лишь перераспределяться либо переходить в другую форму в зависимости от ситуации, но при этом она не может возникнуть ниоткуда или бесследно исчезнуть. Лучистая энергия Солнца, попав на Землю, стремится превратиться в рассеянную тепловую. Доля световой энергии, преобразованная зелеными растениями в потенциальную энергию их биомассы, намного меньше поступившей (qконц < Qсол). Незначительная часть энергии отражается, основная же ее часть превращается в теплоту, покидающую затем и растения, и экосистему и биосферу. Второй закон термодинамики гласит: процессы, связанные с превращением энергии, могут происходить самопроизвольно только при условии, что энергия переходит из концентрированной формы в рассеянную (деградирует). Этот закон назыв. законом энтропии. Теплота не передается самопроизвольно от более холодного тела к более горячему (хотя первый закон такой переход не запрещает). В природе масса примеров однонаправленных процессов. Напр., газы перемешиваются в сосуде, но сами не разделяются, кусок сахара растворяется в воде, но не выделяется обратно в виде куска. Мерой кол-ва связанной энергии, кот. становится недоступной для использования, явл. энтропия (от греч. внутрь и превращение). Т.е. энтропия явл. мерой беспорядка, мерой кол-ва связанной энергии, кот. становится недоступной для использования. В замкнутых системах энтропия (S) не может убывать; ее изменение (ΔS) равно нулю при обратимых процессах или больше нуля при необратимых процессах. Система и ее окружение, предоставленные сами себе, стремятся к состоянию максимальной энтропии (неупорядоченности). Таким образом, самопроизвольные процессы идут в сторону увеличения беспорядка. Второй закон термодинамики можно сформулировать также следующим образом: поскольку некот. часть энергии всегда рассеивается в виде не доступных для использования тепловых потерь энергии, эффективность превращения энергии света в потенциальную энергию хим. соединений всегда меньше 100%. Существует еще одна формулировка закона: любой вид энергии в конечном счете переходит форму, наименее пригодную для использования и наиболее легко рассеивающуюся. Отношения м/ду растениями продуцентами и животными консументами управляются потоком аккумулированной растениями энергии, кот. используется затем животными. Весь живой мир получает необходимую энергию из органич. в-в, созданных растениями и, в меньшей мере, хемосинтезирующими организмами. Пища, созданная в рез-те фотосинтетической деятельности зеленых растений, содержит потенциальную энергию хим. связей, кот. при потреблении ее животными организмами превращается в др.формы. Животные, поглощая энергию пищи, также большую ее часть переводят в теплоту, а меньшую в химическую потенциальную энергию синтезируемой ими протоплазмы. 9. Энтальпия. Закон Гесса. Примеры использования в биологических системах. Энтальпия — это свойство в-ва, указывающее кол-во энергии, кот. можно преобразовать в теплоту. Явл. функцией сост.-я. Обозначается как ΔH, измеряется в Дж/кг. Внесистемной ед. измерения явл. ккал/кг. Закон Гесса: Тепловой эффект многоступенчатого процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным сост.м системы. Следовательно, тепловой эффект химической реакции зависит только от вида и сост.-я исходных в-в и не зависит от пути ее протекания. Калория – внесистемная ед. кол-ва теплоты. Средняя величина физиологически доступной энергии в 1 грамме (в ккал): белков – 4,1; углеводов – 4,1; жиров – 9,3. Кол-во энергии, поглощенной живыми организмами вместе с питательными в-вами, равно выделенной за это же время теплоте. Следовательно, сами по себе организмы не являются источником какой-либо новой формы энергии. 10. Виды теплоты, теплопродукция. Удельная теплопродукция. Примеры. Кол-во теплоты — энергия, кот. получает или теряет тело при теплопередаче. Кол-во теплоты явл. одной из основных термодинамических величин. Колво теплоты явл. функцией процесса, а не функцией сост.-я, (т. е кол-во теплоты, полученное системой, зависит от способа, которым она была приведена в текущее сост..) Теплопродукция, теплообразование, выработка теплоты в организме в рез-те энерг. превращений в живых клетках; связана с непрерывно совершающимся биохим. синтезом белков и др. органич. соединений, с осмотической работой (перенос ионов против градиента концентраций), с механической работой мышц (сердечная мышца, гладкие мышцы различ. органов, скелетная мускулатура). Даже при полном мышечном покое такая работа в сумме достаточно велика, и человек среднего веса и возраста при оптимальной температуре среды освобождает около 1 ккал (4,19 кДж) на кг массы тела в 1 ч. У гомойотермных животных в покое: 50% всей теплоты образуется в органах брюшной полости, 20% - в скелетных мышцах, 10% - при работе органов дыхания и кровообращения. (В покое около 50% всей теплоты образуется в органах брюшной полости (главным образом в печени), по 20% в скелетных мышцах и центральной нервной системе и около 10% при работе органов дыхания и кровообращения. Т. называется также химической терморегуляцией.) Все реальные процессы, сопровождаются рассеянием некот. части энергии в теплоту. Теплота - деградированная форма энергии. Теплота – это особый вид энергии (низкого качества) не может переходить без потери в др.виды энергии. Тепловая энергия связана с хаотич движением молекул, остальные виды энергии базируются на упорядоч движении молекул. Сущ. классифик. видов энергии по сп-ти вида энергии превращаться в др.виды энергии. A. – max эффективная, превращается во все др.виды энергии. Гравитационная, ядерная, световая, электрическая, B. – химическая, C. – тепловая. Выделяют первич и вторич теплоту, удельную теплопродукцию. Первичная теплота - это рез-т неизбежного рассеивания энергии в ходе реакций диссимиляции из-за необратимо протекающих биохим. реакций. Первичн теплота выдел сразу же после поглощ. организмом кислорода и продуктов пит. независимо от того, совершает он работу или нет и идет на нагревание организма и рассеивается в окруж. пространстве. Выделение вторичной теплоты наблюдается лишь при реализац. энергии макроэргических соединений (АТФ, ГТФ). Идет на соверш. полезной работы. Удельная теплопродукция – это кол-во теплоты, выделяемое ед. массы животного в ед. времени: q = QT / μT, ,где : QT - кол-во теплоты, выделенное в ед. времени, μT - ед. массы, q удельная теплопродукция. Теплопродукция пропорциональна массе животного : q = a + b/M 2/3,где : а – кол-во клеток, b – площадь поверхности, М – масса тела животного. (Удельная теплопродукция уменьшается с Увелич.м массы животного). 11.Второе начало термодинамики. История открытия. Формулировка, физический и биологический смысл. Второе начало термодинамики явл. законом, в соответствии с которым макроскопические процессы, протекающие с конечной скоростью, необратимы. Второе начало термодинамики — физич. принцип, накладывающий ограничение на направление процессов передачи тепла м/ду телами. Второе начало ТД запрещает так называемые вечные двигатели второго рода. Второе начало термодинамики: В изолированной системе общее изменение энтропии всегда положит., т. е. необратимые термодинамич. процессы протекают в направлении возраст. энтропии. Поэтому эти процессы необратимы, то есть могут самопроизвольно протекать только в одном направл. История открытия:Второе начало термодинамики возникло исторически при анализе работы тепловых машин. Название «Второе начало термодинамики» и первая его формулировка (1850 г.) принадлежат Клаузиусу: «...невозможен процесс, при кот.теплота переходила бы самопроизвольно от тел более холодных к телам более нагретым». Причем такой процесс невозможен в принципе: ни путем прямого перехода теплоты от более холодных тел к более теплым, ни с помощью каких– либо устройств без использования каких-либо других процессов. В 1851 году английский физик Томсон дал другую формулировку второго начала термодинамики: «В природе невозможны процессы, единственным следствием кот. был бы подъем груза, произведенный за счет охлаждения теплового резервуара». Отсюда следует невозможность реализации двигателя 2-го рода, т.е. двигателя без потерь энергии на трение и др.сопутствующие потери. Кроме того, отсюда также следует, что все реальные процессы, происходящие в материальном мире в открытых системах, необратимы. В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции сост.-я системы, кот. Клаузиус назвал энтропией (S). Физический смысл: энтропии состоит в том, что в случае, когда материальная система наход. в полном термодинамич. равновесии, элементарные частицы, из кот. состоит эта система, находятся в неуправляемом состоянии и совершают различ. случайные хаотич. движения. В биологии: Напр., развитие зеленых растений на Земле происходит благодаря увеличению энтропии в системе Солнце–Земля. Известно, что и в состоянии покоя, и при выполнении работы может происходить рост и развитие организма, но одновременно идет непрерывн выдел. тепла жив. организм. Эта теплота диссипации представляет собой рез-т окисления в-в, заключенных в пище, кот. сопровож-ся ростом энтропии, значительно большим, чем снижение энтропии за счет роста организма и дифференцировки его клеток. Но она же противоречива Буквальное применение второго начала термодинамики ко Вселенной как целому, приведшее Клаузиуса к неправильному выводу о неизбежности «тепловой смерти Вселенной», явл. неправомерным, так как в природе в принципе не может существовать абсолютно изолир. систем. 12. Энтропия. Свойства энтропии. Ее физический и биологический смысл с позиций термодинамики и молекулярной физики. Понятие энтропии ввел Клаузиус, как ф-ция сост.-я ТД системы, определяющ меру необратим. рассеив. энергии. Клаузиус сформулир. полож. «Теплота сама собой не может переходить от тела холодного к телу горячему». Клаузиус: соотношение Q/Т (теплота / температура) есть ф-ция сост.я, S – энтропия S = Q/Т Свойства энтропии составляют 2ое начало ТД. 1) невозможность создания вечного двигателя 2-го рода (без потерь Q) (зависит от поступления Е (а 1го рода без потерь Е)) 2) все реальные процессы сопровождаются рассеянием части Е в Q. Q – деградированная форма энергии. Различ. виды энергии делят на 3 класса: А – гравитационная, световая, электрическая энергии –с наименьшими потерями Q могут быть превращены в др. виды Е. В – Е среднего кач-ва (хим. Е). С большей S переходит в др. Е. С – самая низкая – Е с maxS переходит в др. Е. (тепловая).3) Кажд. реальн. процесс, протекающ. в ТД сист., может осущ-ся только в одном направл. => любой процесс необратим. Свойства S: [S]=Дж/моль*К (параметр сост.-я) Экстенсивный параметр ТД системы. Аддитивность (полная S = ∑S каждой части). dS = diS + deS. diS – часть энтропии, обусловленная изменениями внутри системы. deS – поток энтропии, обусловл. вз-действ-м с окруж. средой.S↑, если m↑. S↑ при ↑t. S↑ при переходе в-ва из одного сост.-я в др. (Тв→ж; ж→г). S – часть общей Е, кот не может использоваться в данной системе (часть Е, кот не пойдет на соверш. работы). ↑S ↓E, вовлеченная в обмен, потери tmax. diS – никогда не имеет отрицательного значения. Если система изолирована (deS = 0): dS = diS ≥0. (diS>0 – не вся внутренняя Е переходит в А, а часть ее рассеивается в виде Q) (diS=0 при обратим. процессах. Рассеивание энерг. в пространстве не происходит). S↑ во всех реальных ТД процессах. В живых системах S↑ или ↓. Всякое ↓S требует участия внеш. сил =>S внешней системы будет возрастать. Увелич. S всегда само произвольно и необратимо. Рост и развитие: ↓S, накопление свободной Е. Статистический смысл энтропии. Принцип Больцмана: энтропия системы S в данном состоянии пропорциональна термодинам. вероятности W этого сост.-я: S = k ln W.k – константа Больцмана. W – термодинамическая вероятность, число всех возможных перегруппировок частиц, составляющих данное сост. системы. Термодинамическая вероятность явл. числом микросостояний системы, посредством кот. реализуется данное макросост. системы. Чем больше возможно микросостояний (вариантов расположения частиц), тем более неупорядочена система, тем больше величины W и S. Кажд. сист. хар-ся тенденц. самопроизвольн перехода к состоянию max сост.-я беспорядка, а в процессе роста и развития организмов происходит уменьшение скорости продуцир-я энтропии, отнесенной к ед. массы объекта. Скорость продуцир. энтропии непрерывно уменьшается и достигает minзн-я в конечном стац. состоянии (у чел. в 25 лет). Затем S↑ - старость. Благодаря > интенсивности метаболизма отток S>, чем ее продукция. «Жизнь – это постоян. борьба против тенденции к возраст. энтропии». 13. Изменение энтропии в открытых системах. Определение скорости продукции энтропии в открытых системах. dS=diS+deS. diS>=0 (никогда не бывает отрицательной). deS=0 только в изолированной системе(стационарное сост.); в закрытых и открытых системахdeS ≠ 0. Энтропия возрастает во всех реальных термодинамических процессах. (Неравенство dS≥ 0 выражает второе начало ТД) В живых системах S возрастает или уменьшается. Всякое уменьшение энтропии требует участия внеш. сил, => энтропия внешней системы (взаимодействующей) будет возрастать. Возрастание энтропии самопроизвольно и необратимо. *каждой системе свойственна тенденция к самопроизвольному переходу в сост. maxмолекулярного беспорядка, т.е. Кажд. система стремится к разупорядоченности. Второе начало ТД для открытых систем: • deS/dt ˃ 0 показывает Увелич. энтропии системы в рез-те того, что в организм постоянно поступает поток в-ва и энергии. • deS/dt ˂ 0 означает, что отток энтропии из организма превышает ее приток. • Величина diS/dt , обусловленная процессами происходящими внутри организма и выделением теплоты в окружающую среду,может принимать любое положительное значение. При условии, что diS/dt ˃ 0 , возможны следующие три случая: 1. dS/dt ˃ 0: 1.1. deS/dt ˃ 0 1.2. deS/dt ˂ 0, но diS/dt ˃ deS/dt: скорость производства энтропии внутри организма будет превышать скорость обмена энтропией с окружающей средой 2. dS/dt ˂ 0 deS/dt ˂ 0 deS/dt ˃ diS/dt Общее изменение энтропии в системе становится отрицательным, т.е. скорость обмена энтропией с окружающей средой превышает скорость производства энтропии внутри организма. Отток из организма положительной энтропии или приток из окружающей среды отрицательной энтропии. Только при ЭТОМ условии обмена энтропией с внешней средой возможно существование и усложнение живых организмов в процессе эволюции. 3. dS/dt = 0 deS/dt ˂ 0 Скорость обмена энтропией с окружающей средой равна скорости производства энтропии за счет внутренних биофизических и биохим. процессов. Установление в системе стационарного сост.-я. Увелич. энтропии системы за счет происходящих в ней необратимых процессов компенсируется притоком отрицательной энтропии при взаимодействии системы с внешней средой. Баланс S при росте и развитии организмов:рост и развитие – непрерывное снижение скорости продуцирования S, отнесенной к ед. массы объекта: dS = diS + deS< 0.Снижается и достигает минимальных значений в конечном стационарном состоянии (при ТД равновесии). Уменьшение скорости теплопродукции (dβ/dt) = уменьшение скорости продуцирования энтропии (dS/dt). Благодаря более интенсивным процессам обмена в-в отток энтропии превышает ее продукцию:deS/dt ˃ diS/dt. Старение сопровож-ся возрастанием энтропии! dS = diS + deS> 0; diS/dt>deS/dt. Жизнь – это постоянная борьба против тенденции к возрастанию энтропии. 14. Работоспособность биологических систем. Градиенты. Работоспособность биологических систем, обусловленная наличием свободной энергии, определяется градиентами, кот. являются рез-том неравновесного распределения в-ва в биологической системе и непрерывного переноса его молекул из одной части системы в другую. Работа биологической системы происходит за счет реализации энергии каких-либо градиентов. Поэтому отсутствие градиентов означает смерть организма. Биологические системы обладают разнообразными градиентами: • концентрационный - возникает при условии наличия значительной разницы в концентрации ионов во внутренней и внешней среде; • осмотический - характеризует разницу в величине осмотического давления в системе растворитель - раствор, разделенных полупроницаемой мембраной, т. е. проницаемой для молекул растворителя, но непроницаемой для растворенного в-ва; • электрический - характеризует движение ионов в сторону их противоположного заряда. Термодинамические потоки Процесс жизнедеятельности определяют потоки: осмотический, электрический, тепловой, диффузионный...кот. характеризуются градиентами соответствующих величин. Н-р: интенсивность диффузионного потока пропорциональна градиенту концентрации вва: в живых организмах градиенты определяют потоки. Градиенты, вызывающие в системе потоки в-в, теплоты, зарядов, назыв.ся термодинамическими силами. 15. Баланс энтропии при росте и развитии организмов. Для биологии и медицины особый интерес представляют открытые неравновесные системы, находящиеся в стационаром состоянии (взрослый организм). Для таких систем характерно постоянство энтропии ΔS = 0, хотя в системе протекают необратимые процессы (теплоотдача), кот. сопровождаются Увелич.м энтропии. Баланс энтропии живой системы необходимо рассматривать в виде: ΔS = ΔSi + ΔSe где ΔSi – изменение энтропии, обусловленное необратимыми процессами в системе; ΔSе – изменение энтропии, вызванное вз-действ-м системы с внешними телами. Поскольку ΔS = 0 и ΔSi > 0, то ΔSe < 0, то есть энтропия в-в поступающих в систему, меньше энтропии продуктов, выходящих из системы. В организме постоянно разруш. сложн. молек., что должно приводить к уменьш. его упорядоченности, но благодаря поступл. свободной энерг. извне (химическая энергия питательных в-в) организм непрерывно восстанавл-ет наруш. порядок. Восстанавливаются не те же молекулы биополимеров, а создаются новые, идентичные разрушенным. Характ для жизни порядок может поддерживаться только за счет непрерывной компенсации внутр. продукции энтропии внешн потоком отриц. энтропии. Используя его, биологич. сист. способна обновляться и этим тормозить переход в сост. ТД равновесия=смерть Для стационарных состояний сформулирован принцип минимума производства энтропии (И. Пригожин): в стационарном состоянии системы скорость возникновения энтропии вследствие необратимых процессов имеет минимальное значение при данных внеш. условиях. Таким образом, можно утв., что поддерж. гомеостаза требует от живых организмов min потребления энергии. Согласно теореме Пригожина система за счет внутренних необратимых процессов не способна выйти из стационарного сост.-я. Если за счет небольших флуктуаций система отклоняется от стац. сост.-я, то стремление внутр. процессов уменьшить dSi/dt вернет систему к исх. уровню (изменение, в определенном диапазоне, уровня глюкозы в крови, температуры и других параметров не приводят к необр. процессам).В общ. виде это положение сформулировано в принципе ЛеШателье–если на систему, находящуюся в состоянии равновесия оказывается внешнее воздействие, она стремится самопроизвольно вернуться в исходное сост. за счет изменения параметров в направлении противоположном внешнему возмущению. О скорости продуцирования энтропии можно судить по выдел. потока тепла, кот. сопровождает необрат. процессы в системе. Изменение скорости теплопродукции dSi/dt, отнесенная к ед. массы на разных объектах показали, что этот параметр уменьшается, начиная с первых стадий развития организма. В процессе роста и развития организма скорость продуцирования энтропии непрерывно снижается и достигает миним. знач. в конечн стац. сост-ии. Старение сопровож-ся повышением энтропии, кот. уже не компенсируется ее оттоком в окружающую среду. dS = dSi + dSe> 0; Жизнь – это постоянная борьба биосистемы против тенденции к возрастанию энтропии. 16. Сравнительная характеристика стационарного сост.-я и ТД равновесия. Сост. системы, при кот.ее параметры не изменяются в течении длительного времени, но происходит обмен в-вом и энергией с окружающей средой, назыв. стационарным. В стационарном состоянии свободная энергия и работоспособность системы постоянны, а в состоянии ТД равновесия они минимальны. В СС энтропия постоянна, а в ТД равновесии она максимальна. В СС существуют градиенты переменных и могут протекать ТД процессы, а в состоянии ТД равновесия градиенты и процессы отсутствуют. Если на систему наложены ограничения, препятствующие ее переходу в сост. ТД равновесия, она переходит в СС. В стационарном состоянии, близком к равновесию, продукция энтропии минимальна. Теорема Пригожина представляет собой критерий эволюции системы к стационарному состоянию и показывает, что вблизи ТД равновесия невозможны колебательные процессы. В процессе развития и роста организмов скорость продуцирования энтропии непрерывно снижается и достигает миним. значений в конечном стац. сост.. Отличие стационарного сост.-я от равновесного заключается в том, что в этом состоянии макроскопические процессы не прекращаются, как в случае равновесного сост.-я, а идут с постоянной скоростью. ТАБЛИЦА 17. Термодинамический подход к анализу сопряженных процессов. Связь м/ду потоками, движущими силами и скоростью продуцирования энтропии при сопряжении. Соотношения Онзагера. Биологические примеры сопряженных процессов. В живых системах градиенты определяют потоки. Градиенты, вызывающ в сист. потоки в-в, теплоты, зарядов, назыв.ся ТД силами и обозначаются Х. Потоки (или суммарная скорость соотв потоков) обозначаются J. М/ду движущ силами и потоками существует взаимосвязь, при кот. Увелич. (уменьшение) движущей силы вызывает соответствующее Увелич. (уменьшение) скорости процесса. Теория Онзагера: diS / dt = (1/Т)Х J > 0, где Х – ТД силы, действующие в системе интенсивные факторы, представляющие собой разнообразные градиенты (температуры, давления, концентрации, электрического потенциала, химического потенциала и др.) J – обобщенные потоки, вызываемые этими силами, это могут быть потоки тепла, в-ва, электрических зарядов и т.д. Произведение Х J имеет размерность работы Закон лин.соотношений: J = LX – соотнош. Онзагера. Изменение физической величины J явл. линейной функцией соответствующей термодинамической силы X. L - коэффициент прямой пропорциональности (постоянный, или линейный коэффициент). Условия применения соотнош.Онзагера: когда открытая система находится вблизи термодинамического равновесия; когда значения движущих сил весьма малы (Х), а сами процессы протекают достаточно медленно (J). Линейный закон обобщает многие эмпирические принципы, Напр., закон Ома (зависимость переноса электрического заряда от градиента электрического потенциала): • поток электричества I • движущая сила – разность потенциалов U • L = 1/R – линейный коэффициент пропорциональности I = U/R • I — сила тока (А, ампер) , • U — напряжение или разность потенциалов (В, вольт), • R — сопротивление (Ом). Кажд. поток зависит не только от своего градиента, но и от остальных. Сопряжение потоков различ. процессов означает, что потоки сами по себе невозможные с ТД точки зрения, кот сопровождаются повышением своб энергии – могут осущ-ся за счет др обобщенных сил. Кажд. поток влияет на величину других потоков системы. Два вз-д-ющих процесса : J1, X1 -поток тепла, градиент температуры; J2 , X2 - поток массы, концентрационный градиент. J1 = L11 X1 + L12X2 J2 = L21X1 + L22X2 L21, L12 - соответствуют возможной взаимосвязи двух потоков коэффициенты взаимности Онзагера. Кажд. отдельное изменение в системе может вызвать только уменьшение ее свободной энергии и повышение энтропии. Но др.изменения в этой же системе могут происходить так, что повышение энтропии при одном изменении компенсировалось ее уменьшением из-за другого изменения. Напр., некот. частицы могут перемещаться ч/з мембрану клетки в направлении их более высокой концентрации. При этом происходит уменьшение энтропии системы, кот. компенсируется гидролизом АТФ, в рез-те которого энтропия системы увелич.. Биол. примеры сопряж. проц.: процессы переноса тепла и диффузии в-ва ч/з мембрану из одной фазы в другую включают движущие силы - градиенты температуры и концентраций, а потоки соответствуют переносу тепла или вва м/ду двумя фазами. 18. Характеристики устойчивого и неустойчивого стационарного сост.-я системы. Диссипативная структура. Сост. системы, при кот.ее параметры не изменяются в течении длительного времени, но происходит обмен в-вом и энергией с окружающей средой, назыв. стационарным. Сост. системы называется стационарным, если величина энтропии не изменяется во времени dS = 0 (diS = - deS). Энтропия системы в стационарном состоянии - стабильная, но не максимальная. Градиенты и потоки сохраняются в системе. Отличие стационарного сост.-я от равновесного заключается в том, что в этом состоянии макроскопические процессы не прекращаются, как в случае равновесного сост.-я, а идут с постоянной скоростью. Устойчивое стационарное сост. характеризуется тем, что при отклонении системы от стационарного уровня в ней возник. силы, стремящиеся вернуть ее в первоначальное положение. Появление неустойчивости в биологических системах можно рассматривать как новое их сост., кот. стабилизируется во времени и пространстве. График зависимости ТdS/dt от h Т – температура, dS/dt – скорость производства энтропии, h – како-либо показатель стационарного уровня системы Диаграммы устойчивого (а) и неустойчивого (б) стационарных состояний в открытой системе. Диссипативная структура- это устойчивое сост., возникающее в неравновесной среде при условии диссипации (рассеивания) энергии, кот. поступает извне. Диссипативная система характеризуется спонтанным появлением сложной, зачастую хаотичной структуры. Простыми примерами диссипативных структур являются ячейки Бенара, лазеры и биологические процессы. Диссипация энергии системы – это переход части энергии упорядоченного процесса в энергию неупорядоченного процесса, в конечном счете – тепловую. • Если система выходит из стационарного сост.-я самопроизвольно, происходит Увелич. энтропии. • В рез-те в системе возник. процессы, кот. стремятся возвратить ее в стационарное сост.. • Если изменения не превышают определенных пределов, то стационарное сост. может восстановиться, т.е. небольшие отклонения от стационарного сост.-я не ведут к необратимым изменениям. 19. Скорость продуцирования энтропии вблизи стационарного сост.-я системы. Теорема Пригожина. Сост. системы, при кот.ее параметры не изменяются в течении длительного времени, но происходит обмен в-вом и энергией с окружающей средой, назыв. стационарным. Сост. системы называется стационарным, если величина энтропии не изменяется во времени: dS = 0 (diS = - deS). • Энтропия системы в стационарном состоянии - стабильная, но не максимальная. • Градиенты и потоки сохраняются в системе. Скорость продуцирования энтропии пропорциональна произведению скоростей процессов на движущие силы; то есть, чем ближе к равновесию, тем меньше потоки, значит и это произведение меньше точнее сказать, оно стремится к своему минимальному значению. не постоянно во времени. а вот в стационарном состоянии - оно уже постоянно и минимально. Теорема Пригожина* «В стационарном состоянии при фиксированных внеш. параметрах скорость продукции энтропии в системе постоянна во времени и минимальна по величине» dS = min *Пригожин Илья Романович (25 января 1917 г. – 28 мая 2003 г.) Нобелевская премия по химии, 1977 г. («за работы по термодинамике необратимых процессов, особенно за теорию диссипативных структур»). 20. Общие свойства систем вблизи от термодинамического равновесия. Общие свойства систем вдали от термодинамического равновесия. ВБЛИЗИ: 1. Интенсивные переменные в разных точках системы различаются не резко; 2. ТД силы и скорости процессов невелики, следовательно: 3. Скорости линейно зависят от движущих сил (поток зависит от градиента). Выполняется соотношение Онзагера; 4. Скорость продуцирования энтропии пропорциональна произведению скоростей процессов на движущие силы; 5. Все стационарные сост.-я являются устойчивыми; 6. Флуктуации, приводящие к отклонению от аттракторов, затухают. 7. Вблизи ТД равновесия невозможна временная и пространственная упорядоченность. ВДАЛИ: 1. Интенсивные переменные в разных точках системы резко отличаются, поэтому движущие силы и скорости процессов достаточно велики. 2. Скорости процессов не являются линейными ф-циями движущих сил, соотношение Онзагера не выполняется. 3. Скорость продуцирования энтропии не пропорциональна произведению скоростей процессов на движущие силы. По изменениям диссипативной функции нельзя однозначно судить о приближении системы к СС. Теорема Пригожина не выполняется. 4. Вдали от ТД равновесия возможны неустойчивые СС. 5. Большую роль в работе системы играют флуктуации. 6. Эволюция системы может приводить к возникновению упорядоченных структур = самоорганизация. (Ч/з диссипативные структуры). *Флуктуации – это случайные отклонения переменных от их стационарных значений. Если СС устойчиво, то Ф. не могут вывести систему из этого СС. Если СС неустойчиво, то Ф. приводят к значительным отклонениям системы от СС до перехода этой системы в новое СС. Ф. играют большую роль во временной эволюции системы, особенно вблизи точек бифуркации. 21. Флуктуации в термодинамической системе. Свойства и значения флуктуаций вблизи и вдали от термодинамического равновесия. Флуктуации в ТД системе – это случайные отклонения переменных от их стационарных значений. Если стационарное сост. устойчиво, то флуктуации не могут вывести систему из стационарного сост.-я (отклонения затухают). Если неустойчивое стационарное сост., то флуктуации приводят к значительным отклонениям, вплоть до перехода в другое стационарное сост.. Вблизи от ТД равновесия Вдали от ТД равновесия Флуктуации редки Частые флуктуации Имеют малые размеры, их вкладом пренебрегают Могут усиливаться до макроскопического уровня (до размеров всей системы) Не имеют значения для поведения системы во времени играют роль во временной эволюции системы Флукт., приводящие к отклонению от сост.-я равновесия, затухают 22.Феномен белка в биофизике. Уникальность строения и свойств белка. Белки являются носителями активного начала всего живого (нк-потенциальное начало живого), они главным образом изучаются молекулярной биофизикой, чья главная задача заключается в раскрытии физических и хим. механизмов, ответственных за структуру и биологические функции молекул. Основу структурной организации живого составляют макромолекулы, прежде всего важнейшие биополимеры — белки и нуклеиновые кислоты. Основная проблема м.б заключается в том, чтобы раскрыть природу взаимодействий атомных групп, определяющих конформационные особенности и внутреннюю динамику биологических макромолекул, механизмы взаимодействия электронных и конформационных переходов, и на этой основе понять механизмы функционирования биополимеров в живых системах. Белки являются биополимерами, состоящими из аминокислотных остатков, соединенных пептидными связями. Аминокислотная последовательность определяет пространственную структуру белка, а структура эта уже определяет его функцию. Они часто имеют нерегулярное строение и сложную пространственную структуру. Белки – многофункциональные молекулы. Важнейшая ф-ция белков — ферм. катализ хим. превращ. в клетке и вокруг нее. Кроме того, белки-регуляторы контролируют экспрессию генов, а рецепторные белки обеспеч. восприятие межклеточных сигналов, часто передаваемых гормонами (тоже белками). Иммунные белки и сходные с ними белки гистосовместимости обеспеч. иммунные реакции. Структурные белки образуют микрофиламенты, микротрубочки, — а также фибриллы, они армируют мембраны и поддерживают структуру клеток и тканей. Транспортные белки переносят (а запасные — запасают) др.молекулы. Белки, переносящие протоны и электроны ч/з мембрану, обеспеч. всю биоэнергетику — поглощение света, дыхание, выработку АТФ. Др.белки, "сжигая" АТФ, обеспеч. механохимическую деятельность, — они работают в мышцах или перемещают элементы клетки. При всем разнообразии, работа белков всегда базируется на высоко специфическом — взаимодействии белка с обрабатываемой им молекулой. Для специфического взаимодействия необходима достаточно "твердая" пространственная структура. Поэтому биологическая ф-ция белков тесно связана с определенностью их трехмерных структур. Не только разрушение — даже небольшие изменения этих структур часто ведут к утере или резкому изм. акт. белков. 23. Фибриллярные Мембранные Глобулярн белки. Харки примеры Фибриллярные белки. Полипептидные цепи расположены параллельно друг другу и образуют длинные волокна (фибриллы) или слой. Механическое свойство: Способны к сжатию и распрямлению. (Выполняют структурные функции) Нерастворимы в воде. Примерами являются : α-структурные фибриллярные белки (кератины, тропомиозин, белки промежуточных филаментов) β-структурные фибриллярные белки (фиброин шелка), коллаген — белок сухожилий и хрящей , и эластин. Мембранные белки. По характеру взаимодействия с мембраной белки делятся на: -монотопические белки взаимодействуют с поверхностью мембраны (моно – одним из слоев липидов); -битопические пронизывают мембрану насквозь (би – двумя слоями липидов); -политопические пронизывают мембрану несколько раз (поли- многократное вз-е с липидами). (первые относятся к периферическим белкам, а вторые и третьи к интегральным) Примеры: белки мембраны клетки и органелл (рецептор адреналина; сукцинатдегидрогеназа; цитохром b5). Глобулярные белки. Полипептидные цепи плотно скрученные в шаровидные или овальные структуры — глобулы. Они могут быть растворимыми в воде, растворах щелочей, солей и кислот. Функции: Выполняют преимущественно динамическую функцию. Особенности укладок белковых глобул: Кажд. слой сложен либо только из α-спиралей, либо только из β-тяжей, но не из α - спиралей и β-тяжей одновременно! Детальная последовательность действий не играет решающей роли при сворачивании белка. Примеры: Овальбумин. Из этого белка на 60 процентов состоит яичный белок. Лактальбумин - основная составляющая молока. Гемоглобин - содержится в эритроцитах. Это белок, кот. способен связываться с кислородом и транспортировать его. Миоглобин – это белок, похожий на гемоглобин. Он выполняет ту же функцию — перенос кислорода. Такой белок содержится в мышцах (поперечнополосатых и сердечной). 24. Элементарные взаимодействия в белках: ковалентные, координационные связи в белках. Белки – это высокомолекулярные орг-е в-ва, состоящие из альфа-аминокислот, соединенных в цепочку пептидной связью. Ковалентные пептидные связи. Первичная структура представляет собой совокупность ковалентных (пептидных) связей. Они образуют энергетический остов молекулы белка и действуют вдоль пептидной цепи. Ковалентные связи характеризуются наибольшей электронной плотностью м/ду двумя связывающими атомами, поэтому энергия связи велика. Пептидная связь образуется за счет СООН группы одной ам.к-ты и NH2 группы соседней ам.к-ты. Жесткость этих связей и плоская форма пептидной группировки образуется за счет sp2гибридизации. Ковалентные –s – s – связи: Они обусловливают изменение направления полипептидной цепи, скрепляют ее отдельные участки. Эти связи возник. м/ду двумя молекулами цистеина, находящимися на различ. участках цепи, за счет отрыва водорода от сульфгидрильных групп. Хотя под действием дисульфидных связей и уменьшается степень упорядоч вторичной структуры, наличие этих связей укрепляет структуру оставшихся α-спиралей и β-складок и делает ее более стабильной к воздействию таких физико-хим. факторов среды, как температура и рН. Если цистеиновые фрагменты содержатся в различ. полипептидных цепях, образующийся цистеиновый мостик связывает эти цепи. Координационные связи (донорно-акцепторный мех-м) образуются м/у атомамиN, O, S– белков. Могут уч-ть атомы О, принадлеж. Н2О. С 2,3 валентными металлами обрсякоорд. связь. Fe, Zn, Ca, Co, Mg. У них есть свободные орбитали. У N, O,S(доноры) есть свободные электронные пары. Образуется связь ничем не отличающаяся от ковалентной связи. В чистом виде есть доноры и акцепторы. Атом Ме: связывается одновременно с несколькими атомами, при этом крупные ат. доноры со всех сторон «прилепляются» к Ме. Чаще всего 6 атомов координируется вокруг Ме. Роль этих связей связана с работой белков. 25. Силы Ван-дер-Ваальса, характеристика, примеры на белковых молекулах. Вандерваальсово вз-е (относится к слабым типам связей; межмолекулярные взаимодействия, не приводящие к образованию хим. соединений): • Ориентационные силы: Энергия дипольдипольного взаимодействия равна: Wдд = - p12p22 / 6 πɛ0ɛkTr6 где p1 иp2 - дипольные моменты вз-д-ющих молекул; r – расстояние м/ду молекулами (диполями) K – постоянная Больцмана; T – температура; ɛ0 - = -12 Ф/м – электрическая постоянная ɛ относительная диэлектрическая проницаемость среды. • Индукционное вз-е (наведенное): Молекула, имеющая постонный дипольный момент, способна индуцировать его в соседней молекуле. Энергия индукц. взаимодействия равна:Wинд= -αp2 / 2πε0εr6 где α поляризуемость молекулы или атомной группы, p – дипольный момент • Дисперсионные взаимодействия Электрическая энергия растет с уменьшением расстояния r как 1/r. Согласованное колебание электронов (квантовый эффект) понижает энергию системы. *Вандерваальсовым вз-действ-м (в числе прочих слабых вз.-ий) обусловлены вторичная и более высокого уровня структуры белка, в частности, четвертичная структура: объединение неск.пептидных цепей в комплекс – примеры: гемоглобин, многие ферм. (фосфорилаза – отв. за перенос и деградацию гликогена в клетках).Наличие четвертичной структуры ферме. белков важно для их физиол. акт. (*-не по лекциям) 8,85* 10 26. Энергия Ван-дер-Ваальсова взаимодействия: вз-е сил отталкивания и притяжения в белках, формула ЛеннардДжонса. Ван-дер-Ваальсова взаимодействия, обусловливают притяжение м/ду молекулами. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионное взаимодействия. На малых расстояниях начинают сказываться силы отталкивания м/ду атомами, кот. связаны с эффектами отталкивания электронных облаков при их взаимопроникновении. Значение энергии притяжения обратно пропорционально r6: (1/r)6 Значение энергии отталкивания обратно пропорционально r12: (1/r)12. Потенциалы взаимодействия складываются из энергии притяжения и отталкивания. их, как правило, не рассчитывают строго теоретически, а задают в виде атом-атомных потенциалов Букингема или ЛеппардаДжонса. Формула Леннард-Джонса: ULD = E0[(r0/r)12 — (r0/r)6] или ULD = А/ r12 - В/ r6 где А и В — эмпирические константы Минимум на кривой при г = r0 соответствует равновесному положению, в кот.силы притяжения уравновешиваются силами отталкивания. Формула при заданных значениях констант определяет минимальное расстояние, на кот.система из двух вз-д-ющих атомов устойчива. Если ограничиться только силами Ван- дер-Ваальса, не принимая во внимание других взаимодействий, то силовое поле вокруг атома обладает центром симметрии. Тогда можно определить тот эффективный объем вокруг атома, или эффективный радиус взаимодействия, в пределах которого невозможно одновременное нахождение двух атомов. Wдисп= - 2 I1I2 / 3 (I1+I2) * α1 α2 / r6 где I1 и I2 потенциалы ионизации групп; α1 и α2 - поляризуемости групп. Г. Рамачандран (1963) нашел минимальные расстояния для пар различ. атомов и небольших атомных групп (СНз,СН2). Напр., для пары ковалентно не связанных атомов С • • • С обычное расстояние составляет 0,32 нм а минимально возможное — 0,3 нм. Использование этих расстояний полезно при составлении стерических карт биополимеров, так как позволяет определить стерически разрешенные области взаимного расположения атомных групп. Однако недостатком данного подхода явилось предположение о центрально-симметричной картине взаимодействия и пренебрежение направленным характером сил. Характерные параметры потенциалов Вандер-Ваальсовых взаимодействий Вз-е E0, ккал/моль r0, Å rmin, Å H . . . . H 0.12 2.4 2.0 H . . . . C 0.11 2.9 2.4 C . . . . C 0.12 3.4 3.0 O . . . . O 0.23 3.0 2.7 N . . . . N 0.20 3.1 2.7 27. Элементарные взаимодействия в белках: водородные связи, их характеристика. Элементарные взаимодействия в белках делятся на: Ковалентные связи, Координационные связи, Силы Ван-дер-Ваальса, Водородные связи и Гидрофобные взаимодействия. Вода — Н2О — кипит при 3730К, а твердеет при 2730К, в то время как О2 кипит при 900К и твердеет при 540К; Н2 кипит при всего 200К и плавится при 40К. То, что структуры воды и льда с трудом разрушаются теплом, показывает, что молекулы воды чем-то очень сильно связаны м/ду собой. Водородные связи. Образуются м/ду атомом водорода, ковалентно связанным с электроотрицательным атомом и другим электроотрицательным атомом(О, N, F, Сl). Но С-H группа, Напр., водородных связей не образует: атом С — недостаточно электроотрицательный атом. Водородная связь имеет электростатическую природу и связана с наличием парциальных зарядов на вз-д-ющих атомах. Водородная связь направлена от донора(водород) к акцептору(атому O или N). Водород всегда выступает донором одной водородной связи, кислород может быть акцептором двух водородных связей. Заряды на полярных атомах появляются в рез-те того, что электроотрицательные атомы O оттягивают электронные облака от соседних Н атомов. В рез-те на последних возник. небольшие положительные заряды, а на O — отрицательный заряд. В белках водородные связи образуются м/ду отдельными группами аминокислотных остатков и м/ду полярными АК и молекулами воды. Водородные связи стабилизируют вторичную структуру полипептидных цепей. Парциальные заряды молекулы воды взаимодействуют с энергией порядка 10 ккал/моль на расстоянии 3, чего хватает на то, чтобы, при притяжении Н к О, "промять" электронные оболочки атомов. Особенно этот эффект "проминания" облаков существенен для атомов водорода: здесь электронная оболочка Н, и так состоявшая всего из одного электрона, оттянута к О атому, так что смять ее особенно легко. Смять электронную оболочку, скажем, О атома много труднее — вокруг ядра О вращается 8 "своих" электронов, да еще какую-то часть электронного облака атом О (в Н2О) оттягивает у соседних водородов. Легкость проминания электронного облака у Н атома и превращает обычное электростатическое вз-е в водородную связь. 28. Элементарные взаимодействия в белках: гидрофобные взаимодействия, их характеристика. Возник. м/ду гидрофобными участками аминокислот цепи. Неполярный участок препятствует образованию водородных связей м/ду молекулами воды. Это приводит к уменьшению энтропии в системе и увеличению свободной энергии, так как происходит уменьшение числа степеней свободы у молекул воды, находящихся в контакте с неполярным участком. Далее происходит самопроизвольный процесс сближения гидрофобных участков для уменьшения поверхности их соприкосновения с молекулами воды. Таким образом, гидрофобные взаимодействия обусловлены эволюцией белка к стационарному состоянию с минимальной площадью контакта гидрофобной части с молекулами воды. В белках наиболее гидрофобные остатки образуют "гидрофобное ядро", окруж. гидрофильн. остатками. 29. Первичная структура белка. Пептидная связь и ее свойства. Пространственная конфигурация полипептидной цепи. Факторы ее определяющие. Первичная структура полипептидной цепи представлена последовательностью АК остатков, соединенных пептидными связями. Пептидная связь – ковалентная св. (образ за счет обобществления пары электронов). Пепт св образ за счет амино- и карбоксильной групп аминокислот. Связь C-N частично имеет характер двойной (полуторная связь: примерно 0,132 нм, в то время как у двойной св длина 0,124 нм, а у одинарной 0,147 нм). Причина этого состоит в том, что неподеленная пара 2s2-электронов атома азота обобществляется м/ду углеродами и азотом, давая примесь двойной связи м/ду ними. При этом электрон углерода «выталкивается» из двойной π-связи С = О и локализуется на атоме кислорода, частично превращая связь С = О в одиночную и увеличивая ее длину от 0,121 до 0,124 нм. Т.о. м/у атомами C, N, O происходит делокализация электронов, что сопровож-ся сдвигом электронной плотности. Жесткость связи определяется sp2 – гибридизацией. Свойства пепт св: • копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости; • способность существовать в двух резонансных формах (кето- или енольной форме); • транс-положение заместителей по отношению к С-N-связи; • способность к образованию водородных связей, причем Кажд. из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными. Пространственная конфигурация полипептидной цепи, точнее тип полипептидной спирали, определяет вторичную структуру белка (α-спирали и βструктуры). На образование вторичных структур влияет аминокислотный состав, способность образование водородных связей, дисульфидных мостиков. 30. Вторичная структура белка. Типы вторичной структуры, их особенности. Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при кот. происходит вз-е пептидных групп с образованием м/ду ними водородных связей. Вторичная структура образуется только при участии водородных связей м/ду пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д. Можно выделить два возможных варианта регулярных вторичных структур: α-спираль (α- структура) и β-складчатый слой (βструктура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура. α-спираль характеризуется витками вокруг оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм, спираль стабилизирована водородными связями м/ду H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали. β-складчатый слой: белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В резте пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей. Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких вз-д-ющих друг с другом участков одного белка может быть от двух до пяти. Под направлением белковой цепи понимают направление от N-конца (N-концевой аминокислоты) к C- концу (С-концевой аминокислоте). Также существуют нерегулярные вторичные структуры, аминокислотные остатки кот. имеют разную конформацию главной цепи: • повороты — нерегулярные участки полипептидной цепи, кот. обеспеч. поворот ее направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин петля; Венкатачалам ввел для них термин β-изгиб. Также существуют повороты из 4, 5 и 6 аминокислотных остатков. • полуповороты, или переходы, — нерегулярные участки полипептидной цепи, кот. обеспеч. поворот ее направления на 90°. Минимальный полуповорот состоит из 3 аминокислотных остатков. 31. Третичная структура белка, характеристика. Четвертичная структура белка, характеристика, отличия от агрегатов. У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, явл. вз-е радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также вз-е белковых молекул с другими ввами. Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям м/ду атомными группировками боковых радикалов следующих типов: - водородные связи могут возникать м/ду функциональными группами боковых радикалов. Напр., м/ду ОН группой тирозина и –N<в кольце остатка гистидина. - электростатические силы притяжения м/ду радикалами, несущими противоположно заряженные ионные группы (ион-ионные взаимодействия), Напр. отрицательно заряженная карбоксильная группа (– СОО– ) аспарагиновой кислоты и (NН3+) положительно заряженной e-аминогруппой остатка лизина. - гидрофобные взаимодействия обусловлены силами Ван-дер-Ваальса м/ду неполярными радикалами аминокислот. (Напр., группами –СН3 – аланина. - ковалентной дисульфидной связью (–S–S–) м/ду остатками цистеина. Эта связь очень прочная и присутствует не во всех белках. Только после приобретения белковой молекулой естественной, нативной третичной структуры он проявляет свою специфическую функциональную активность: каталитическую, гормональную, антигенную и т.д. Именно при образовании третичной структуры происходит формирование активных центров ферментов, центров ответственных за встраивание белка в мультиферментный комплекс, центров, ответственных за самосборку надмолекуляных структур. Поэтому любые воздействия (термические, физические, механические, химические), приводящие к разрушению этой нативной конформации белка (разрыв связей), сопровож-ся частичной или полной потерей белком его биологических свойств. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена). Некот. белковые макромолекулы могут соединяться друг с другом и образовывать относительно крупные агрегаты. Подобные полимерные образования белков, где мономерами являются макромолекулы белка, назыв.ся четвертичными структурами. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой — протомерами или субъед.ми . При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Напр., гемоглобин - белок, имеющий четвертичную структуру, состоит из четырех субъединиц, кот. образуют единый макромолекулярный агрегат. Кажд. из субъединиц — глобулярный белок и в целом гемоглобин тоже имеет глобулярную конфигурацию. Стабилизация четвертичной структуры белков: Контакты м/ду поверхностями субъединиц возможны только за счет полярных групп аминокислотных остатков, поскольку при формировании третичной структуры каждой из полипептидных цепей боковые радикалы неполярных аминокислот (составляющих большую часть всех протеиногенных аминокислот) спрятаны внутри субъединицы. М/ду их полярными группами образуются многочисленные ионные (солевые), водородные, а в некот. случаях и дисульфидные связи, кот. прочно удерживают субъединицы в виде организованного комплекса. 32. Общие закономерности, наблюдаемые в структуре белков. Мотивы укладки. Термодинамические характеристики образования структур белковых молекул. На самом деле здесь действует правило "80%:20%". В применении к белкам — "80% всех белков вписывается в 20% наблюдаемых архитектур белковых глобул". Существуют "типовые проекты" строения белковых глобул. Архитектуры вновь расшифрованных белков все чаще и чаще оказывались сходными с архитектурами белков уже известных — но при этом совсем других и по функции, и по аминокислотной послед-ти. Поэтому причина сходства структур, видимо, заключается не только в эволюционной дивергенции и не в функциональной конвергенции белков, а в ограничении набора укладок какими-то физическими закономерностями. М/ду двумя "традиционными" структурными уровнями (вторичная структура белка и его детальная атомная трехмерная структура) находится промежуточный уровень — «мотив укладки" белковой цепи, определяемый взаимным расположением α- и/или βучастков в глобуле — и что именно на этом уровне проявл. сходство белков, не связанных ни эволюционно, ни функционально. В отличие от детальной, атомной трехмерной структуры, "мотивы укладки" удивительно просты и даже красивы Почему стабильность плотной глобулы требует, чтобы каркас белковой молекулы выглядел бы как компактная упаковка α- и βслоев, чтобы α- и β-участки шли от одного края глобулы до другого, и чтобы нерегулярные участки не лежали внутри глобулы? Тут все дело в водородных связях, кот. стоят дорого, а потому все должны быть насыщены в стабильной структуре. Доноры и акцепторы таких связей есть в пептидной группе каждого аминокислотного остатка. Насытиться они могут или водой, или при образовании вторичной структуры. Поэтому только вторичные структуры могут не контактировать с водой — лежать внутри глобулы — а содержащие свободные полярные пептидные группы элементы — петли, края β-листов и концы α- спиралей — должны быть на поверхности. Вытянутые α- и β-структуры должны, ради стабильности глобулы, со всех сторон плотно окружать гидрофобное ядро, создаваемое боковыми группами этих участков, и тем самым отделять его от воды. В то же время αспирали и β-листы не могут смешиваться в одном слое, — пропадут водородные связи края β-листа. Значит, стабильность глобулы требует образования α- слоев и — отдельно — β-слоев. Такие слои (обычно не плоские — скрученные, иногда цилиндрические, а в αспиральных глобулах — даже квазисферические) типичны для белковых глобул. Подавляющее большинство доменов может быть представлено в виде двух-, трех- или (редко) четырехслойных структур, хотя отдельные белки (особенно те, кот. содержат металлоорганич. комплексы или много S-S связей боковых групп) могут и не вполне удовлетворять этой схеме. Более чем четырехслойных доменов нет. У них внутри, в отдалении от воды находилось бы слишком много остатков, и при типичном для белковых цепей — точнее, для цепей водорастворимых глобулярных белков — соотношении 1:1 м/ду неполярными и полярными остатками многие полярные остатки увлекались бы внутрь белка, что энергетически крайне невыгодно: такой белок не был бы стабильным. Поэтому очень большие единые глобулы "обычного" аминокислотного состава должны быть нестабильны, и большие белки должны разбиваться на субглобулы, домены. Статистический анализ показывает, что аминокислотные послед-ти водорастворимых глобулярных белков — а о них-то сейчас и идет у нас речь — выглядят как "случайные". То есть в них разные аминокислотные остатки перемешаны примерно так, как можно было бы ожидать при случайной сополимеризации. Конечно, Кажд. последовательность не есть рез-т случайного биосинтеза; Кажд. белковая цепь кодируется геном. Однако аминокислотные послед-ти водорастворимых глобулярных белков выглядят как "случайные", — в том смысле, что в них нет ни блочности, характерной для мембранных белков (где явно гидрофобные куски перемежаются с явно гидрофильными), ни периодичности, характерной для белков фибриллярных. Мотивы укладок белковых цепей часто удивительно красивы. Ход белковых цепей часто напоминает линии, орнаментирующие керамику. Это сходство не случайно — так как и линия орнамента, и белковая цепь "решает" одну и ту же задачу — окружить объем (в белке это центр глобулы, ее гидрофобное ядро), избежав самопересечений этой линии. 33. Физическая теория фазовых переходов. Понятие фазового перехода. Типы фазовых переходов. Образование и разрушение пространственной структуры белка с позиции теории фазовых переходов. Фаза вва – это сост. в-ва, которому в данных условиях соответствует минимум свободной энергии. При изменении условий могут происходить переходы м/ду фазами, изменение фазового сост.-я в-ва. По характеру изменения свободной энергии выделяют три типа фазовых переходов. ФП 1 рода. В процессе ФП наблюдается только начальное и конечное сост.-я, невозможно уловить промежуточные сост.-я. ФП происходит в узком диапазоне условий, зависимость свободной энергии от условий носит S-образный характер. Изменение фазы происходит по принципу "Все или Ничего". Стабильные сост.-я м/ду ФП 1 рода разделены достаточно высоким энергетическим барьером, поэтому они происходят достаточно длительное время. ФП 2 рода. Для этого типа ФП характерно постепенное изменение фазы ч/з многочисленные промежуточные сост.-я, принцип "Все или Ничего" отсутствует. Скачок энергии в малом диапазоне условий отсутствует, поэтому ФП 2 рода происходят быстро и в более широком диапазоне условий. При достижении температуры ФП происходит скачок теплоемкости системы, в рез-те дальнейший рост температуры сопровож-ся слабым ростом энергии. Нефазовые переходы. Для них характерно значительное изменение упорядоченности системы без изменения ее агрегатного сост.-я и размерности. В процессах денатурации и ренатурации белка разные стадии представляют собой фазовые переходы разного рода. Для малых белков процесс можно считать одностадийным. Этот процесс происходит как ФП 1 рода. Для крупных белков этот процесс многостадийный, и разные его стадии происходят как ФП разного рода. Ранние этапы самосборки различаются в зависимости от типа вторичной структуры. Образование α-спирали происходит как нефазовый переход, так как оба фазовых сост.-я одномерны и не происходит изменения границы фаз. Образование βлистов происходит как ФП 1 рода, площадь контакта цепи с листом зависит от размера контактирующих элементов. Процесс образования β-структуры происходит значительно дольше. Процесс образования и разрушения нативной структуры происходит как ФП 1 рода. В процессе этого перехода происходит изменение энтропии системы, компенсированное изменением свободной энергии. Это обеспечивается наличием большого числа слабых связей с низкой энергией. К ФП 2 рода могут относиться процессы образования и разрушения доменных структур, кот. часто сопровождаются ростом теплоемкости системы. 34.Денатурация белка. Термодинамическая характеристика денатурации. Этапы денатурации белка. Механизмы денатурации. Способы денатурации. Ренатурация. Денатурация – потеря белком своей активности, нативности, рабочей структуры. В термодинамическом плане денатурация сопровож-ся Увелич.м энтропии и уменьшением свободной энергии белка. Существует два механизма денатурации для малых и крупных белковых молекул. В первом случае процесс денатурации представляет собой ФП 1 рода, что обеспечивается наличием большого числа слабых связей с глобуле. Во втором случае на первом этапе плавления глобулы происходит нарушение упорядоченности боковых групп, но сохраняется общая пространственная структура. Этот переход происходит как ФП 1 рода. Дальнейшие этапы денатурации зависят от доменной и вторичной структуры и могут происходить как ФП любого рода. Расплавленная глобула явл. устойчивым интермедиатом разворачивания белка и характеризуется минимумом свободной энергии. Самые распространенные способы денатурации: температурная, химическая, лучевая (механизмы – это то, что лежит в основе каждого способа денатурации). Температурная – 2 типа: 1.Тепловая – при увеличении температуры. В основе лежит Увелич. скорости молекулярных движений, приводящих к разрыву связей (ковалентных, дисульфидных, координационных, реже пептидных). 2.Холодовая – при понижении температуры. Причина денатурации – снижении гидрофобности. Химическая – оттягивается часть водородных связей при погружении в раствор, следовательно белок становится менее стабилен (т.к. вода тоже явл. конкурентной). Лучевая – обусловлена поглощением атомами белка энергии, следствие – разрыв связей. Установлено, что денатурация (Д.) малых белков представляет собой S-образную кривую. Характеристики молекулы меняются от тех, что характерны для нативного белка до тех, что характерны для белка денатурированного. Узость этих S-образных кривых свидетельствует о кооперативности перехода (о том, что он охватывает много аминокислотных остатков). Переход «все или ничего»: Калориметрическое иссл-е тепловой денатурации лизоцима при разных рН. Положение пика удельной теплоемкости (Ср) определяет температуру T0, его ширина — ширину перехода дельта T, площадь под пиком — поглощенное при плавлении тепло дельта Н в расчете на грамм белка. ( Т.е. Энтальпия и температура денатурации белка зависят от рН среды, следовательно, существенна роль электростатических эффектов). Напр., миоглобин при рН 12,2 - Т плавл. =50°С и ΔН =300 кДж/моль; при рН 10,7 - Т плавл. = 78°С и ΔН=710 кДж/моль. Сочетание факторов существенно влияет на механизм денатурации. Денатурация кислотой или щелочью определяется: 1.Свободная энергия полиэлектролита пропорциональна квадрату суммы заряда поверхности. Стабильность глобулы уменьшается в обе сторон от изоэлектрической точки (ИЭТ – это когда число разноименных зарядов в молекуле одинаково, суммарный заряд = 0). 2.Изменение pH может приводить к ионизации групп, погребенных в неполярном ядре глобулы (гидрофобном ядре). Эти группы притягивают гидратные оболочки, а следовательно происходит сдвиг равновесия к расплавленной форме. Увеличенная теплоемкость денатурированного белка – следствие увеличения поверхности контакта его гидрофобных боковых групп с водой при частичном или полном разворачивании белка. Принцип «все или ничего» - микроскопический аналог ФП 1-ого рода (ФП 1-ого рода в чистом виде наблюдается в маленьком белке или отдельных доменах крупного белка). Денатурация крупного белка – есть сумма денатурации доменов. Как плавится белок: целиком или по частям? Калориметрическая теплота – это кол-во тепла, поглощаемо одной молекулой белка в процессе плавления. Эффективная теплота перехода – это кол-во тепла, поглощенного одной независимой «ед. плавления». Если эффективная теплота перехода МЕНЬШЕ калориметрической теплоты перехода, значит ед. плавления МЕНЬШЕ, чем сама молекула белка. Такая молекула плавится по частям. Если эффективная теплота перехода БОЛЬШЕ калориметрической теплоты перехода, ед. плавления БОЛЬШЕ этой молекулы. Плавится агрегат молекул. Если эти 2 теплоты перехода равны, значит молекула плавится как единое целое, ед. плавления = этой молекуле. (критерий ВантГоффа – для перехода «все или ничего»). Детьта Т определяется шириной зоны резкого изменения любого экспериментального параметра, определяющего вероятность расплавленного сост.-я. • ΔE = ΔH/N «все или ничего», где ΔH – колво тепла, поглощаемое всеми имеющимися молекулами, N – кол-во всех молекул белка, ΔH/N – калориметрическая теплота. • ΔE < ΔH/N ед. плавления меньше, чем весь белок • ΔE > ΔH/N ед. плавления больше белка (сразу несколько молекул плавится). В процессах денатурации и ренатурации белка разные стадии представляют собой фазовые переходы разного рода. Для малых белков процесс можно считать одностадийным. Этот процесс происходит как ФП 1 рода. Для крупных белков этот процесс многостадийный, и разные его стадии происходят как ФП разного рода. Денатурация может быть: Обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, Напр., рецепторные белки мембраны. Необратимой, если восстановление пространственной конфигурации белка невозможно. Обычно это происходит при разрыве большого кол-ва связей, Напр., при варке яиц. Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции. Процесс восстановления структуры белка после денатурации называется ренатурацией. 35. Строение атома, теории Томсона, Резерфорда. Первый и второй постулаты Бора. Атомные спектры. Теория Томпсона («Кекс с изюмом») 1903 год: Атом представляет собой электронейтральную сферу, в кот. в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд кот. равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов. Теория Резерфорда (Планетарная модель атома): В центре атома находится положительно заряженное ядро с зарядом Z (порядковый номер элемента), по круговым орбитам вращаются отрицательно заряженные электроны. Недостатки: Центростремительная, сила, удерживающая электрон на орбите радиусом г, представляет кулоновскую силу притяжения электрона к ядру: где εо = 8,85 • 10-12 Ф/м — электрическая постоянная; m — масса электрона, кг; v — скорость электрона на орбите, м/с. Энергия электрона должна постепенно убывать, а вместе с ней и скорость вращения электрона вокруг ядра. Электрон в конце концов должен упасть на ядро. Однако атомы — достаточно устойчивые образования и могут существовать миллиарды лет. Постулаты Бора: 1) Условие стационарности: электрон в атоме может находится только в некот. определенных устойчивых сост.-ях, называемых стационарными, или квантовыми, каждому из кот. соответствует определенная энергия. В этих сост.-ях атом не излучает. Из всех возможных состояний в атоме реализуются только те, для кот. момент импульса равен целому числу постоянных Планка (h=6,63*1034 Дж/с), деленных на . Условие квантования орбит: 2) При переходе из 1 стационарного сост.-я в другое атом излучает и поглощает энергию электромагнитного излучения определенными порциями – квантами или фотонами. Условие частот: Атомные спектры – спектры испускания электромагнитных волн одиночными атомами. Обусловленные электронными переходами м/ду стационарными орбитами. При переходе с одной орбиты на другую излучается или поглощается квант энергии с определенной частотой: При переходе с внешней орбиты на первую – серия Лаймана, частоты в УФ области. При переходе с любой внешней на вторую – серия Бальмера, ближняя УФ и видимая область. При переходе с любой внешней на третью – серия Пашена, инфракрасная область. При переходе с любой внешней орбиты на четвертую – серия Брэкета, далекая инфракрасная область. 36. Фотофизические и фотохимические превращения биосистем. Классификация фотобиологических процессов. Фотобиологическими назыв. процессы, начинающиеся с поглощения света биологическим соединением и заканчивающиеся определенной физиологической реакцией организма. Фотохимические и фотофизические процессы являются ключевыми в жизнедеятельности биосистем. Подавляющее большинство фотобиологических реакций относятся к эндергоническим. Фотохимическими реакциями назыв. такие химические реакции, кот. протекают только под воздействием света. Начальной стадией любой фотохимической реакции явл. поглощение фотона, кот. переводит молекулу в возбужденное сост.. Энергия фотонного возбуждения составляет несколько электронвольт, в то время как энергия теплового возбуждения при обычных температурах не превышает нескольких сотых электронвольта (Ефот >> Етепл). Высокая энергия фотовозбуждения и обусловливает возможность протекания таких реакций, кот. в обычных условиях неосуществимы. Фотонное возбуждение молекулы запускает один из двух возможных механизмов изменения ее хим. свойств, Кажд. из кот. затем порождает цепочку обычных хим. превращений. В возбужденной молекуле появл. электрон на высоко расположенной свободной орбитали. Такой электрон легко отделяется от молекулы, и она вступает в реакции фотоокисления. В этом случае возбужденная молекула становится донором электрона. Типичными донорами являются возбужденные молекулы триптофана и тирозина (ароматические аминокислоты). C др. стороны, после перехода электрона на один из верхних энерг. уровней на основной орбитали S0 образуется вакансия, в рез-те чего молекула может вступить в восстановительную реакцию с подходящим донором. В этом случае она становится акцептором электрона. Примером такой реакции служит фотовосстановление хлорофилла. Продукты первичных окислительновосстановительных реакций являются свободными радикалами (имеют неспаренный электрон) и обладают высокой химической активностью. Они вступают во вторичные реакции, кот. и заканчиваются соответствующей физиологической реакцией. Энергия света необходима для преодоления активационных барьеров и хим. превращения. Функции света в живых системах: 1 Энергетическая – обеспечение живых систем свободной энергией солнца. 2 Информационная – обеспечение взаимодействия живых систем с окружающей средой. Классификация фотобиологических процессов. А) с энергетической т.з. 1. Эндергонические фотобиологические реакции – реакции, в рез-те кот. образуются фотопродукты, обладающие большими запасами свободной энергии. Эти запасы больше, чем у исходных в-в. Смысл: превращение световой энергии в химическую. 2. Экзергонические фотобиологические реакции – идут с уменьшением или без существенного изменения свободной энергии системы (большинство фотобиологический реакции, Напр., зрение). В) с функционально-физиологической т.з (биологической стороны): 1. Энергетические фотобиологические р-ции (АТФ) 2. Информационные фотобиологические р-ции – кванты света по средством образования продуктов запускают усиленные механизмы, организм получает информацию. Напр., токсины, зрение у животных, тропизмы, периодизмы. 3. Фотобиосинтетические реакции – отдельные промежуточные стадии последовательных реакций синтеза (Напр., витамина D, хлорофилла, активация ферментативных систем, синтез пигментов). 4. Деструктивно – модифицирующие фотобиологические реакции – свет повреждает молекулы объекта, индукция хим. процессов приводит к повреждению или гибели клеток (организма). Наряду с этим может быть стимуляция или модификация жизненных процессов. Большинство фотобиологических реакций относятся к деструктивно-модифицирующим. Их разделяют на: летальные, мутационные, патофизиологические. Общая схема фотобиологических процессов. Отдельный фотобиологический процесс представляет собой сложную последовательность различ. стадий : 1. Поглощение энергии фотона хромофорной группой биомолекулы и образование электронно-возбужденных состояний системы 2. Миграция энергии электронного возбуждения 3. Первичный фотофизический акт и появление первичных фотопродуктов 4. Промежуточные стадии, включающие перенос заряда 5. Образование стабильных хим. продуктов 6. Физиолого-биохим. процессы 7. Конечный фотобиологический эффект. Первичные фотохимические продукты (молекулы в электронновозбужденном состоянии, свободные радикалы) крайне неустойчивы и быстро переходят либо в исходные в-ва, либо в устойчивые фотопродукты. 37. Физические аспекты поглощения света молекулами в-ва при протекании фотобиологических процессов. Особенности строения хроматофорных групп, типы электронных переходов. Общая схема фотобиологических процессов. Отдельный фотобиологический процесс представляет собой сложную последовательность различ. стадий: 1. Поглощение энергии фотона хромофорной группой биомолекулы и образование электронно-возбужденных состояний системы 2. Миграция энергии электронного возбуждения 3. Первичный фотофизический акт и появление первичных фотопродуктов 4. Промежуточные стадии, включающие перенос заряда 5. Образование стабильных хим. продуктов 6. Физиолого-биохим. процессы 7. Конечный фотобиологический эффект. Поглощение монохроматического света в-вом описывается законом БугераЛамберта- Бера I = I0e- snl или I = I010- ecl, где I и I0 интенсивности ослабленного образцом и падающего на образец монохроматического света ; l - толщина образца (см); n и c концентрация в-ва в образце, выражаемая соответственно в числе молекул на 1 см3 (1/см3) или в молях на литр (М); коэффициенты s (см2) и e [л/(моль " см)] характеризуют способность молекул исследуемого в-ва поглощать свет данной длины волны и назыв.ся поперечным сечением поглощения и молярным коэффициентом поглощения соответственно. Часто способность образцов поглощать свет количественно оценивают величиной оптической плотности D = ecl = lg (I0 / I ). Зависимость s, e или D от длины волны назыв. спектром поглощения . Способность поглощать свет и положение полосы поглощения определяются прежде всего тем, как связаны м/ду собой в молекулах атомы углерода. Чем длиннее в молекуле система сопряженных двойных связей (система чередующихся двойных и одинарных связей м/ду атомами углерода), тем в более длинноволновой области располагается спектр поглощения Меняя длину волны, можно избирательно возбуждать и фотохимически модифицировать разные биомолекулы. На этом основана избирательность действ. света. Поглощение квантов рентгеновского или гамма-излучения осуществл. не молекулами , а атомами и не зависит от того, в состав каких молекул эти атомы входят. Поэтому поглощение ионизирующего излучения происходит в основном теми элементами, кот. в организме больше. А так как наш организм на 80% состоит из воды, то радиохимические процессы приводят преимущественно к появлению свободных радикалов воды. По закону Бугера-Ламберта-Бера молекулы представляют собой мишени с некоторым эффективным сечением s, при попадании в кот. происходит поглощение кванта света . В фотохимии ввели понятие поперечного сечения фотохимической реакции s = js (см2). Видно, что s меньше s по абсолютному значению, так как j меньше единицы, но форма кривых зависимостей величин s и s от длины волны света одинакова. Зависимость от длины волны называется спектром действия фотохимической реакции. Для нахождения формы спектра действия проводят определение значений s при нескольких длинах волн. При исследовании относительно простых систем, Напр. растворов ферментов, при каждой длине волны регистрируют дозовую кривую инактивации фермента. Скорость фотоинактивации описывается уравнением dn / dt = -I0(1 - e- snl)/ l, где n - концентрация активного фермента. Особенности строения хроматофорных групп. Хромофоры — это функциональные группы, кот. поглощают электромагнитное излучение независимо от того, возникает при этом окраска или нет. Они содержат группировки атомов, содержащие π - электроны или свободные электронные пары гетероатомов, кот. дают свои, характеристические линии поглощения в УФ – области спектра. К хромофорам относят азогруппу —N=N—, нитрогруппу —NO2, нитрозогруппу —N=O, карбонильную группу >С=О. Рисунок : Типы электронных переходов. 38. Фотофизическая дезактивация электронно-возбужденной молекулы. Типы. Характеристика. Фотофизическая дезактивация электронно-возбужденной молекулы может реализоваться различ. путями S0→S1(синглетное сост.) S2 (стрелочки в разные стороны ч/з 1 пустой квадратик)(направление спина остается тем же). Время жизни ~10-8-10-9с Затем происходит отдача избыточной энергии окр. среде. Все молекулы переходят на низший колебательный уровень S0. 1) Безизлучательный переход – тепловая диссипация. 2) Флуорисценция – излучательный переход – свет. 3) Фотохимическая реакция – продукт. 4) Передача Е др. молекуле (трение?). 5) Переход в триплетное возбужденное сост. – интеркомбинационная конверсия – переход ē с превращением спина (стрелочки в одну сторону). Требует большого вложения Е, активация Е барьеров. Переход из триплетного (Т) в S0запрещен или затруднен. Требуется конверсия. Нужна Е и время (~10-4 – 10 с). При дезактивации: 1) безизлучательный переход в S0с образованием спина ē (↑t). 2) Испускание кванта фосфорисценции. 3) Фотохимическая реакция с образованием фотопродукта. 4) Передача Е возбуждения др. молекуле. Люминесценция – это спонтанное излучение тела, избыточное при данной t тела над тепловым излучением, длительность кот. превышает период световых волн. Период св. волн ~ 10- 15c, а длительность min 10-10. Видимый свет, УФ, ИК. Люминесцировать тело может при любой температуре. В-ва, способные люминесцировать – люменофоры. По виду возбуждения (телу не обязательно возбуждаться от света): фосфо, рентген, радио, электро, хемо (хим. реакция), биолюминесценция (реакции Ох в живых системах), катодолюм. (кинескопы, асцилографы), триболюм. (разруш. Кристаллич. тел. 39. Люминесценция. Фосфоресценция, флуоресценция. Классификация видов люминесценции в зависимости от вида возбуждения. Люминесценция – спонтанное излучение тепла, избыточное при данной температуре тела над тепловым излучением, длительность которого значительно превышает период световых волн. Период световых волн составляет 10-15 c, а длительность люминесценции как минимум 10-10 c. Типы люминесценции по длительности свечения: Флуоресценция (10-8 с)- быстрое свечение, кратковременное, остаточное -излучательный переход возбужденного электрона из синглетного сост.-я S1 в основное сост. S0 Фосфоресценция (10-3 – 10-4 с и более) – длительное свечение, продолжительное излучательный переход возбужденного электрона из триплетного сост.-я T1 в основное сост. S0. а) ν люм = ν б) ν люм ˂ ν в) ν люм ˃ ν Основной энергетической характеристикой люминесценции явл. ее энергетический выход η - отношение энергии, кот. люминофором излучается, к энергии, кот. люминофор поглощает: η = E/E0 Люминесцентный анализ по методике иссл-я делится на: • макроанализ • микроанализ • флуоресцентные зонды и метки. Также люминесценцию используют для создания осветительной и регистрирующей аппаратуры (лампы дневного света, экран осциллографа). Классиф. по виду возбуждения: ▪Фотолюминесценция ▪Рентгенолюминесценция ▪Радиолюминесценция ▪Катодолюминесценция ▪Электролюминесценция ▪Хемилюминесценция ▪Биолюминесценция Механизм биохемилюминесценции определяется реакциями окисления. В биологических системах хемилюминисценция возникает при рекомбинации перекисных свободных радикалов липидов. 40. Механизмы люминесценции. Возможные варианты протекания этого процесса. Правило Стокса. Энергетический выход, закон Вавилова. Люминесценция – спонтанное излучение тела, избыточное при данной температуре тела над тепловым излучением, длительность которого значительно превышает период световых волн. Период световых волн составляет 10-15 c, а длительность люминесценции как минимум - 10-10 c. Резонансная люминесценция – характерна для атомов и некот. простых молекул при их возбуждении в газовой фазе. Возвращение атомов из возбужденного в нормальное сост.сопровож-ся излучением кванта люминесценции, равного поглощенному кванту. Обычно у возбужденных атомов происходят те или иные энергетические потери. В рез-те излучаемые кванты меньше поглощаемых и люминесценция имеет большую длину волны. Стоксова люминесценция – При взаимодействии с окружающими атомами возбужденный атом может передать им часть энергии и перейти на уровень 2’, при переходе с которого и происходит люминесценция. Уровень испускания 2’ лежит ниже уровня 2, часть энергии при возбуждении теряется на тепло, а длина волны испущенного света больше, чем поглощенного Антистоксова люминесценция – получается, если квант света поглощен возбужденной молекулой. Длина излучаемой волны меньше длины волны возбуждающего света Правило Стокса: Спектр люминесценции сдвинут относительно спектра вызвавшего его света в сторону больших длин волн. Энергия кванта, вызвавшего возбуждение (hν0 ), при поглощении его в-вом, частично переходит в др.энергии: Основной энергетической характеристикой люминесценции явл. ее энергетический выход η - отношение энергии, кот. люминофором излучается, к энергии, кот. люминофор поглощает: η = E/E0. I – интенсивность люминесцентного излучения, λ – длина волны Энергия кванта, вызвавшего возбуждение (hν0), при поглощении его в-вом частично переходит в др.энергии: hν0 = hνлюм + ΔE Поэтому: hνлюм<hν0, λлюм> λ0. Согласно закону Вавилова энергетический выход люминесценции сначала возрастает пропорционально возрастанию длины волны возбуждающего света, а потом резко падает: η = E/E0 = hν/(hν0) = λ/λ0. (энергетический выход пропорционален длине волны возбуждающего света). 41. Применение люминесценции в биологии и медицине. Люминесцентный анализ - совокупность методов для определения природы и состава в-ва по спектру его люминесценции. • Качественный анализ - определение наличия (или отсутствия) каких-либо в-в (молекул) по форме спектра люминесценции. При этом можно изучать структуру молекул в-ва; межмолекулярное вз-е ; химические превращения. • Количественный анализ - определение кол-ва в-ва по интенсивности спектра люминесценции (можно обнаружить массу вва m = 10-10 г). Если люминофором явл. растворенное в-во, то при невысокой оптической плотности раствора интенсивность люминесценции пропорциональна концентрации раствора. Поэтому по интенсивности люминесценции можно судить о концентрации раствора. Для этого интенсивность люминесценции исследуемого раствора (Ιχ) сравнивают с интенсивностью люминесценции раствора (I0), концентрация которого известна. Неизвестную концентрацию Сх находят по формуле По методике иссл-я люминесцентный анализ можно представить следующей схемой. Макроанализ - наблюдение невооруженным глазом люминесценции объектов, облученных УФ-излучением: - проверка качества и сортировка пищевых продуктов - сортировка фармакологических средств - свечение волос, чешуек, ногтей при диагностике их поражения грибком и лишаем. Микроанализ - иссл-е люминесцирующих микрообъектов при помощи специальных люминесцентных микроскопов, в кот. есть специальный осветитель, содержащий ртутную лампу со светофильтром, пропускающим УФ-излучение. Флуоресцентные зонды. В некот. медицинских иссл-я х применяются специальные люминофоры, вводимые в организм и распределяющиеся по тканям в соответствии со своими свойствами. Такие люминофоры получили название флуоресцентных зондов. Напр., при введении раствора такого люминофора в кровь он разносится по всему организму и диффундирует в дерму и эпидермис. Люминесценция возбуждается длинноволновым ультрафиолетовым излучением и наблюдается в видимом свете. В поверхностных тканях с пониженным кровоснабжением люминесценция появл. позже, чем в тканях с нормальным кровоснабжением. Флуоресцентные метки. Флуоресцирующие молекулы можно ковалентно связывать с определенными молекулами, и затем эту систему вводить в исследуемый объект. Такие молекулы назыв.ся флуоресцентными метками. Примером явл. использование флуоресцентно меченых антител. Если добавить такие антитела к суспензии смеси клеток, то они связываются только с теми из них, на поверхности кот. находятся специфические к данному антителу антигены. Возникает яркая люминесценция определенных клонов клеток, наблюдаемая в люминесцентном микроскопе. Данная методика используется в иммунологических иссл-я х крови. 42. Лазеры. Типы лазеров. Определение. Принцип действия лазера. Инверсная нацеленность. Активная среда. Системы возбуждения. Лазер — это устройство, преобразующее энергию накачки (световую, электрическую, тепловую, химическую и др.) в энергию когерентного, монохроматического, поляризованного и узконаправленного потока излучения. В зависимости от вида активной среды и способа ее возбуждения лазеры несколько условно можно разделить на несколько типов: • твердотельные, рабочим в-вом этих лазеров служат кристаллы или стекла, активированные посторонними ионами. • жидкостные, их активной средой служат растворы органич. соединений, комплексных соединений редкоземельных элементов (Nd, Eu), неорганич. жидкости. • газовые, источником вынужденного излучения в газах служат возбужденные нейтральные атомы, молекулы или слабоионизованная тлеющим электрическим разрядом плазма. • полупроводниковые, активной средой лазеров служат полупроводниковые кристаллы (GaAs, InSb, PlS). Атомы в-ва, поглощая энергию, Напр., при нагревании в-ва, переходят в возбужденное сост.. Их электроны поднимаются на верхний энергетический уровень E1; ч/з какое-то время они вновь опускаются на основной уровень E0, отдавая энергию в виде квантов электромагнитного излучения. Частота излучения определяется разностью энергий этих двух уровней: E1 – E0 = h, где h— Постоянная Планка, — частота излученного фотона. В обычной среде излучение отдельных атомов происходит самопроизвольно, независимо друг от друга, в разные моменты времени и в разных направлениях. Кол-во атомов обычного в-ва в основном состоянии больше, чем в возбужденном. В-во, предназначенное для лазерной генерации, имеет большинство атомов в возбужденном состоянии. Такая ситуация называется инверсной населенностью. Чтобы она осуществилась, атомы в-ва должны непрерывно получать энергию, а их электроны достаточно долго находиться на верхних энерг. уровнях (такие уровни назыв.ся метастабильными). С метастабильного уровня электрон, как правило, не успевает опуститься сам — его «сбрасывает» вниз пролетевший мимо фотон той же частоты. Излученный при этом — вынужденном — переходе фотон имеет ту же фазу, что и исходный. После каждого такого взаимодействия число фотонов удваивается — по в-ву идет лавина вынужденного, или индуцированного, излучения. Лазер состоит из трех основных компонентов: активная среда, в кот. осуществл. инверсная населенность атомных уровней и происходит генерация, система накачки, создающая инверсную заселенность, и оптический резонатор — устройство, создающее положительную обратную связь. Активная среда — смесь газов, паров или растворов, кристаллы и стекла сложного состава. Компоненты активной среды подобраны так, что энергетические уровни их атомов образуют квантовую систему, в кот. есть хотя бы один метастабильный уровень, обеспечивающий инверсную населенность. Система накачки создает в активной среде инверсную заселенность. Почти сразу атомы среды начинают спонтанно излучать фотоны в случайных направлениях. Фотоны, испущенные под углом к оси резонатора, порождают короткие каскады вынужденного излучения, быстро покидающего среду. Фотоны же, испущенные вдоль оси резонатора, отражаются от зеркал и многократно проходят сквозь активную среду, вызывая в ней все новые акты вынужденного излучения. Генерация начинается в тот момент, когда Увелич. энергии волны за счет ее усиления при каждом проходе резонатора начнет превосходить потери, кот. складываются из внутренних потерь (поглощение и рассеяние света в активной среде, зеркалах резонатора и др. элементах) и той энергии, кот. поступает наружу сквозь выходное зеркало. 43. Особенности лазерного излучения. Лазерное излучение по своим свойствам значительно отличается от излучения обычных источников света. Отметим его характерные особенности. 1. Когерентность. Излучение явл. высококогерентным, что обусловлено свойствами вынужденного излучения. При этом имеет место не только временная, но и пространственная когерентность: разность фаз в двух точках плоскости, перпендикулярной направлению распространения, сохраняется постоянной. 2. Коллимированность. Лазерное излучение явл. коллимированным, т.е. все лучи в пучке почти параллельны друг другу. На большом расстоянии лазерный пучок лишь незначительно увелич. в диаметре. Так как угол расходимости мал, то интенсивность лазерного пучка слабо убывает с расстоянием. Это позволяет передавать сигналы на огромные расстояния при малом ослаблении их интенсивности. 3. Монохроматичность. Лазерное излучение явл. в высокой степени монохроматическим, т.е. содержит волны практически одинаковой частоты (ширина спектральной линии составляет Δλ ≈ 0,01 нм). 4. Высокая мощность. С помощью лазера можно обеспечить очень высокую мощность монохроматического излучения - до 105 Вт в непрерывном режиме. 5. Высокая интенсивность. В импульсных лазерах интенсивность лазерного излучения очень высока и может достигать I = 1014-1016 Вт/см2 (ср. интенсивность солнечного света вблизи земной поверхности I = 0,1 Вт/см2). 6. Высокая яркость. У лазеров, работающих в видимом диапазоне, яркость лазерного излучения (сила света с единицы поверхности) очень велика. Даже самые слабые лазеры имеют яркость 1015 кд/м2 (для сравнения: яркость Солнца L ~ 109 кд/м2). 7. Давление. При падении лазерного луча на поверхность тела создается давление (Д). При полном поглощении лазерного излучения, падающего перпендикулярно поверхности, создается давление Д = I/c, где I интенсивность излучения, с - скорость света в вакууме. При полном отражении величина давления в два раза больше. Для интенсивности I = 1014 Вт/см2 = 1018 Вт/м2; Д = 3,3х109 Па = 33 000 атм. 8. Поляризованность. Лазерное излучение полностью поляризовано. 44. Первичные механизмы и биологическое действие лазерного излучения. Под биологическим действием понимают совокупность структурных, функциональных, биофизических и биохим. изменений, кот. возник. в организме под действием лазерных лучей. На атомно-молекулярном уровне происходят: поглощение света; возникновение внутреннего фотоэффекта, электрическая диссоциация ионов, возбуждение атомов и молекул, миграция энергии возбуждения; появление первичных фотопродуктов. На клеточном уровне: изменение активности клеточных мембран; активация ядерного аппарата клеток и систем ДНК-РНК-белок; активация окислительно-восстановительных реакций, процессов фотосинтеза и различ. ферментативных систем, усиление образования макроэргов – АТФ, усиление митотической активности клеток и активация их пролиферации. На тканевом (организменном) уровне: снижение рецепторной чувствительности, снижение длительности фаз воспалительного процесса, отека, и напряжения тканей; усиление поглощения тканями кислорода, Увелич. скорости кровотока, Увелич. числа функционирующих коллатералей, активация транспорта в-в ч/з сосудистую стенку. Биологическое действие зависит от поглощенной дозы лазерного излучения, кот., в свою очередь, зависит от: 1) условий применения (интенсивности, частоты, спектрального состава, режима - импульсного или непрерывного – импульсный режим чаще характеризуется механическим действием, а непрерывный - тепловым, когерентности, монохроматичности, поляризованности); 2) биофизических особенностей ткани (отражающей и поглощающей способности, теплоемкости, акустических и механических свойств). Чаще всего поглощается на глубине 2мм. Действие любого излучения на организм в зависимости от поглощенной дозы можно представить следующим образом: 1. высокие дозы - разрушающее действие; 2. средние дозы – угнетающее действие; 3. малые дозы – стимулирующее действие, 4. Очень маленькие – отсутствие действия. 45. Изменения свойств ткани и ее температуры под действием непрерывного мощного лазерного излучения. Фазы. При повышении температуры до 40 – 60° имеет место активации ферментов, появление отеков, изменения в клетках или их гибель, денатурации белков, начало коагуляции. 60 – 70° – денатурация коллагена, дефекты мембраны. 100° – обезвоживание, выпаривания тканевой воды. > 100° – обугливание и почернение ткани. > 300° – выпаривание ткани и газообразование (прекращается рост температуры). При данной температуре лазера рассекает ткань как скальпель. Степень повышения температуры зависит от глубины ткани. Абляция ткани* под действием интенсивного лазерного излучения (под действием коротких импульсов лазерного излучения непрерывно действующих) Происходит очень быстрый нагрев тканевой жидкости >100°. При этом тканевая жидкость оказывается в нестабильном перегретом состоянии, происходит взрывное вскипание, Резкий разрыв ткани. Температура абляции не больше 100 – 120°, следовательно, не происходит обугливание нагревании близ лежащих тканей. (Напр.: лазерный пиллинг кожи, операция на сетчатке глаза). *В медицине абляция (лат. ablatio отнятие) это направленное разрушение ткани (опухоли, эктопического водителя ритма сердца) без физического удаления ткани. 46.Использование лазерного излучения. Лазерная диагностика. Лазерное излучение в биологии, в терапии и хирургии. Процессы, характеризующие вз-е лазерного излучения (ЛИ) с биообъектами, можно разделить на 3 группы: • невозмущающее воздействие (не оказывающее заметного действия на биообъект); • фотохимическое действие (возбужденная лазером частица либо сама принимает участие в соответствующих хим. реакциях, либо передает свое возбуждение др. частице, участвующей в химической реакции); • фоторазрушение (за счет выделения тепла или ударных волн). Лазерная диагностика Лазерная диагностика представляет собой невозмущающее воздействие на биообъект, использующее когерентность лазерного излучения. Перечислим основные методы диагностики. Голография. С помощью лазерного излучения получают 3-мерное изображение объекта. В медицине этот метод позволяет получать объемные изображения внутренних полостей желудка, глаза и т.д. Лазерная масс-спектроскопия. Этот метод используют для иссл-я химического состава объекта. Мощные пучки лазерного излучения испаряют в-во с поверхности биообъекта. Пары подвергают масс-спектральному анализу, по рез-там которого судят о составе в-ва. Лазерный анализ клеток (крови). Лазерный луч, пропускаемый ч/з узкий кварцевый капилляр, по которому прокачивается специально обработанная кровь, вызывает флуоресценцию ее клеток. Флуоресцентное свечение затем улавливается чувствительным датчиком. Это свечение специфично для каждого типа клеток, проходящих поодиночке ч/з сечение лазерного луча. Подсчитывается общее число клеток в заданном объеме крови. Определяются точные количественные показатели по каждому типу клеток. Метод фоторазрушения. Его используют для иссл-я поверхностного состава объекта. Мощные пучки ЛИ позволяют брать микропробы с поверхности биообъектов путем испарения в-ва и последующего массспектрального анализа этого пара. В биологии: Низкоинтенсивное лазерное излучение стимулирует метаболическую активность клетки. Стимуляция биосинтетических процессов может быть одним из важных моментов, определяющих действие низкоинтенсивного излучения лазера на важнейшие функции клеток и тканей, процессы жизнедеятельности и регенерации (восстановления). В хирургии используются высокоинтенсивные лазеры. Лазерный луч используется в качестве универсального светового скальпеля. При воздействии на биоткань лазерного излучения большой интенсивности происходит ее нагрев, коагуляция, испарение или же абляция. Эти явления используются в лазерной хирургии для рассечения тканей, удаления ее патологических участков, остановки кровотечения, сваривания биотканей. Выбирая должным образом длину волны излучения, его интенсивность и длительность воздействия, можно получать различ. хирургические эффекты. Применение лазерного луча в хирургии обеспечивает избирательное и контролируемое воздействие. Лазерная хирургия имеет ряд преимуществ: • бесконтактность, дающую абсолютную стерильность; • селективность, позволяющую выбором длины волны излучения дозированно разрушать патологические ткани, не затрагивая окружающие здоровые ткани; • бескровность (за счет коагуляции белков); • микрохирургию тканей и клеток, позволяющую, благодаря высокой степени фокусировки луча; • незначительное механическое травмирование прилегающих областей; • точно определенная глубина проникновения в ткань. Укажем некот. области хирургического применения лазеров. Лазеротерапия – лечебное использование оптического излучения, источником которого явл. лазер. В рез-те воздействия лазерного излечения, вследствие поглощения световой энергии возникает ряд фотобиологических процессов. Кратковременное Увелич. концентрации свободного кальция в клетках запускает последующий каскад ответных реакций организма на воздействие: · активируются пролиферативные и метаболические процессы; · нормализуется ф-ция иммунной системы; · улучшается сост. сосудов, в частности, происходит расширение сосудистых стенок; · возникает обезболивающий эффект; · усиливается микроциркуляция; · нормализуется кислородно-транспортная фция крови; · повышается антиоксидантная и протеолитическая активность крови; · стимулируется гемопоэз; · улучшаются обменные процессы; · активируется регенерация тканей; · наблюдается дезинтоксикационное, противовоспалительное и антиаллергическое действие. 47.Рентгеновское излучение. Общие понятия, история открытия. Источники рентгеновского излучения. Рентгеновское излучение (РИ) – это электро-магнитные -3 волны с длиной волны 100 – 10 нм. (Область м/ду УФ и гамма-излучением). Также рентгеновские лучи назыв. Х-лучами. Биологическое воздействие • Рентгеновское излучение явл. ионизирующим. • Воздействует на ткани живых организмов и может быть причиной лучевой болезни, лучевых ожогов и злокачественных опухолей. • При работе с рентгеновским излучением необходимо соблюдать меры защиты. • Считается, что поражение прямо пропорционально поглощенной дозе излучения. • Рентгеновское излучение явл. мутагенным фактором. РИ было открыто Вильгельмом Конрадом Рентгеном. Изучая экспериментально катодные лучи (1895 год) он заметил, что находившийся вблизи катодно-лучевой трубки картон, покрытый платиносинеродистым барием, начинает светиться в темной комнате. В течение нескольких следующих недель он изучил все основные свойства вновь открытого излучения, названного им X-лучами ("икслучами"). 22 декабря 1895 года Рентген сделал первое публичное сообщение о своем открытии в Физическом институте Вюрцбургского университета, чуть позже в журнале Вюрцбургского физико-медицинского общества была опубликована статья Рентгена под названием «О новом типе лучей». Однако еще за 8 лет до этого — в 1887 году Никола Тесла в дневниковых записях зафиксировал рез-ты иссл-я рентгеновских лучей и испускаемое ими тормозное излучение, однако ни Тесла, ни его окружение не придали серьезное значение этим наблюдениям. Кроме этого, уже тогда Тесла предположил опасность длительного воздействия рентгеновских лучей на человеческий организм. Катодно-лучевая трубка, кот. Рентген использовал в своих экспериментах, была разработана Й. Хитторфом и В. Круксом. При работе этой трубки возник. рентгеновские лучи. Это было показано в экспериментах Генриха Герца и его ученика Филиппа Ленарда ч/з почернение фотопластинок. Однако никто из них не осознал значения сделанного ими открытия и не опубликовал своих рез-тов. По этой причине Рентген не знал о сделанных до него открытиях и открыл лучи независимо — при наблюдении флюоресценции, возникающей при работе катодно-лучевой трубки. Рентген, потерявший интерес к Х-лучам, говорил своим коллегам: «Я уже все написал, не тратьте зря время». Свой вклад в известность Рентгена внесла также знаменитая фотография руки Альберта фон Келликера, кот. он опубликовал в своей статье. За открытие рентгеновских лучей Рентгену в 1901 году была присуждена первая Нобелевская премия по физике, причем нобелевский комитет подчеркивал практическую важность его открытия. В других странах используется предпочитаемое Рентгеном название — X- лучи. В России лучи стали называть «рентгеновскими» по инициативе ученика Рентгена — Абрама Федоровича Иоффе. Источники РИ: естественные и искусственные. Естественные: радиоактивные изотопы (40К,55Fe). Искусственные: рентгеновские катодные трубки (трубка Крукса). Трубка Крукса представляет собой катод и анод. Анод расположен под углом. М/ду катодом и анодом высокое напряжение (1 – 500 кВ), там всегда вакуум (Зачем? Чтобы поток электронов происходил с высокой скоростью). Катод – это спираль, кот. нагревается эл.током. Электрон разгоняется с высокой скоростью, попадает на анод. Трубка Крукса: 48. Тормозное рентгеновское излучение, характеристика. Спектр тормозного рентгеновского излучения. Тормозное рентгеновское излучение – излучение, возникающее при торможении электрона в вве анода. Излучение испускается отдельными квантами, энергии кот. связаны с частотой E = hv = hc / λ. Все электроны, достигающие анода, имеют одинаковую кинетическую энергию, равную работе электрического поля м/ду анодом и катодом: Ek = eU. Кинетическая энергия электрона частично передается в-ву и идет на его нагревание (Q), а частично расходуется на создание рентгеновского кванта: eU = Q + hv , или eU = Q + hc / λ. Соотношение м/ду Q и hv случайно. Кванты порожденные различными электронами имеют различ. частоты и длины волн, поэтому спектр тормозного РИ явл. сплошным. Типичный вид спектральной плотности потока тормозного РИ (Фλ = dФ/d λ) λmin=1.23/U Поток (Фλ) тормозного рентгеновского излучения прямо пропорционален квадрату напряжения U м/ду анодом и катодом, силе тока I в трубке и атомному номеру Z в-ва анода: Ф = кZU2I, k 10-9 В-1 Спектры при различ. напряжениях, температурах катода, силах тока, в-в анода будут различаться. 49. Характеристическое рентгеновское излучение, характеристика. Спектр характеристического рентгеновского излучения. Закон Мозли. Характеристическое рентгеновское излучение - это излучение содержащее дискретный набор частот, определяемый материалом анода, и называется характеристическим излучением. Последовательность процесса : Катодные электроны проникают в глубь атомов в-ва анода и выбивают электроны с их внутренних оболочек - образовавшиеся вакантные места заполняются электронами с верхних оболочек- высвечиваются кванты излучения. (Полный спектр- это наложение хар-го спектра на спектр тормозного излучения ) Характеристическое излучение имеет линейчатый спектр, т.е. состоит из закономерно расположенных достаточно узких спектральных линий. Их длины волн зависят исключительно от материала анода, что следует из определения х. излучения. (Характеристическое излучение напоминает линейчатый спектр газов в оптической области.) Закон Мозли (Генри Мозли 1887 – 1915) В 1913 установил, что корень квадратный из частоты характеристического излучения есть линейная ф-ция порядкового номера элемента: (закон Мозли позволяет определить атомный номер хим.элемента по наблюдаемому спетктру х. излучения). 50. Вз-е рентгеновского излучения с в-вом. Закон ослабления. Физические основы использования рентгеновского излучения в биологии и медицине. Существуют два основных типа взаимодействия рентгеновского излучения с в-вом: рассеяние и фотоэффект. При рассеянии направление движения фотона изменяется. При фотоэффекте фотон поглощается. Когерентное (упругое) рассеяние происходит тогда, когда энергия рентгеновского фотона недостаточна для внутренней ионизации атома (выбивания электрона с одной из внутренних оболочек). При этом изменяется направление движения фотона, а его энергия и длина волны не изменяются (поэтому это рассеяние и называется упругим). Некогерентное (комптоновское) рассеяние происходит тогда, когда энергия фотона намного больше энергии внутренней ионизации. При этом электрон отрывается от атома и приобретает некот. кинетическую энергию Ек. Направление движения фотона при комптоновском рассеянии изменяется, а его энергия уменьшается: Комптоновское рассеяние связано с ионизацией атомов в-ва. Фотоэффект имеет место тогда, когда энергия фотона hv достаточна для ионизации атома: hv > Аи. При этом рентгеновский квант поглощается, а его энергия расходуется на ионизацию атома и сообщение кинетической энергии выбитому электрону Ек = hv - АИ. Комптоновское рассеяние и фотоэффект сопровождаются характеристическим рентгеновским излучением, так как после выбивания внутренних электронов происходит заполнение вакантных мест электронами внеш. оболочек. Закон ослабления Рисунок : Ослабление рентгеновского потока в направлении падающих лучей Рассеяние рентгеновских лучей и фотоэффект приводят к тому, что по мере проникновения рентгеновского излучения вглубь первичный пучок излучения ослабляется . Ослабление носит экспоненциальный характер: Ф=Ф0 *exp(-μm*x) где x-глубина проникновения; μлинейный коэфф. Ослабления, равный сумме трех слагаемых, соответствующих когерентному рассеянию (μк), некогерентному (μнк) и фотоэффекту (μф): μ=μк+μнк+μ ф Величина μ зависит от поглощающего материала и спектра излучения. Для практических расчетов в качестве характеристики ослабления используют массовый коэфф. ослабления μm, равный отношению линейного коэфф. Ослабления к плотности в-ва: μm=μ/p. В этом случае закон ослабления записывают в виде: Ф=Ф0 *exp(-μm*px). Расчеты показ., что у одноатомных в-в массовый коэфф. Ослабления опред-ся по формуле μm=kλ^3*Z^3 где λ - длина волны; Z атомный номер элемента; k - некот. константа. Для сложного в-ва массовый коэфф. ослабления находят по его хим. Формуле с исп. μm=kλ^3*Z^3, Так для воды, молек кот сост из двух атомов водорода Z=1 и одного атома кислорода Z=8, μm=kλ^3*(2*1^3 + 1*8^3)=514kλ^3 Физические основы использования рентгеновского излучения в биологии и медицине: Рентгенодиагностика – это методы получения изображения тканей, органов, с использованием РИ. Физической основой этих методов явл. закон ослабления рентгеновского излучения в в-ве. Однородный по сечению поток рентгеновского излучения после прохождения неоднородной ткани станет неоднородным. Эта неоднородность может быть зафиксирована на фотопленке, флуоресцирующем экране или с помощью матричного фотоприемника. Напр., массовые коэффициенты ослабления костной ткани Са3(РО4)2 - и мягких тканей - в основном Н2О - различаются в 68 раз (μm кости /μm воды = 68). Плотность кости также выше плотности мягких тканей. Поэтому на рентгеновском снимке получается светлое изображение кости на более темном фоне мягких тканей. Рентгенодиагностика : 1.Рентгеноскопия Изображение формируется на флуоресцирующем экране. Яркость изображения невелика, и его можно рассматривать только в затемненном помещении. Врач должен быть защищен от облучения. Достоинством рентгеноскопии явл. то, что она проводится в реальном режиме времени. Недостаток - большая лучевая нагрузка на больного и врача (по сравнению с другими методами). Современный вариант рентгеноскопии рентгенотелевидение - использует усилители рентгеновского изображения. Усилитель воспринимает слабое свечение рентгеновского экрана, усиливает его и передает на экран телевизора. В рез-те резко уменьшилась лучевая нагрузка на врача, повысилась яркость изображения и появилась возможность видеозаписи рез-тов обследования. 2.Рентгенография - Изображение формируется на специальной пленке, чувствительной к рентгеновскому излучению. Снимки производятся в двух взаимно перпендикулярных проекциях (прямая и боковая). Изображение становится видимым после фотообработки. Готовый высушенный снимок рассматривают в проходящем свете. При этом удовлетворительно видны детали, контрастности кот. отличаются на 1-2 %. В некот. случаях перед обследованием пациенту вводится специальное контрастное в-во. Напр., йодсодержащий раствор (внутривенно) при исследовании почек и мочевыводящих путей. где λ - длина волны; Z - атомный номер элемента; k - некот. константа. Достоинствами рентгенографии являются высокое разрешение, малое время облучения и практически полная безопасность для врача. К недостаткам относится статичность изображения (объект нельзя проследить в динамике). 3.Флюорография - При этом обследовании изображение, полученное на экране, фотографируется на чувствительную малоформатную пленку. Флюорография широко используется при массовом обследовании населения. Если на флюорограмме находят патологические изменения, то пациенту назначают более детальное обследование. 4.Ангиография - Этот метод применяется при обследовании кровеносных сосудов. Ч/з катетер в вену вводится контрастное в-во, после чего мощный рентгеновский аппарат выполняет серию снимков, следующих друг за другом ч/з доли секунды. 1, 2, 3, 4 – разница по плотности м/ду в-вами = 10 – 20%. 5.Рентгеновская компьютерная томография - Этот вид рентгеновского обследования позволяет получить изображение плоского сечения тела толщиной несколько мм. При этом заданное сечение многократно просвечивается под разными углами с фиксацией каждого отдельного изображения в памяти компьютера. Затем осуществл. компьютерная реконструкция, рез-том кот. явл. изображение сканируемого слоя. Разница по плотности м/ду в-вами = 1%. Рентгенотерапия: использование рентгеновского излучения для уничтожения злокачественных образований. Биологическое действие излучения заключается в нарушении жизнедеятельности особенно быстро размножающихся клеток. Очень жесткое рентгеновское излучение (с энергией фотонов примерно 10 МэВ) используется для разрушения раковых клеток, находящихся глубоко внутри тела. Для уменьшения повреждений здоровых окружающих тканей пучок вращается вокруг пациента таким образом, чтобы под его воздействием все время оставалась только поврежденная область. В науке: рентгеноструктурный анализ белков и нуклеиновых кислот 51. Радиоактивность. История открытия. Основной закон радиоактивного распада. Постоянная распада. Период полураспада. Активность. *Эрнест Резерфорд (18711937) – «отец ядерной физики»; обнаружил сложный состав радиоактивного излучения. Опыт: радиоактивный препарат помещали на дно узкого канала свинцового цилиндра, напротив помещалась фотопластинка. На выходившее из канала излучение действовало магнитное поле; вся установка - в вакууме. В магнитном поле пучок первичного излучения распадался на три части: две отклонялись в противоположные стороны, что указывало на наличие у них противоположных зарядов (―+‖назвали альфа-лучами,―-‖бета-лучами), третья часть не отклонялась, т.е. частицы нейтральные по заряженности (гамма-лучи). Рассчитал заряд одной α-частицы: измерял число испускаемых частиц за опр. время (помещая счетчик Гейгера на их пути), отдельно измерял заряд частиц, испущенных за то же время (с пом. электрометра) >рассчитал заряд одной частицы, кот. оказался равен двум элементарным. Установил, что на один элементарный заряд приходятся две атомные единицы массы. Т.о., при заряде, равном двум элементарным, αчастица имеет четыре атомные единицы массы, =>α-излучение - это поток ядер гелия. Открыл возможность превращения одних хим. эл-тов в др.в рез-те РА распада. Открыл закон радиоактивного распада. Антуан Анри Беккерель (1852 — 1908) случайно открыл радиоактивность во время работ по иссл.-ю фосфоресценции в солях урана: завернул флуоресцирующий материал в фотопластинки, чтобы защитить от солн. света до проведения опыта, и еще до опыта обнаружил, что они оказались засвечены. Это побудило его к иссл.-ю спонтанного испускания ядерного излучения, за что вместе с Кюри получил Нобелевку. Пьер Кюри (1859-1906) Мария Склодовская-Кюри (1867-1934) - Совместно открыли эл- ты радий и полоний. Проводили сравнение соединений урана, полученных из разных месторождений, по интенсивности их радиоактивности. Мария активно способствовала применению радиологии в медицине. (*-не по лекциям) Радиоактивность способность некот. атомных ядер самопроизвольно (спонтанно) превращаться в др.ядра с испусканием частиц • Протоны, нейтроны – нуклоны • Кол-во протонов в ядре – Z (порядковый номер хим. элемента) • Кол-во нуклонов в ядре – массовое число – А • Изотопы – ядра с одинаковым порядковым номером и различными массовыми числами (хим.свойства одинаковые, физ. свойства могут различаться) Постоянная распада (λ)– вероятность того, что ядро данного изотопа распадется за ед. времени. dP = λdt - вероятность распада за малое время dt N = N0 exp (- λt ):N0 – число ядер радиоактивного изотопа в начальный момент времени (t=0), N – число ядер, оставшиеся к моменту времени t Основной закон радиоактивного распада:Число радиоактивных ядер убывает со временем по экспоненциальному закону. Период полураспада (Т) – время, в течение которого распадается половина радиоактивных ядер. N = N02-t/T T = ln2/λ = 0.693/λ (Убывание кол-ва ядер исходного в-ва при радиоактивном распаде) Активность– число ядер радиоактивного препарата, распадающихся за ед. времени: А = dN‘/dt Ед.изм. (СИ) – беккерель (Бк); 1 Бк – один акт распада за 1 секунду Внесистемная ед.изм. – кюри (Ки); 1г 226Ra : 1 Ки = 3,7▪1010 Бк 52. Основные виды радиоактивного распада. Характеристика. Основные виды распада: α - распад это самопроизвольное превращение ядер с испусканием α частиц. При этом массовое число ядра уменьшается на 4, а атомный номер— на 2. Идет по схеме: Скорость вылетающих из ядра α частиц от 12 до 20 тыс. км/с. Являются самыми тяжелыми частицами и имеют наименьший пробег. Однако при попадании в живую систему вызывают сильный негативный эффект. β- - распад - электронный распад обычно происходит у нейтронно-избыточных ядер, идет по схеме: β- частицы вылетают со скоростью 270 тыс км/с. Естественных β –распадов не очень много ( пример К40). β+ распад – позитронный распад заключается в превращении одного протона в нейтрон и позитрон по схеме: Если позитрон встречается с электроном, происходит аннигиляция – уничтожение в рез-те выделяется два γ кванта. Данный вид распада всегда сопровож-ся γ излучением. γ кванты имеют электромагнитную природу. Длина волны ~ 10-10м. Проникают глубоко в ткани. Вызывают ионизацию молекул. Переводят атомы в возбужденное сост., а это вызывает образование продуктов типа ионов или свободных радикалов. 53.Количественные характеристики взаимодействия ионизирующего излучения с в-вом (линейная тормозная способность в-ва, линейная плотность ионизации, средний линейный пробег). Заряженные частицы, распространяясь в в-ве, взаимодействуют с электронами и ядрами, в рез-те чего изменяется сост. как в-ва, так и частиц. Основным механизмом потерь энергии заряженной частицы (α и β) при прохождении ч/з в-во явл. ионизационное торможение. При этом ее кинетическая энергия расходуется на возбуждение и ионизацию атомов среды. Вз-е частицы с в-вом количественно оценивается линейной плотностью ионизации, линейной тормозной способностью в-ва и средним линейным пробегом частицы Линейная плотность ионизации (i). Эта величина показывает число ионов одного знака, образованных ионизирующей частицей или фотоном на элементарном пути. Наибольшей линейной плотностью ионизации обладает α-излучение, поскольку оно образовано тяжелыми ядрами гелия и обладает большой кинетической энергией. Величина линейной плотности ионизации пропорциональна энергии излучения. Линейная тормозящая способность (S) – энергия, теряемая частицей на ед. пути в в-ве. Средний линейный пробег (R). Величина, отражающая проникающую способность излучения. Самым проникающим излучением явл. γ- излучение. Средний пробег в воздухе 300м., в тканях – 1 метр. Чем больше линейная плотность ионизации, тем больше линейная тормозящая способность и тем меньше средний линейный пробег. - частицы – заряжены и сравнительно медленно движутся, следовательно, много времени проводят рядом с атомами в-ва и ионизируют их, следовательно, в в-ве плотные скопления ионов и электронов. Но глубина проникновения небольшая (около 40 мкм). - частицы – движутся быстрее, следовательно, ионизация проходит в меньшей степени, следовательно, остается разреженное скопление ионов и электронов. Наибольшая ионизация – к концу пути. Глубина проникновения больше (до нескольких мм). 54. Биофизические основы действия ионизирующего излучения. Основные стадии. Общие закономерности биологической стадии. Биологическое действие ионизирующих излучений - изменения, вызываемые в жизнедеятельности и структуре живых организмов при воздействии коротковолновых электромагнитных волн (рентгеновского излучения и гамма-излучения) или потоков заряженных частиц (альфа-частиц, бетаизлучения, протонов) и нейтронов. Основные стадии: 1) физическая (передача энергии излучения молекулам в биологическом смысле), их ионизация и возбуждение. Длительность: 10-16 – 10-13 сек. 2) Физико-химическая (различного рода реакции перераспределение избыточной энергии возбужденных молекул и ионов, запускаются разного рода химич реакции. 1013 – 10-10 сек. 3) Химические взаимодействия радикалов и ионов м/ду собой и с окружающими молекулами, происходят структурные повреждения, изменяются биологич свойства. 10-6 – 10-3 сек. 4) Биологическая (повреждение молекул клеточной структуры, вызывая этим апоптозы, некрозы, тканевые и органные повреждения, кот могут передаваться по наследству.) длительность: несколько мин – десятки лет. Особенности: 1) Глубокие нарушения жизнедеятельности вызываются ничтожно малыми кол-вами поглощаемой энергии. Так, энергия, поглощенная телом млекопитающего животного или человека при облучении смертельной дозой, при превращении в тепловую привела бы к нагреву тела всего на 0,001°С. 2) Не ограничивается подвергнутым облучению организмом, но может распространяться и на последующие поколения, что объясняется действием на наследственный аппарат организма. 3) Для Б. д. и. и. характерен скрытый (латентный) период, т. е. развитие лучевого поражения наблюдается не сразу. Продолжительность латентного периода может варьировать от нескольких мин до десятков лет в зависимости от дозы облучения, радиочувствительности организма. Так, при облучении в очень больших дозах (десятки тыс.рад) можно вызвать "смерть под лучом", длительное же облучение в малых дозах ведет к изменению сост.-я нервной и других систем, к возникновению опухолей спустя годы после облучения 55. Естественная и искусственная радиоактивность. Примеры. Естественная радиоактивность – радиоактивность изотопов, существующих в природе или радиоактивность, кот. образуется в каких-то природных процессах. Естественные радиоактивные в-ва: 210 Pb (свинец) и 210 Po (Полоний) – в рыбе и других продуктах морей, в растениях, лишайниках, северных оленях, питающихся этими лишайниками. Радон 222 – половина от всей естественные радиации. Хорошо растворим. Присутствует в озерах реках. Калий 40 – поступает в корневую систему растений. 15 % естественного излучения – космическое излучение, где главную роль играет изотоп углерода 14. Оно обуславливает долголетие людей, живущих в горах. Искусственная радиоактивность – радиоактивность, кот. возникает в рез-те деятельности человека. Ядра, обладающие искусственной радиоактивностью, получают путем бомбардировки стабильных ядер тяжелыми частицами: а-частицами, нейтронами, реже протонами и др. При этом ядерные превращения происходят в два этапа. Сначала бомбардирующая частица, попадая в ядро, вызывает его превращение в промежуточное нестабильное (радиоактивное) ядро. Затем образовавшееся радиоактивное ядро самопроизвольно испускает частицу и превращается либо в стабильное, либо в новое радиоактивное ядро. Принципиального различия м/ду естественной и искусственной радиоактивностью нет, и законы радиоактивного превращения в обоих случаях одинаковы.