Горобец Алена
advertisement

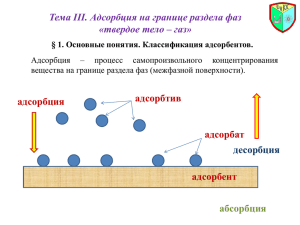
Всероссийский конкурс научно-исследовательских работ имени Д.И. Менделеева ИССЛЕДОВАНИЕ АДСОРБЦИОННОЙ СПОСОБНОСТИ НЕКОТОРЫХ АДСОРБЕНТОВ Горобец Алена Сергеевна, обучающаяся 9 класса МБОУ СОШ № 9 станицы Новосергиевской МО Крыловский район Краснодарского края Научный руководитель: Дзюба Оксана Александровна, учитель химии высшей категории ст. Новосергиевская 2018 Оглавление. Введение …………………………………………………………...…………………....…... 2 Глава 1. Обзор источников информации по теме исследования………...………….……. 3 1.1. Адсорбция как явление……….…………………………………………....….... 3 1.2. Классификация адсорбции……………………………………….…...….…….. 4 1.3. Механизм адсорбции……………………………………………...…….........… 5 1.4. Виды адсорбентов и их характеристики…………………………………….…7 1.5. Применение адсорбции в жизни человека.……………………………............ 8 1.6. Роль адсорбции в природе. …………………………….…………………….. 11 Глава 2. Методика проведённых исследований……………………………..…………... 13 2.1. Исследование адсорбционной способности адсорбентов.………………..…13 2.1.1. Поглощение растворённых в воде веществ поверхностью различных адсорбентов……………………………………………………………….…………13 2.1.2. Поглощение газообразных веществ поверхностью различных адсорбентов……………………………………………………………………….…13 2.1.3. Поглощение активированным углем оксида серы (IV)……………………13 2.2. Влияние природы растворителя на адсорбционные свойства активированного угля.……………………………………………………………... 14 2.3. Избирательная адсорбция газов активированным углем.……….……..….... 14 2.4. Влияние площади поверхности адсорбента на его адсорбционные свойства…………………………………………………………………….………...14 Заключение ……………………………………………………………………………........ 15 Список использованных источников …………………………………………………….. 16 Приложения ………………………………………………………………………..………. 17 Приложение 1 ………………………………………………………..…………….. 18 Приложение 2 …………………………………………………………………...…. 19 Приложение 3 …………………………………………………………………….... 20 Приложение 4 ………………………………………………………………..…….. 21 Приложение 5 ……………………………………………………………………… 22 Приложение 6 …………………………………………………………………..….. 23 1 Введение. Вы никогда не задумывались «Почему одежда маляра пахнет краской, кондитера – ванилью, а продавца парфюмерного магазина – духами?». С физико­химическим явлением, о котором сейчас пойдет речь, знаком, наверное, каждый, хотя, может быть, не все знают, что оно называется адсорбцией. Выбранная мною тема исследования является актуальной, так как адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с адсорбентами, по которым перемещаются водные и газовые растворы. Лёгочная ткань подобна адсорбенту ­ носителю, на котором удерживается гемоглобин крови, обеспечивающий перенос кислорода в организм. Многие функции биологических мембран живой клетки связаны со свойствами их поверхности, так, например, общая площадь биологических мембран в организме человека достигает десятков тысяч квадратных метров. Даже такие наши чувства, как обоняние и вкус, зависят от адсорбции молекул соответствующих веществ в носовой полости и на языке. Явление адсорбции изучено учёными-химиками достаточно хорошо. Поглощающая способность угля была подмечена ещё в XVIII веке. Однако лишь в 1915 году Н.Д. Зелинский, русский химик-органик, разработал способ получения активных углей, предложив их в качестве универсальных поглотителей отравляющих веществ, и совместно с Э.Л. Кумантом сконструировал угольный противогаз. Наука не стоит на месте, поэтому в настоящее время имеется большое количество адсорбентов, обладающих различной адсорбционной активностью. Итак, что такое адсорбция? Какие вещества называются адсорбентами? Какие вещества обладают высокой адсорбционной способностью и почему? Как используется это явление в быту и промышленности? Как ещё можно использовать это явление? Ответить на все эти вопросы мне поможет моя исследовательская работа. Гипотезой моего исследования явилось предположение о том, что адсорбционные свойства адсорбентов различны и зависят от некоторых факторов. Цель: исследовать и сравнить адсорбционную способность различных адсорбентов. Для достижения цели поставлены задачи: • изучить литературу по данной теме; • сравнить адсорбционную способность различных адсорбентов; • выявить факторы, влияющие на адсорбционную способность адсорбентов; 2 • найти примеры практического применения адсорбентов в промышленности и быту; • проанализировать все результаты и сделать соответствующие выводы. Объект исследования: твёрдые вещества - адсорбенты. Предмет исследования: адсорбционная способность различных адсорбентов. Методы исследования: поисковый (сбор информации по теме); лабораторное исследование; анализ и систематизация собранной информации. Глава 1. Обзор источников информации по теме исследования. 1.1. Адсорбция как явление. Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды ещё на заре человеческого общества. В конце XVIII века Карл Шееле обнаружил способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция (от лат. ad-на, при и sorbeo-поглощаю) - это концентрирование различных веществ на поверхности раздела двух систем (твердое вещество - жидкость, твердое вещество - газ, жидкость - газ, жидкость - жидкость). Проще говоря – это поглощение жидкостью либо поверхностью твёрдого тела газов, твёрдых частичек, либо растворенных веществ какого-нибудь вещества. Адсорбирующие вещества характеризующие способности вещества впитывать жидкость и поглощать вредоносные токсические вещества. Вещество, которое удерживает на своей поверхности частицы за счёт межмолекулярных сил вблизи этой поверхности, называется адсорбентом. Вещества, которые адсорбируются, являются адсорбатами, или адсорбтивами. В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы — поры, которые условно могут быть разделены на макропоры (более 2×10-4 мм), переходные поры (6×10-6-2×10-4 3 мм), микропоры (2×10-6-6×10-6 мм). Характер процесса адсорбции определяется размером пор. Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента. Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью. В промышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.) а также синтетические ионообменные смолы (иониты) [1]. 1.2. Классификация адсорбции. В зависимости от природы адсорбционных сил различают физическую и химическую адсорбцию (хемосорбция). Адсорбция физическая химическая (хемосорбция) - молекулы сохраняют - молекулы теряют свою индивидуальность; свою индивидуальность; - обратима; - необратима; - уменьшается с ростом - увеличивается с ростом температуры. При физической температуры. адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей, а при хемосорбции — за счет образования химической связи. В результате физической адсорбции молекулы адсорбата сохраняют свои индивидуальные особенности. Физическая адсорбция обратима, малоспецифична, т.е. в незначительной степени зависит от природы адсорбата, не локализована (адсорбированные молекулы в состоянии передвигаться по поверхности адсорбента), 4 может привести к образованию нескольких адсорбционных слоев и уменьшается с ростом температуры. За счет физической адсорбции осуществляется, например, адсорбция паров воды. При хемосорбции молекулы адсорбата образуют с адсорбентом поверхностные химические соединения. Хемосорбцию следует рассматривать как химическую реакцию на поверхности раздела фаз, а применительно к дисперсным системам – между фазой и средой. Между физической и химической адсорбцией существует много промежуточных случаев, обусловленных образованием водородных связей, электростатическими силами взаимодействия между ионами, диполями или квадруполями и другими причинами в зависимости от химической природы молекул адсорбтива и адсорбента. Значительная часть промежуточных случаев вызвана специфической адсорбцией, которая определяется химической природой молекул адсорбата и адсорбента. Кроме того, адсорбция зависит от геометрии поверхности раздела — в случае плоской поверхности речь идет об адсорбции на самой поверхности, а для пористой поверхности — об адсорбции в порах адсорбента. Адсорбционные свойства адсорбентов зависят от химического состава и физического состояния поверхности, от характера пористости и поверхности. [1] 1.3. Механизм адсорбции. Адсорбция может протекать на поверхностях раздела: твердое – газ; твердое – жидкость; жидкость – газ; жидкость – жидкость. Адсорбция идет самопроизвольно и обусловлена снижением поверхностного натяжения. Поверхностное явление адсорбции может сопровождаться тепловыми эффектами, связанные с выделением или поглощением тепла. Тепло выделяется при образовании новой поверхности раздела фаз. Адсорбция лежит в основе очистки, осушки, разделения газов и других процессов. У любого твердого тела отдельные его частицы (атомы, молекулы или ионы) расположены в известном порядке. При этом частица внутри тела находится в иных условиях, чем расположенная на его поверхности. Действительно, частица А окружена другими такими же частицами равномерно со всех сторон. Ее внешнее силовое поле, следовательно, со всех сторон одинаково компенсировано подобными же полями соседних частиц. В ином положении находится частица Б, так как ее поле с внешней стороны не компенсировано. Поэтому на поверхности остается свободное силовое поле, за счет которого к твердому телу и могут притягиваться частицы тех или других веществ из соприкасающегося с ним газа или раствора. 5 Сила адсорбционного поля и его характер определяются природой данного адсорбента (поглотителя) и расположением частиц на его поверхности. Кроме того, адсорбционная способность зависит и от величины поверхности. Поэтому понятно, что отдельные адсорбенты могут очень сильно отличаться друг от друга по своей поглотительной способности как количественно, так и качественно. Следует отметить, что не существует особых сил, вызывающих адсорбцию. Адсорбция молекул на поверхности твердого тела происходит за счет сил притяжения со стороны поверхностных частиц. Атомы, молекулы или ионы на поверхности адсорбента находятся в ином окружении, чем внутри объемной фазы, поскольку, по крайней мере, с одной стороны у них нет соседей. Газ можно представить как множество молекул, движущихся свободно по всем направлениям. Если в сосуд, в котором находится газ, поместить адсорбент, то во время своего движения часть молекул может удариться о поверхность адсорбента и остаться на ней на некоторое время. Продолжительность пребывания молекул на поверхности и величина адсорбции зависят от таких факторов, как природа поверхности и самой молекулы, а также температура и число молекул, ударяющихся о поверхность (пропорционально давлению газа). В случае тонкодисперсного или пористого твердого тела влияние поверхности может быть весьма значительным [1]. Величина адсорбции зависит от природы адсорбента и состояния его поверхности, природы адсорбтива, температуры, концентрации адсорбтива в окружающей среде и природы растворителя (если адсорбтив является растворимым веществом). Зависимость величины адсорбции от природы адсорбента и состояния его поверхности изучена пока недостаточно. Результаты формулируются так: полярные адсорбенты лучше адсорбируют полярные вещества; неполярные адсорбенты лучше адсорбируют неполярные молекулы. Поскольку при адсорбции из растворов молекулы растворителя и растворенного вещества являются конкурентами за место на адсорбционном центре, для адсорбции неполярного вещества из полярного растворителя следует применять неполярные адсорбенты (например, из водного раствора неполярные органические вещества хорошо адсорбируются неполярным активированным углем). Температура влияет на величину адсорбции следующим образом: чем выше температура, тем активнее броуновское движение молекул, тем больше десорбция и меньше адсорбция. [2]. 6 1.4. Виды адсорбентов и их характеристики. В качестве адсорбентов применяются пористые твёрдые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы— поры, которые условно могут быть разделены на макропоры (более 2×10-4 мм), переходные поры (6×10-6-2×10-4 мм), микропоры (2×10-6-6×10-6 мм). Характер процесса адсорбции определяется размером пор. Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента. Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью. В промышленности в качестве поглотителей применяют, главным образом, активные угли и минеральные адсорбенты (силикагель, цеолиты и др.), а также синтетические ионообменные смолы (иониты). Активные угли. Высокопористые активные угли получают путём сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Для повышения активности углей в них часто перед обугливанием вводят активирующие добавки (растворы хлористого цинка, кислот, щелочей и др.). Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть. Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путём обработки раствора силиката натрия минеральными кислотами или кислыми растворами их солей. Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей. 7 Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д.И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм. Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются ионообменные смолы, активированные минералы и органические вещества и др. [3] 1.5. Применение адсорбции в жизни человека. Самым общедоступным адсорбентом является уголь активированный, который потребляют вовнутрь при многообразных заболеваниях желудочно-кишечного тракта, при наличии хронических аллергических и инфекционно-воспалительных процессов с целью очистки организма от токсических веществ. Какие вещества можно удалить из организма при помощи активированного угля? Уголь активированный употребляют вовнутрь с целью очистки организма от каких-либо вредоносных веществ. При проведении кратковременных курсов принятия угля организм на самом деле очищается от вредоносных компонентов. К тому же даже значительные дозы угля активированного (к примеру, при совершении промывания желудка за один раз используют до 30,0 грамм данного препарата) не способствует передозировке. Однако при долговременном или слишком частом принятии угля активированного он способен устранять из желудочно-кишечного тракта различные витамины, которые нужны организму для правильного обмена веществ и энергии, что в конечном итоге приведет к понижению иммунитета и расстройствам обмена веществ. В таких случаях вдобавок могут быть устранены также ферменты, необходимые для процесса пищеварения, и пища в зоне кишечника начнет аномально разлагаться, т.е. посредством гниения. Это может вызвать глушение полезной микрофлоры и стремительное развитие микрофлоры условно-патогенной, которая способна в любое время в стенке кишечника вызвать какой-нибудь воспалительный процесс. Данное состояние имеет название дисбактериоз. [4] 8 При долговременном использовании угля активированного могут ликвидироваться полезнейшие компоненты из крови в результате их адсорбции через ворсинки слизистой кишечника. Подобным способом могут быть из крови устранены необходимые минеральные компоненты — магний и калий (от этого может пострадать, прежде всего, мышца сердечная) и кальций (он активно участвует в клеточном обмене веществ). Уголь активированный может непрерывно из организма устранять определенную часть пищевых компонентов — жиров, белков и углеводов. При недостаточном количестве белков явно понижается иммунитет, ногти и волосяной покров становятся ломкими, кожный покров стареет быстро, страдают различные внутренние органы, клеткам которых неизменно необходимы белки, а также иммунитет. Как упоминалось ранее, адсорбционные свойства угля нашли применение в конструирование противогаза. Русский химик-органик, академик АН СССР Николай Дмитриевич Зелинский совместно с инженером Кумантом создал противогаз. [5] В период с 1914-1918 годов Зелинский разработал средство защиты от боевых отравляющих веществ — угольный противогаз. 22 апреля 1915 в районе Ипра на стыке французского и британского фронтов немцы осуществили первую газобалонную химическую атаку. В результате из 12 тысяч солдат в живых осталось только 2 тысячи. 31 мая подобную атаку повторили на русско-германском фронте под Варшавой. Потери среди солдат были огромны. Николай Зелинский поставил задачу отыскать надежное средство защиты от отравляющих газов. Понимая, что для универсального противогаза нужен универсальный поглотитель, для которого был бы совершенно безразличен характер газа, Зелинский пришел к идее использовать обыкновенный древесный уголь. Он вместе с В. С. Садиковым разработал способ активирования угля путем прокаливания, что значительно увеличило его поглотительную способность. В июне 1915 года на заседании противогазовой комиссии при Русском техническом обществе Зелинский впервые доложил о найденном им средстве. В конце 1915 инженер Э. Л. Кумант предложил использовать в конструкции противогаза резиновый шлем. Из-за преступной задержки с внедрением противогаза по вине командования армии только в феврале 1916 после испытаний в полевых условиях он, наконец, был принят на вооружение. К середине 1916 года было налажено массовое производство противогазов Зелинского-Кумманта. Всего за годы Первой мировой войны в действующую армию было направлено более 11 миллионов противогазов, что спасло жизнь миллионам русских солдат. 9 Гидрат окиси алюминия повышает активность выведения через кишечник фосфатов. Аморфный белый рыхлый порошок, в воде нерастворим; растворим в процессе нагревания в растворах едких щелочей и разбавленных кислотах. Использование: адсорбент, обволакивающее, антацидное средство, используется вдобавок в форме присыпок, является одним из компонентов препарата «Маалокс» и «Алмагель», «Смекта». Употреблять наружно — с целью присыпок, вовнутрь — при высокой кислотности сока желудочного, а вдобавок при отравлении организма токсическими веществами. Адсорбция лежит в основе клинического анализа крови на СОЭ (скорость осаждения эритроцитов). Так, при инфекционных заболеваниях в крови происходит обменная адсорбция: вместо ионов электролитов поверхность эритроцитов занимают молекулы белков. При этом заряд эритроцитов понижается и они быстрее объединяются и оседают. Хорошей адсорбирующей способностью обладает клетчатка. Содержание клетчатки у больных сахарным диабетом должно быть не меньше 25 г/1000 ккал: клетчатка замедляет всасывание сахаров, компенсируя повышение концентрации глюкозы в плазме после приема пищи. На основе оксида кремния создан препарат полисорб – неселективный полифункциональный энтеросорбент. Его применяют для выведения из организма патогенных бактерий и их токсинов, пищевых аллергенов, солей тяжелых металлов, радионуклидов, этанола, а также ядов различного происхождения. Силикагель - это гранулированная, стекловидная форма диоксида кремния. Силикагель представляет собой высушенный гель, образующийся из пересыщенных растворов кремниевых кислот. Является высокопористым, образованным мелкими частицами сферической формы, веществом. Силикагель имеет множество полезных свойств как осушитель. Благодаря этим уникальным свойствам, он находит применение в различных областях промышленности. Когда мы открываем какой-нибудь новый ноутбук, телевизор, новую одежду или коробку с обувью, даже некоторые продукты питания, мы можем увидеть маленькие бумажные пакеты, с мелкими гранулами. Эти гранулы – силикагель, осушитель, который дает превосходные результаты для удаления влаги. Силикагель приходит на помощь и любителям кошек. Использование диоксида кремния в кошачьих наполнителях для туалета является новейшим продуктом на рынке. Этот продукт действительно уникален и экономичен. Он отлично впитывает 10 влагу. Слой силикагеля в 3-5 см на дне кошачьего лотка и запах исчезнет на 2-3 недели. Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с адсорбентами, по которым перемещаются водные и газовые растворы. Легочная ткань подобна адсорбенту - носителю, на котором удерживается гемоглобин крови, обеспечивающий перенос кислорода в организм. Многие функции биологических мембран живой клетки связаны со свойствами их поверхности, так, например, общая площадь биологических мембран в организме человека достигает десятков тысяч квадратных метров. [6] 1.6. Роль адсорбции в природе. Адсорбционные процессы имеют как теоретическое, так и практическое значение, так как широко распространены в природе. Гетерогенный катализ тесно связан с адсорбцией. Легче всего реагенты адсорбируются на активных центрах твердого катализатора, где имеется избыток свободной поверхностной энергии. В некоторых случаях на этих участках может произойти хемосорбция с образованием поверхностных соединений. Все это приводит к предварительному ослаблению отдельных химических связей реагентов и облегчает дальнейшее их превращение (уменьшает энергию активации реакции). Для изменения ионного состава природных вод методом ионного обмена используют природные алюмосиликаты (цеолиты) или искусственно получаемые высокомолекулярные соединения – ионообменные смолы или иониты. Это нерастворимые в воде твердые вещества от желтого до черного цвета, изготавливаемые в виде зерен размером 0,2...2,0 мм. Катиониты – это ионообменные смолы, способные к обмену катионами между смолой и раствором. Аниониты же способны к обмену с раствором анионами. Чем больше активных групп содержит ионит, тем выше его ионообменные свойства. Очистка воды ионитами имеет большое значение при питании котлов высокого давления, а также в ряде производств, где требуется исправление ионного состава растворов – в ликеро-водочной промышленности, сахарной промышленности, пивоварении, производстве фототоваров и лекарственных препаратов и другие. Существенную роль они играют в винодельческой и молочной промышленности. С их помощью удаляют ионы Fe3+, Cu2+ и Са2+, которые вызывают помутнение вин. При удалении Са2+ из коровьего молока его свойства приближаются к свойствам женского молока, пригодного для питания грудных детей. 11 Действие почвенного поглощающего комплекса (ППК), состоящего в основном из почвенных коллоидов, основано на явлении адсорбции. Высокоразвитая поверхность их обуславливает наличие избытка свободной поверхностной энергии, изза чего ППК обладает способностью поглощать и удерживать питательные вещества. Затем, в результате ионообменной адсорбции, эти вещества могут десорбироваться в почвенный раствор и усваиваться растениями. Минеральные и органические почвенные коллоиды адсорбируют из почвенного раствора катионов растворенных электролитов. Поэтому способность почвы поглощать и удерживать питательные вещества измеряется параметром емкости катионного обмена (ЕКО). ЕКО – это количество моль-эквивалентов катионов, поглощаемых 1 кг воздушно сухой почвы. Некоторые анионы также удерживаются в составе почвы (гидрофосфат-ионы и сульфат-ионы). Однако это происходит по механизму эквивалентной адсорбции. Сначала почвенные коллоиды адсорбируют катионов. Затем поглощенные катионы притягивают из раствора и удерживают тех анионов, с которыми образуют малорастворимые соединения. Адсорбция играет чрезвычайно важную роль в биологических процессах. Роль адсорбции обусловлена наличием в организме большого количества различных поверхностей раздела – поверхности клеток, стенок сосудов, коллоидных частиц протоплазмы и поверхности раздела между организмом и средой. Действие ферментов также начинается с адсорбции субстрата на ферменте [6]. Выводы по главе 1. Изучив теоретические аспекты по теме моей исследовательской работы, я пришла к следующим выводам: 1. Адсорбция – это процесс поглощения вещества из раствора или газа поверхностным слоем жидкости или твердого тела, при котором происходит повышение концентрации одного вещества у поверхности другого вещества. 2. В зависимости от природы адсорбционных сил различают физическую и химическую адсорбцию. 3. В качестве адсорбентов применяются пористые твёрдые вещества с большой удельной поверхностью. В промышленности, главным образом, используют активные угли и минеральные адсорбенты (силикагель, цеолиты и др.), а также синтетические ионообменные смолы (иониты). 4. Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. 12 Глава 2. Методика проведённых исследований. Для проведения исследований я использовала следующие адсорбенты: уголь активированный; силикагель; медицинский препарат «Смекта». 2.1. Исследование адсорбционной способности адсорбентов. 2.1.1. Поглощение растворённых в воде веществ поверхностью различных адсорбентов. Приготовила раствор красной гуаши, налила его в три стакана. Предварительно взвесила по 3 грамма исследуемых адсорбентов. Затем насыпала их по отдельности в каждый из стаканов. Размешала стеклянной палочкой и дала растворам отстояться. Через 24 часа отфильтровала данные растворы и отметила изменение окраски. Увидела, что в стакане с адсорбентом «Смекта» окраска раствора стала светлее, чем в других двух стаканах. (Приложение 1). В данном опыте медицинский препарат «Смекта» лучше справился с поглощение растворённых твёрдых веществ по сравнению с активированным углем и силикагелем. Вывод: «Смекта» обладает лучшей адсорбционной способностью жидкостей. 2.1.2. Поглощение газообразных веществ поверхностью различных адсорбентов. Взяла три стакана, на дно каждого из них капнула по 1 капле туалетной воды. Насыпала исследуемые образцы адсорбентов по 1 г в каждый из стаканов по отдельности. Накрыла стаканы плотным картоном и оставила на 5 минут. По истечении времени оценила интенсивность запаха туалетной воды в каждом из стаканов. (Приложение 2). В данном опыте активированный уголь лучше справился с поглощение газообразных веществ по сравнению со «Смектой» и силикагелем. Вывод: активированный уголь обладает лучшей адсорбционной способностью газообразных веществ. 2.1.3. Поглощение активированным углем оксида серы (IV). Взяла две плоскодонные колбы, в каждую из них поместила розовые цветки герани. В одну из данных колб насыпала 2 грамма активированного угля. Затем в ложечку для сжигания веществ насыпала серу, подожгла её в пламени спиртовки и внесла по очереди в каждую из колб. Наблюдала выделение оксида серы (IV). После проведения данного опыта достала из колб цветы герани и увидела, что края лепестков цветка герани, который находился в колбе без адсорбента, изменили свою окраску с розовой на белую. (Приложение 3). 13 Вывод: активированный уголь обладает хорошей адсорбционной способностью газообразных веществ. 2.2. Влияние природы растворителя на адсорбционные свойства активированного угля. Взяла два стакана. В один из них налила 10 мл этилового спирта, во второй – 10 мл воды. В каждый из стаканов насыпала по 0,5 г метилового оранжевого и 0,5 г активированного угля. Перемешала данные смеси стеклянной палочкой. Дала растворам отстояться 10 минут. Затем отфильтровала. Оценила интенсивность окрашивания фильтрованных растворов и заметила, что метилоранж плохо растворим в воде и хорошо - в спирте. Поэтому адсорбция активированным углем заметно лучше в стакане со спиртом. (Приложение 4). Вывод: адсорбционные свойства адсорбента зависят от природы растворителя. 2.3. Избирательная адсорбция газов активированным углем. В плоскодонную колбу насыпала 3 г активированного угля и опустила в неё горящую лучину. Отметила, что лучина горит хорошо. Эту же колбу наполнила небольшим количеством оксида азота (IV) NO2 бурого цвета. Диоксид азота получила при взаимодействии медных стружек с концентрированной азотной кислотой: Cu + 4 HNO3 (конц.) = Cu(NO3)2 + 2 H2O + 2 NO2. Увидела, что бурая окраска газа исчезала, что свидетельствует о поглощении диоксида азота активированным углем, а горящая в данной колбе лучинка доказывала то, что молекулы кислорода не поглотились активированным углем. Следовательно, активированный уголь хорошо адсорбирует молекулы диоксида азота и плохо адсорбирует молекулы кислорода и азота. (Приложение 5). Вывод: активированный уголь – обладает избирательной адсорбционной способностью. 2.4. Влияние площади поверхности адсорбента на его адсорбционные свойства. Взяла два стакана, налила в них 20 мл воды, затем добавила 3 капли спиртового раствора йода. В качестве адсорбента в первый стакан насыпала 2 г порошкообразного силикагеля, а во второй – 2 г гранулированного силикагеля. Через 30 минут силикагель в виде порошка набух в данном растворе, а в виде гранул - набух слегка. Через 24 часа оценила интенсивность окраски растворов. Площадь поверхности силикагеля в виде порошка больше, поэтому он лучше поглотил йод из раствора. (Приложение 6). Вывод: силикагель в виде порошка является лучшим адсорбентом, его лучше использовать в быту. 14 Выводы по главе 2. Анализируя проведённые мною исследования, я пришла к следующим выводам: 1. Активированный уголь – обладает избирательной адсорбционной способностью газов. 2. Адсорбционные свойства веществ зависят от природы растворителя и площади поверхности адсорбента. 3. Для впитывания влаги лучше использовать силикагель в виде порошка. 4. Медицинский препарат «Смекта» быстро адсорбирует вещество. Заключение. Подводя итог проведённому исследованию, можно констатировать, что я достигла поставленной цели и решила задачи, которые определила в начале моей исследовательской работы, а именно: изучила литературу по данной теме; сравнила адсорбционную способность различных адсорбентов; выявила факторы, влияющие на адсорбционную способность адсорбентов; проанализировала все результаты и сделала соответствующие выводы Моя гипотеза полностью подтвердилась. Действительно, адсорбционные свойства адсорбентов различны и зависят от некоторых факторов. Полученные мною результаты исследования можно представить в виде следующих выводов. 1. Активированный уголь является наилучшим адсорбентом по поглощению газов, запахов в воздухе и посторонних веществ в растворе, это его свойство позволило великому русскому учёному Н. Д. Зелинскому использовать прослойку угля в противогазе; 2. Силикагель хорошо впитывает запахи и влагу, благодаря этим свойствам его используют в быту (для осушения), а также для комфортного содержания домашних животных; 3. Гидроокись алюминия также впитывает газы, запахи и обезвреживает посторонние вещества, гидроокись алюминия входит в состав лекарств для лечения болезни желудка («Смекта»), так как помимо адсорбционных свойств, гидроокись алюминия обладает противокислотными (антацидными), обволакивающими свойствами, необходимыми при высокой кислотности желудочного сока, язвах желудка и двенадцатиперстной кишки и других заболеваниях желудочно-кишечного тракта. 15 Человек нашёл промышленности. применение Сейчас на адсорбции многих кухнях в быту, над в военном газовыми плитами деле, в ставят разнообразные устройства для очистки воздуха от чада и дыма. В таких устройствах, помимо прочего, есть патрон с каким-либо адсорбентом, через который прогоняют загрязненный воздух. А когда вся поверхность будет занята посторонними, «впитанными» из воздуха частицами, патрон заменяют свежим. Я узнала интересный факт, если положить пакетики с силикагелем рядом с острыми бритвами, лезвиями, ножами, они не затупятся и не подвергнутся окислению, так как силикагель впитывает влагу. Силикагель применяют во флористике: есть способ сохранить букет – дать ему вторую жизнь при помощи силикагеля. Растения после сушки с помощью силикагеля выглядят практически как свежие, сохраняется цвет лепестков. Я считаю, что работа выполнена вполне удачно, так как я открыла для себя много новой и полезной информации. Список использованных источников: 1. http://islimming.ru/1206/adsorbent. 2. http://chem.ssti.ru 3. http://studfiles.net 4. Скурихин И.М., Нечаев А.П. Все о пище точки зрения химика - М.: Высшая школа, 1991. 5. Габриелян О.С. Химия 9 класс – М.: Дрофа, 2017. 6. http://referat.yabotanik.ru 7. http://allrefrs.ru 16 ПРИЛОЖЕНИЯ 18 Приложение 1. Поглощение растворённых в воде веществ поверхностью различных адсорбентов. Фото 1. Смеси растворов с адсорбентами. Фото 2. Фильтрование смесей. Фото 3. Отфильтрованные растворы. 18 Приложение 2. Поглощение газообразных веществ поверхностью различных адсорбентов. Фото 4. Опыт по поглощению газообразных веществ. Фото 5. Определение интенсивности запаха после опыта. 18 Приложение 3. Поглощение активированным углем оксида серы (IV). Фото 6. Подготовка опыта. Фото 7. Проведение опыта. Фото 8 и 9. Результаты опыта. 18 Приложение 4. Влияние природы растворителя на адсорбционные свойства активированного угля. Фото 10. Проведение опыта по влиянию природы растворителя на адсорбцию. 18 Приложение 5. Избирательная адсорбция газов активированным углем. Фото 11. Горение лучины на воздухе в присутствии адсорбента. Фото 12. Поглощение оксида азота (IV) активированным углем. 18 Фото 13. Горение лучины в результате адсорбции. Приложение 6. Влияние площади поверхности адсорбента на его адсорбционные свойства. Фото 14. Адсорбция раствора йода силикагелем. 18