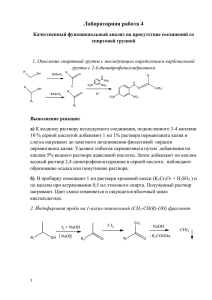
конкурс 15 мая Шкиндерова Т.М. метод.ук.по лабор.рабx
реклама

Профессиональный конкурс работников образования ВСЕРОССИЙСКИЙ ИНТЕРНЕТ-КОНКУРС ПЕДАГОГИЧЕСКОГО ТВОРЧЕСТВА (2012/13 учебный год) МИНИСТЕРСТВО ТРУДА, ЗАНЯТОСТИ И СОЦИАЛЬНОЙ ЗАЩИТЫ ГОСУДАСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «НИЖНЕКАМСКИЙ НЕФТЕХИМИЧЕСКИЙ КОЛЛЕДЖ» Номинация конкурса: Педагогические идеи и технологии: профессиональное образование МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ по выполнению лабораторных работ дисциплины «Органическая химия» для специальностей: 240113 «Химическая технология органических веществ» 240134 «Переработка нефти и газа» 240125 «Технология производства и переработки пластических масс и эластомеров» Автор: Шкиндерова Татьяна Михайловна, преподаватель ГБОУ СПО «Нижнекамский нефтехимический колледж», высшей категории Место выполнения работы: ГБОУ СПО «Нижнекамский нефтехимический колледж», Республика Татарстан, г. Нижнекамск, ул. Химиков д. 45 2013 Методические указания. Лабораторные работы по дисциплине «Органическая химия» проводятся одновременно с изучением теоретического курса, основные положения которого они иллюстрируют. В основу лабораторных работ положена классификация органических соединений по функциональным группам. Всего работ 17: 1. Качественный элементный анализ. 2. Алканы (парафиновые углеводороды). 3. Алкены (олефиновые углеводороды). 4. Алкины (ацетиленовые углеводороды). 5. Арены (ароматические углеводороды). 6. Галогенпроизводные. 7. Спирты. 8. Фенолы. 9. Альдегиды и кетоны. 10. Карбоновые кислоты. 11. Производные карбоновых кислот. 12. Нитросоединения. 13.Амины. 14.Углеводы (моно- и олигосахариды). 15.Полисахариды. 16.Белковые вещества. 17.Функциональный анализ органических соединений. Последняя работа подводит итог всем проделанным предыдущим лабораторным работам. Для выполнения каждой лабораторной работы необходимо: - знать теорию той темы, по которой проводится работа; - внимательно прочитать и понять инструкцию к лабораторной работе; - осмыслить формулируемую цель работы; - ознакомиться с перечнем необходимых реактивов, материалов, оборудования; - бережно использовать реактивы; - осмысленно выполнять опыты; - выполнять требования техники безопасности; - составить отчет о проделанной работе с использование ГОСТа на техническую документацию; - ответить на контрольные вопросы; - сдать отчет преподавателю. Л а б о р а т о р н а я р а б о т а 1 КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Цель работы: С помощью качественных реакций доказать наличие углерода, водорода, галогена в органических соединениях. Студенты должны знать: - сущность качественного анализа; - определение углекислого газа; - определение воды; - определение галoгенов; - правила техники безопасности при выполнении работы; - методику проведения работы; Уметь: - собрать прибор для работы; - провести качественный анализ органических соединений; - объяснить методику определения углерода, водорода, галогена. КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В состав органических веществ, кроме углерода чаще всего входят еще водород, кислород и азот. Наряду с ними в молекулу органического вещества могут входить и другие элементы, например сера, галогены, фосфор и др. Для определения элементов, входящих в состав органических веществ, их необходимо предварительно перевести в неорганические соединения, для дальнейшего исследования которых применяют методы обычного качественного анализа. Например, специальными методами углерод переводят в диоксид углерода, водород— в воду, азот- в цианистый натрий, серу—в сульфид натрия и т. д. Рассмотрим определение углерода, водорода, азота, серы и галогенов. Для определения кислорода обычно не пользуются качественными реакциями. О его присутствии чаще всего судят по данным количественного анализа. Опыт 1. Определение углерода и водорода сожжением вещества с оксидом меди. Реактивы и материалы: глюкоза (или глицерин, крахмал, сахар); оксид меди (порошок); баритовая вода, насыщенный водный раствор; сульфат меди (II)безводный. Оборудование: газоотводная трубка с пробкой; стеклянная палочка; микролопатка. В сухую пробирку 1 насыпают черный порошок оксида меди (слой высотой около 5 мм). Добавляют половину микролопатки глюкозы и тщательно перемешивают, встряхивая пробирку. В верхнюю часть пробирки помещают небольшой комочек ваты, на который насыпают немного белого порошка безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в вату с CuSО4. Нижний конец трубки опускают в пробирку 2, предварительно налив в нее 5 - 6 капель баритовой (или известковой) воды. Пробирку 1 нагревают на пламени горелки. Через несколько секунд из газоотводной трубки начинают выходить пузырьки газа, и баритовая вода мутнеет вследствие выделения белого осадка углекислого бария. Пробирку 2 удаляют. Продолжают нагревать пробирку 1, пока пары воды не достигнут белого порошка обезвоженного медного купороса, находящегося на ватной пробке, и не вызовут изменения его окраски вследствие образования кристаллогидрата CuS04* 5Н2О. Химизм процесса: С6Н12О6 + 12CuO > 6СО2+ 6Н2О+ 12Сu СО2 + Ва(ОН)2 CuSО4+ 5Н2О > ВаСОз + Н2О > CuSО4• 5Н2О Метод основан на том, что при прокаливании органического вещества в смеси с окислителем (СuО) происходит окисление углерода органического вещества в диоксид углерода, а водорода—в воду. Оксид меди при этом восстанавливается до металлической меди. Выделение диоксида углерода доказывается появлением белого осадка углекислого бария. Воду в продуктах сжигания обнаруживают по образованию синих кристаллов медного купороса. О п ы т 2. Определение хлора по зеленой окраске пламени. Реактивы и материалы: хлороформ (или дихлорэтан); медная проволока. Галогены проще всего открываются по Бейльштейну - прокаливанием органического вещества с оксидом меди в пламени горелки. Медную проволоку длиной 10 см с петлей на конце прокаливают на пламени горелки до исчезновения посторонней окраски пламени (признак отсутствия загрязнения медной петли). Остывшую петлю, покрывшуюся черным налетом оксида меди, опускают в пробирку с 1-2 каплями испытуемого вещества, например хлороформа, и вновь вносят в пламя горелки. Немедленно появляется характерная ярко-зеленая окраска пламени. При прокалывании кислород оксида меди окисляет углерод и водород органического вещества в диоксид углерода и воду, медь же образует с галогеном летучие соединения, которые окрашивают пламя горелки в зеленый цвет. Появление зеленого окрашивания указывает на присутствие в органическом соединении галогена. Химизм процесса: 2СНСl3 + 5CuO CuCl2+ 4СuCl + 2СО2 + Н2О Чтобы очистить проволоку, ее смачивают соляной кислотой и снова прокаливают. Для открытия галогенов органическое вещество разрушают. При этом галогены переходят неорганические соли, которые могут быть обнаружены обычными ионными реакциями. Галогены можно отщепить и перевести в соли галогеноводородных кислот также методом А.В. Степанова - действием металлического натрия на спиртовой раствор органического вещества. Контрольные вопросы: 1. Состав органических соединений. 2. Особенности органических соединений. 3. Что такое качественный элементный анализ? 4. Что называется количественным анализом? 5. Как определить углерод? 6. Как определить водород? 7. Как определить хлор? Л а б о р а т о р н а я р а б о т а 2 АЛКАНЫ Цель работы: Получить метан, установить действие на жидкие алканы, на метан бромной воды, перманганата калия, концентрированных кислот. Студенты должны знать: - строение алканов; - способ получения метана сплавлением натриевых солей карбоновых кислот со щелочами; - действие бромной воды на алканы; - действие на алканы перманганата калия; - действие на алканы концентрированных кислот; - методику проведения работы; - правила техники безопасности. Уметь: - собрать прибор для работы; - получить метан; - объяснить действие бромной воды, перманганата калия и других реагентов на алканы; - объяснить методику проведения работы. Опыт 1. Получение метана и изучение его свойств Реактивы и материалы: уксуснокислый натрий обезвоженный; натронная известь; бромная вода, насыщенный раствор; перманганат калия, 1 н. раствор. Оборудование: газоотводная трубка. 1. Получение метана и его горение. В сухую пробирку 1, снабженную пробкой с газоотводной трубкой, помещают смесь из обезвоженного уксуснокислого натрия и натронной извести (примерно 1 : 2) (высота слоя 6—10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки. Химизм процесса: CH3COONa+ NaOH СН4 + Na2CО3 Поджигают выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем. Химизм процесса: СН4 + 2О2 СО2 + 2 Н 2 О При нагревании натриевой соли уксусной кислоты с натронной известью происходит расщепление соли с образованием метана. Нагревание натриевых солей карбоновых кислот с натронной известью является общим лабораторным способом получения предельных углеводородов. 2. Отношение метана к бромной воде и перманганату калия. В пробирку 2 помещают 5 капель раствора перманганата калия и в пробирку 3—5 капель бромной воды. Не прекращая нагревания смеси в пробирке 1, вводят поочередно конец газоотводной трубки в пробирки 2 и 3. Обесцвечивания растворов перманганата калия и бромной воды не происходит. В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жестких условиях, к реакциям присоединения алканы не способны. Опыт 2. Окисление предельных углеводородов Реактивы и материалы: жидкие алканы; перманганат калия, 1 н. раствор; углекислый натрий, 1 н. раствор. В пробирку помещают 1 каплю исследуемого алкана (или смеси алканов), 1 каплю раствора углекислого натрия и 2-3 капли раствора перманганата калия. Содержимое пробирки энергично взбалтывают. Фиолетовая окраска водного слоя не изменяется, так как алканы в этих условиях не окисляются. Опыт 3. Действие концентрированной серной кислоты на предельные углеводороды Реактивы и материалы: жидкие алканы; серная кислота H2SО4 концентрированная (d=1,84 г/см3). В пробирку помещают 2 капли жидкого алкана и 2 капли серной кислоты. Содержимое пробирки энергично перемешивают 1—2 мин, охлаждая пробирку проточной водой. В условиях опыта алканы с серной кислотой не реагируют. При небольшом нагревании дымящая серная кислота образует с алканами, содержащими третичный углеродный атом, сульфокислоты. При высоких температурах серная кислота действует как окислитель. Контрольные вопросы: 1. Что такое углеводороды? 2. Гомологический ряд алканов. 3. Строение алканов. 4. Изомерия алканов. 5. Углеводородные радикалы алканы. 6. Рациональная номенклатура алканов. 7. Современная заместительная номенклатура алканов. 8. Получение алканов по реакциям, не сопровождающимся изменением числа углеродных атомов в молекуле. 9. Получение алканов по реакциям, сопровождающимся уменьшением числа углеродных атомов в молекуле. 10. Получение алканов по реакциям, идущим с увеличением числа углеродных атомов в молекуле. 11. Физические свойства алканов. 12. Галогенирование алканов. 13. Действие на алканы азотной кислоты. 14. Сульфохлорирование алканов. 15. Сульфоокисление алканов. 16. Окисление алканов. 17. Крекинг алканов. Л а б о р а т о р н а я р а б о т а 3 АЛКЕНЫ Цель работы: Получить этилен и установить действие на этилен бромной воды, перманганата калия и других реактивов. Студент должен знать: - строение алкенов; - способ получения алкенов сернокислотной дегидратацией спиртов; - действие бромной воды на алкены; - действие перманганата калия на алкены; - действие концентрированных кислот на алкены; - методику проведения работы; - технику безопасности при выполнении работы; Уметь: - собрать прибор для работы; - получить этилен из этилового спирта; - объяснить действие бромной воды и перманганата калия на алкены; - проводить реакции с алкенами; - объяснить качественные реакции на алкены; Опыт 1. Получение этилена и его горение Реактивы и материалы: этиловый спирт, 96%-ный; серная кислота (d-1,84 г/см3). Оборудование: песок, газоотводная трубка. В сухую пробирку помещают несколько крупинок песка, 6 капель этилового спирта и 8 капель концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки - он горит светящимся пламенем. Химизм процесса: СН3—СН2ОН + HOSO3H <==> СН3—СН2—OSO3H+ H2O этилсерная кислота Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается: СН2= СН2 +H2SO4 CH3-CH2-OSO3H Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта: H H H—C—C—H H H H H—C==C—H+H 2O OH Выделяющийся этилен горит светящимся пламенем: C 2H 4 +3О 2 ---> 2СО2+2Н 2О Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется кроме этилена и следов диэтилового эфира (C2H5)2O ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до диоксида серы: 2H2SО4 + С > СО2 + 2SО2+ 2Н2О Диоксид серы также может обесцвечивать растворы брома и перманганата калия подобно этилену. Поэтому обычно образующийся этилен промывают раствором щелочи для очистки от SО2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, диоксид серы не образуется. Дегидратация спиртов является общим способом получения непредельных углеводородов. Опыт 2. Присоединение к этилену брома Реактивы и материалы: этилен; бромная вода, насыщенный раствор. Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 1), опускают конец газоотводной трубки в пробирку с 5 каплями бромной воды. Бромная вода быстро обесцвечивается вследствие присоединения атомов брома по месту двойной связи. Химизм процесса: СН3= СН2+ Br2 ----> CH2- CH2 Br Br 1,2- дибромэтан Для алкенов характерны реакции присоединения по месту двойной связи. Реакция обесцвечивания водного раствора брома служит качественной реакцией на двойную связь. Опыт 3. Отношение этилена к окислителям Реактивы и материалы: этилен; перманганат калия, 0,1 н. раствор. Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 1), опускают конец газоотводной трубки в пробирку с 1каплей раствора перманганата калия и 4 каплями воды. Раствор перманганата калия быстро обесцвечивается. При этом алкен окисляется в двухатомный спирт. Химизм процесса: СН2=СН2+[О]+H—ОН ---> CH2-CH2, OH OH Этиленгликоль Эта реакция является качественной реакцией на двойную связь. Контрольные вопросы: 1. Что такое алкены? 2. Гомологический ряд алкенов. 3. Строение алкенов. 4. Природа двойной связи. 5. Структурная изомерия алкенов. 6. Пространственная изомерия алкенов. 7. Рациональная номенклатура алкенов. 8. Современная заместительная номенклатура алкенов. 9. Лабораторные способы получения алкенов. 10. Промышленные способы получения алкенов. 11. Физические свойства алкенов. 12. Реакция присоединения. 13. Реакции алкилирования. 14. Реакции полимеризации. 15. Окисление алкенов. 16. Реакции замещения у алкенов. 17. Качественные реакции на алкены. Л а б о р а т о р н а я р а б о т а 4 АЛКИНЫ Цель работы: Получить ацетилен и установить действие на него бромной воды, перманганата калия, нитрата серебра. Студенты должны знать: - строение алкинов; - карбидный способ получения ацетилена; - действие на алкины бромной воды; - действие на алкины перманганата калия; - действие на алкины нитрата серебра в растворе аммиака; - методику проведения работы; - технику безопасности при выполнении работы. Уметь: - собрать прибор для работы; - получить ацетилен из кароида кальция; - объяснить действие бромной воды на алкины; - объяснить действие перманганата калия на алканы; - объяснить действие на алкины аммиачного раствора оксида серебра; - объяснить методику проведения работы. Опыт 1. Получение ацетилена и его горение. Реактивы и материалы: карбид кальция СаС2 (в кусочках). Оборудование: газоотводная трубка с оттянутым концом. Работу с ацетиленом необходимо проводить в вытяжном шкафу, так как неочищенный ацетилен, полученный из карбида кальция, содержит вредные, неприятно пахнущие примеси. В пробирку помещают маленький кусочек карбида кальция СаС2, добавляют 2 капли воды и закрывают пробирку пробкой с газоотводной трубкой, имеющей оттянутый конец. В пробирке бурно выделяется газообразный ацетилен. Химизм процесса: СаС 2+ 2Н 20 НС≡CH + Са(ОН) 2 Поджигают ацетилен у конца газоотводной трубки. Он горит светящимся, коптящим пламенем. Реакция взаимодействия карбида кальция с водой экзотермична. Ацетилен, полученный из карбида кальция, содержит незначительные количества NH3 , РН3, AsH3 и других примесей и поэтому имеет характерный запах. Примеси можно удалить промыванием ацетилена водным раствором дихромата калия, подкисленного серной кислотой. Опыт 2. Присоединение к ацетилену брома Реактивы и материалы: ацетилен; бромная вода, насыщенный раствор. Оборудование: газоотводная трубка. Добавляют в пробирку с карбидом кальция (см. опыт 1) еще 2 капли воды и закрывают ее пробкой с газоотводной трубкой, конец которой опускают в пробирку с 5 каплями бромной воды. Бромная вода обесцвечивается вследствие присоединения атомов брома по месту тройной связи. Химизм процесса: HС ≡ CH+ 2Вг 2--->Br 2HC-CHBr 2 1,1,2,2-тетрaбромэтан Опыт 3. Отношение ацетилена к окислителям Реактивы и материалы: ацетилен; перманганат калия,0,1 н. раствор. Оборудование: газоотводная трубка. В пробирку помещают 1 каплю перманганата калия и 4 капли воды. В пробирку с кусочками карбида кальция добавляют еще 2 капли воды и закрывают пробкой с газоотводной трубкой, конец которой опускают в приготовленный раствор перманганата калия. Розовый раствор быстро обесцвечивается: происходит окисление ацетилена по месту разрыва тройной связи с образованием промежуточного продукта окисления - щавелевой кислоты, которая окисляется дальше до диоксида углерода: 4[O] [O] НС = СH----> НО—С—C—OH —> 2СО2+Н2О O O щавелевая кислота Обесцвечивание бромной воды и раствора перманганата калия доказывает непредельность ацетилена. Опыт 4. Образование ацетиленида серебра Реактивы и материалы: ацетилен; нитрат серебра, 0,2 н. раствор; аммиак, концентрированный раствор. В пробирку вносят 2 капли раствора нитрата серебра и прибавляют 1 каплю раствора аммиака — образуется осадок гидроксида серебра. При добавлении 1—2 капель раствора аммиака осадок AgOH легко растворяется с образованием аммиачного раствора оксида серебра. Реакция протекает по следующим уравнениям: AgNО3+ NH4OH ---> AgOH+ NH4NO3 2AgOH ---> Ag2О + H2О Ag2О + 4NH4OH --> 2[Ag(NH3)2] ОН + 3H2О] Через аммиачный раствор оксида серебра пропускают ацетилен (см. опыт 1). В пробирке образуется светло-желтый осадок ацетиленида серебра, который затем становится серым. Химизм процесса: НС ≡ СН + 2 [Ag(NH3)2] ОН ---> Ag—C ≡ C -- Ag+ 4NH3+ 2H2О ацетиленистое серебро Контрольные вопросы: 1. Что такое алкины? 2. Строение алкинов. 3. Изометрия алкинов. 4. Рациональная номенклатура алкинов. 5. Современная заместительная номенклатура алкинов. 6. Способы получения алкинов. 7. Физические свойства алкинов. 8. Реакции присоединения алкинов. 9. Окисление алкинов. 10. Реакции полимеризации. 11. Реакции замещения. 12. Качественные реакции на алкины. Л а б о р а т о р н а я р а б о т а 5 Ароматические углеводороды /АРЕНЫ/ Цель работы: Установить свойства гомологов бензола. Студент должен знать: - строение аренов; - действие бромной воды на арены; - действие перманганата калия на арены; - окисление гомологов бензола; - методику проведения работы; - технику безопасности при выполнении работы. Уметь: - объяснить действие на арены бромной воды и перманганата калия; - объяснить химические свойства гомологов бензола; - объяснить методику проведения работы. Опыт 1. Проба на ароматическую структуру. Реактивы и материалы: хлороформ; ароматический углеводород; хлорид алюминия, безводный. В пробирку приливают 5 капель ароматического углеводорода, 4 капли хлороформа и вносят на кончике микролопатки безводный хлорид алюминия. Содержимое пробирки тщательно взбалтывают. Постепенно появляется окраска самых разнообразных оттенков, при стоянии переходящая в коричневое окрашивание. Этот опыт можно проделать как пробу на ароматическую структуру с любым ароматическим соединением. Опыт 2. Свойства бензола. Реактивы и материалы: бензол, х. ч.; этиловый спирт; диэтиловый эфир; бромная вода; перманганат калия, 0,1 н. раствор; серная кислота, 2 н. раствор. Оборудование: фарфоровая чашка. 1.Растворимость бензола в различных растворителях. В три пробирки помещают по одной капле бензола. В одну пробирку добавляют 3 капли воды, в другую— 3 капли спирта, в третью—3 капли эфира. Содержимое пробирок тщательно взбалтывают. В пробирке с водой образуется 2 слоя, в пробирках со спиртом и эфиром получается однородный раствор. Следовательно, бензол в воде практически нерастворим и хорошо растворяется в органических растворителях. 2.Горение бензола. (Опыт проводят в вытяжном шкафу!) В фарфоровую чашечку помешают одну каплю бензола и поджигают. Бензол горит ярким коптящим пламенем. 3.Действие бромной воды на бензол. В пробирку помещают 3 капли бромной воды и 2 капли бензола. Содержимое пробирки энергично взбалтывают и дают отстояться. Нижний слой (бромная вода) обесцвечивается, а верхний слой (бензол) окрашивается в коричневато-желтый цвет. Бром легче растворяется в бензоле, чем в воде, и поэтому переходит в верхний бензольный слой. Присоединение брома в этих условиях не происходит. 4. Действие перманганата калия. В пробирку помещают 3 капли воды, каплю раствора перманганата калия и каплю раствора серной кислоты. К полученному раствору добавляют каплю бензола и встряхивают содержимое пробирки. Розовый раствор при этом не обесцвечивается. Для этого опыта бензол предварительно очищают от примесей, охлаждая его до +5°С. При этом бензол затвердевает, а примеси остаются жидкими и легко отделяются. Перекристаллизацию бензола делают два-три раза. Одним из важнейших свойств бензола является его устойчивость к действию окислителей. Наиболее резкое отличие ароматических углеводородов от ненасыщенных углеводородов жирного ряда—отношение к окислителям. О п ы т 3. Окисление гомологов бензола Реактивы и материалы: толуол, перманганат калия, 0,1 н. раствор, серная кислота, 2 н. раствор. В пробирку помещают 3 капли воды, каплю раствора перманганата калия и 1 каплю раствора серной кислоты. Затем добавляют каплю толуола и энергично встряхивают в течение 1—2 мин. Розовая окраска постепенно исчезает, и раствор обесцвечивается. Химизм процесса: O C6H5---CH3+3[O] --> C6H5C +H2O OH Гомологи бензола окисляются значительно легче бензола. Но у них ароматическое ядро более устойчиво к действию окислителей, чем соединенные, с ядром углеводородные радикалы. Как бы ни была сложна боковая цепь, она при действии сильных окислителей разрушается, за исключением атома углерода, ближайшего к ядру. Атом углерода, соединенный с ароматическим ядром, окисляется в карбоксильную группу. По основности полученных кислот судят о структуре гомологов бензола. Опыт 4. Нитрование нафталина Реактивы и материалы: нафталин; азотная кислота (d=1,4 г/см3). Оборудование: водяная баня; стеклянная палочка. В пробирку помещают несколько кристаллов нафталина и приливают 5 капель азотной кислоты. Содержимое пробирки перемешивают стеклянной палочкой и нагревают в слабо кипящей водяной бане 1—2 мин. Горячий раствор выливают в пробирку с холодной водой. Нитронафталин опускается на дно в виде оранжевой маслянистой жидкости, затвердевающей при взбалтывании. Химизм процесса: NO2 +HO—NO2--> нафталин +H2O α-нитронафталин Нитрование нафталина идет значительно легче, чем в ряду бензола. Поэтому вместо нитрующей смеси можно применять концентрированную азотную кислоту. При нитровании нафталина получается α-нитронафталин. Более энергичное нитрование приводит к образованию 1,5-и 1,8-динитронафталинов. βнитронафталин получается диазотированием β-нафтиламина в азотнокислом растворе в присутствии оксида меди (I) Cu2О (обмен диазо- группы на NO2). Контрольные вопросы: 1. Строение бензола. 2. Природа ароматического строения. 3. Изометрия производных бензола. 4. Номенклатура аренов. 5. Ароматические радикалы (арилы). 6. Способы получения аренов из неароматических соединений. 7. Способы получения аренов ароматических соединений. 8. Физические свойства аренов. 9. Механизм реакции электрофильного замещения в ароматическом ряду. 10. Реакции электрофильного замещения в ароматическом ряду. 11. Реакции присоединения к ароматическим углеводородам. 12. Ориентация при электрофильном замещении в бензольном ядре. 13. Как объясняется правило замещения с точки зрения электронной теории? 14. Какие арены называются многоядерными? 15. Классификация многоядерных аренов. 16. Нафталин, его получение, свойства. 17. Бефинил, его получение, свойства. Л а б о р а т о р н а я р а б о т а 6 Г А Л О Г ЕНПРОИЗВОДНЫЕ Цель работы: Получить различными способами галoгенпроизводные. Студент должен знать: - строение алкилгалогенидов; - номенклатуру галoгенпроизводных; - получение алкилгалогенидов из спиртов; - методику проведения работы; - технику безопасности при выполнении опытов. Уметь: - объяснить получения алкилгалогенидов из спиртов; - объяснить качественное определение галогенов; - объяснить методику проведения опытов. Опыт 1. Получение бромистого этила Реактивы и материалы: этиловый спирт; бромид калия (порошок); серная кислота (d=1,84 г/см 3 ). В пробирку с отводной трубкой помещают 3 капли спирта, 2 капли воды и 3 капли серной кислоты. Охладив разогревшуюся спирто -кислотную смесь, в нее помещают на конце микролопатки несколько кристаллов бромида калия. Пробирку укрепляют наклонно в лапке штатива и осторожно нагревают содержимое пробирки до кипения. Конец отводной трубки погружают в другую пробирку, содержащую 6 —7 капель воды и охлаждаемую льдом. Нагревание ведут до исчезновения кристаллов бромида калия в реакционной пробирке. В приемнике образуется два слоя: нижний — бромистый этил, верхний — вода. С помощью пипетки удаляют верхний слой. Стеклянной палочкой вносят 1 каплю бромистого этила в пламя горелки. Пламя окрашивается по краям в зеленый цвет.Химизм процесса: С2Н5ОН + HO-SO3H <=> C2H5-O-SO3H+ НОН этилсерная кислота KBr +H 2 SО 4 <=> НВг + KHSO 4 гидросульфат калия C 2 H 5 -О-SО 3 H+ НВr С 2 H 5 Bг + H 2 SO 4 бромистый этил Наиболее удобным способом получения галогеналкилов является замещение гидроксильной группы спиртов R—ОН на галоген. Получение галогенопроизводных из спиртов применяется в больших масштабах, так как спирты—легкодоступные и хорошо изученные соединения. В некоторых случаях при получении галогеналкилов вместо галогеноводородов применяют галогениды фосфора. Опыт 2. Получение йодоформа из этилового спирта Реактивы и материалы: этиловый спирт; едкий натр, 2 н. раствор; раствор йода в иодиде калия. Оборудование: микроскоп; предметное стекло. В пробирку помещают 1 каплю этилового спирта, 3 капли раствора иода в иодиде калия и 3 капли раствора едкого натра. Содержимое пробирки нагревают, не допуская закипания раствора, так как в кипящем растворе йодоформ расщепляется щелочью. Появляется беловатая муть, из которой постепенно при охлаждении образуются кристаллы иодоформа. Если муть растворяется, то добавляют еще 3—4 капли раствора иода к теплой реакционной смеси и тщательно перемешивают содержимое пробирки, пока не начнется выделение кристаллов. Две капли осадка переносят на предметное стекло и рассматривают их под микроскопом. Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок Химизм процесса: I2+ 2NaOH --> NaOI +NaI+ H2O NaOI ---> NaI+ [O] O СН3—CH2OH + [O] --> CH 3 —C—H+ H2O O О CH3—С—H + 3I2 --> CI3—С—Н + 3НI О Cl3—C—H+NaOH→CHl3+H—COONa Йодоформ образует кристаллы желтого цвета с т. пл. 119°С, обладает сильным, очень навязчивым запахом. Это прекрасный антисептик. Контрольные вопросы: 1. Что такое галогенпроизводные? 2. Изометрия. 3. Номенклатура галогенпроизводных. 4. Способы получения насыщенных галогенпроизводных. 5. Способы получения ненасыщенных галогенпроизводных. 6. Способы получения ароматических галогенпроизводных. 7. Физические свойства галогенпроизводных. 8. Реакции нуклефильного замещения, идущие по механизму SN2. 9. Реакции нуклефильного замещения, идущие по механизму SN1. 10. Влияние углеводородного радикала на свойства галогенпроизводных. 11. Важнейшие реакции галогенпроизводных. 12. Качественное определение галогенов. Л а б о р а т о р н а я р а б о т а СПИРТЫ Цель работы: Изучить химические свойства спиртов. Студент должен знать: -строение спиртов; -функциональную группу спиртов; -отличие ароматических спиртов от фенолов; -отношение спиртов к индикаторам; - кислотные свойства спиртов; -качественные реакции на спирты; -условия дегидратации спиртов; -методику проведения работы; -технику безопасности при выполнении работы; 7 Уметь: - объяснить отношение спиртов к индикаторам; - объяснить кислотные свойства спиртов; -объяснить действие гидроксида меди на глицерин; - проводить качественные реакции на спирт; - объяснить методику проведения опытов; Опыт 1. Отношение спиртов к индикаторам. Реактивы и материалы: этиловый спирт; пропиловый спирт; бутиловый спирт; изоамиловый спирт; фенолфталеин, 1%-ный спиртовой раствор; лакмусовая бумага. В четыре пробирки помещают по 3 капли воды и добавляют по 2 капли этилового, пропилового, бутилового и изоамилового спиртов. И спытывают растворы спиртов на фенолфталеин и лакмус. Цвет индикаторов не изменяется. Спирты показывают нейтральную реакцию на индикаторы. Опыт 2. Образование и гидролиз алкоголятов. Реактивы и материалы: этиловый спирт; металлический натрий; фенолфталеин, 1%-ный спиртовой раствор. В сухую пробирку помещают маленький кусочек металлического натрия. Добавляют 3 капли этилового спирта и закрывают пробирку пальцем. По окончании реакции подносят пробирку к пламени горелки и отнимают палец. У отверстия пробирки воспламеняется выделяющийся водород. Оставшийся на дне пробирки беловатый остаток этилата натрия растворяют в 2—3 каплях дистиллированной воды, добавляют 1 каплю спиртового раствора фенолфталеина — появляется малиновое окрашивание. Химизм процесса: C2H5OH + Na –> C2H5ONa + 1 / 2 H 2 этилат C2H5ONa+ H-OH ---> C2H5OH+ NaOH Атомы водорода гидроксильных групп в спиртах проявляют определенную подвижность (активность). Подобно воде спирты реагируют со щелочными металлами (натрием, калием и др.), которые замещают водород спиртовых гидроксильных групп. При этом образуются так называемые алкоголяты и выделяется водород. Кислотные свойства у спиртов выражены несколько слабее, чем у воды, хотя связь кислород—водород и поляризована: О σ — Н σ+ . Алкильные группы отталкивают от себя электроны, снижая этим легкость отщепления протона по сравнению с водой: H H Oσ— C H σ+ H Реакция щелочных металлов со спиртами протекает медленнее, чем с водой. Алкоголяты — твердые вещества. Они подобны солям очень слабых кислот и при действии воды гидролизуются с образованием спирта и щелочи. Опыт 3. Взаимодействие глицерина с гидроксидом меди (II). Реактивы и материалы: глицерин; сульфат меди, 0,2 н. раствор; едкий натр, 2 н раствор. Помещают в пробирку 2 капли раствора сульфата меди, 2 капли раствора едкого натра и перемешивают— образуется голубой студенистый осадок гидроксида меди (II). В пробирку добавляют 1 каплю глицерина и взбалтывают содержимое. Осадок растворяется и появляется темно-синее окрашивание вследствие образования глицерата меди. Химизм процесса: H2C—OH HO—CH2 HC—OH + HO—Cu—OH + HO—CH H2C—OH HO—CH2 H2C—O HC—O HOH2—C O— CH2 Cu HH O—CH CH2OH +2H2O глицерат меди Глицерин—трехатомный спирт. Кислотность его больше, чем одноатомных спиртов: увеличение числа гидроксильных групп усиливает кислотный характер. Глицерин легко образует глицераты с гидроксидами тяжелых металлов. Однако способность его образовывать металлические производные (глицераты) с многовалентными металлами объясняется не столько его повышенной кислотностью, сколько тем, что при этом образуются внутрикомплексные соединения, обладающие особой устойчивостью. Соединения такого типа часто называют хелатными (от греческого «хела» — клешня). Опыт 4. Окисление этилового спирта оксидом меди (II). Реактивы и материалы: этиловый спирт; фуксинсернистая кислота, спираль из медной проволоки. Оборудование: пинцет. В сухую пробирку помещают 2 капли этилового спирта. Держа спираль из медной проволоки пинцетом, нагревают ее в пламени горелки до появления черного налета оксида меди. Еще горячую спираль опускают в пробирку с этиловым спиртом. Черная поверхность спирали немедленно становится золотистой вследствие восстановления оксида меди. При этом ощущается характерный запах уксусного альдегида (запах яблок). Подтверждением образования уксусного альдегида может служить цветная реакция с фуксинсернистой кислотой. В пробирку помещают 3 капли раствора фуксинсернистой кислоты и пипеткой вносят 1 каплю полученного раствора. Появляется розово-фиолетовая окраска (цветная реакция на альдегид). Химизм процесса: H H H3C—C—H +CuO --> CH3—C OH +Cu+H2O O Контрольные вопросы: 1. Какие органические соединения называются спиртами? 2. Чем ароматические спирты отличаются от фенолов? 3. Классификация спиртов. 4. Изомерия спиртов. 5. Рациональная номенклатура спиртов. 6. Современная заместительная номенклатура спиртов. 7. Карбинольная номенклатура спиртов. 8. Способы получения спиртов. 9. Физические свойства спиртов. 10. Ассоциация спиртов, водородная связь. 11. Кислотные и основные свойства спиртов. 12. Образование алкогометов. 13. Образование простых эфиров. 14. 3амегцение гидроксильной группы галогеном. 15. Образование сложных эфиров. 16. Дегидратация спиртов 17. Окисление спиртов. 18. Каталическое дегидрирование спиртов. 19. Номенклатура многоатомных спиртов. 20. Физические свойства многоатомных спиртов. 21. Способы получения многоатомных спиртов. 22. Химические свойства многоатомных спиртов. 23. Качественные реакции на многоатомные спирты. Л а б о р а т о р н а я р а б о т а ФЕНОЛЫ Цель работы: Изучить химические свойства фенолов. Студент должен знать: - функциональную группу фенолов; - отличие фенолов от ароматических спиртов; - химические свойства фенолов; - качественные реакции на фенолы; - методику проведения работы; - технику безопасности при выполнении опытов. 8 Уметь: - проводить качественные реакции на фенолы; - объяснить более сильный кислотный характер фенолов по сравнению со спиртами; - объяснить цветные реакции многоатомных фенолов; - объяснить методику проведения опытов. Опыт 1. Получение диэтилового эфира Реактивы материалы: этиловый спирт, 96%-ый; серная кислота В сухую пробирку вводят 2 капли этилового спирта и 2 капли серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси очень осторожно добавляют еще 2 капли этилового спирта. Ощущается характерный запах диэтилового эфира. Химизм процесса: 130°С C 2 H5 OH+H OC 2 H 5 ---> C 2 H 5 —O—C 2 H 5 +H2O H2SO4 Реакция проходит в две стадии. Сначала спирт реагирует с серной кислотой, образуя кислый сложный эфир серной кислоты — этилсульфат, или этилсерную кислоту: CH 3 —CH2 OH+ H O—SO3H <=> CH3—CH2—OSO3H+H2O этилсерная кислота Если спирт берется в избытке, то образуется простой эфир: CH3—CH2—O—SO3H+ НО—СН2—СН3 > CH3—CH2—O—CH2—CH3 + H2SO4 Если в реакцию вступает относительно много серной кислоты и мало спирта, то при дальнейшем нагревании (до 160°С) образуется олефин. Следовательно, в зависимости от температуры реакции и количественных соотношений спирта и серной кислоты возможны два случая дегидратации: а) с образованием этиленового углеводорода (внутримолекулярная дегидратация) и б) с образованием простого эфира (межмолекулярная дегидратация). Опыт 2. Получение фенолята натрия Реактивы и материалы: фенол, насыщенный раствор; едкий натр, 2 н. раствор. В пробирку помещают 4 капли эмульсии фенола в воде и добавляют 2 капли раствора едкого натра. Немедленно образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде. Раствор оставляют для следующего опыта. Химизм процесса: С6H5—OH + NaOH --> C6H5—ONa + H2O Фенолы обладают кислотными свойствами, они легко вступают в реакцию с водными растворами щелочей, образуя аналогичные алкоголятам феноляты. Поэтому простейший фенол назвали «карболовой кислотой». Более сильный кислотный характер фенолов по сравнению со спиртами объясняется влиянием бензольного ядра. Опыт 3. Разложение фенолята натрия соляной кислотой. Реактивы и материалы: фенолят натрия, раствор; соляная кислота, 2 н. раствор. К половине прозрачного раствора фенолята натрия (из опыта 2) добавляют каплю раствора соляной кислоты. Вновь выделяется свободный фенол в виде эмульсии: C 6 H 5 ONa+ НС1 --> С 6 Н 5 ОН + NaCl Феноляты щелочных металлов как соли слабых кислот и сильных оснований в водном растворе частично гидролизованы, поэтому их растворы обладают щелочной реакцией. Фенолы можно выделить из растворов фенолятов даже действием такой слабой кислоты, как угольная. О п ы т 4. Реакция фенола с хлоридом железа (III). Реактивы и материалы: фенол, насыщенный водный раствор; хлорид железа, 0,1 н. раствор. Помещают в пробирку 2 капли раствора фенола, добавляют 3 капли воды и 1 каплю раствора хлорида железа. Появляется интенсивное красно фиолетовое окрашивание. Фенолы с хлоридом железа в водном растворе дают цветную реакцию вследствие образования окрашенного соединения C6 H 5 OFeCl 2 или, точнее, окрашенного иона C 6 H 5 OFe 2+ . Эта реакция служит для качественного открытия фенолов. О п ы т 5. Получение трибромфенола. Реактивы и материалы: фенол, водный раствор; бромная вода, насыщенный раствор. В пробирку вводят 2 капли бромной воды и добавляют каплю водного раствора фенола. При этом бромная вода обесцвечивается, и жидкость мутнеет вследствие образования белого осадка трибромфенола. Химизм процесса: OH OH Br Br + 3Br2--> +3HBr Br симм-трибромфенол Гидроксильная группа относится к числу наиболее сильных орто-параориентантов. Реакции электрофильного замещения водорода в бензольном ядре для фенолов проходят значительно легче и в более мягких условиях, чем для бензола. Контрольные вопросы: 1. Строение фенола. 2. Изомерия фенолов. 3. Физические свойства фенолов. 4. Промышленные способы получения фенолов. 5. Кислотные свойства фенолов. 6. Образование фенолитов. 7. Образование простых эфиров. 8. Образование сложных эфиров. 9. Восстановление фенолов. 10. Реакции электрофильного замещения. 11. Гидрирование фенолов. 12. Окисление фенолов. Л а б о р а т о р н а я р а б о т а 9 АЛЬДЕГИДЫ И КЕТОНЫ Цель работы: Изучить химические свойства карбонильных соединений. Студент должен знать: - строение карбоксильных соединении; - функциональную группу альдегидов и кетонов; - номенклатуру альдегидов и кетонов; - химические свойства карбонильных соединении; - качественные реакции на альдегиды; - методику проведения опытов; - технику безопасности при проведении опытов. Уметь: -объяснить качественные реакции на альдегиды; - проводить характерные реакции на альдегиды и кетоны; - объяснить методику проведения опытов. О п ы т 1. Цветная реакция на альдегиды с фуксинсернистой кислотой. Реактивы и материалы: формальдегид, 40%-ный водный раствор; уксусный альдегид; фуксинсернистая кислота. В две пробирки помещают по 2 капли раствора фуксинсернистой кислоты и добавляют в одну из них 2 капли раствора формальдегида, в другую — 2 капли уксусного альдегида. добавлении раствора фиолетовый цвет, при Раствор фуксинсернистой формальдегида добавлении постепенно уксусного кислоты окрашивается альдегида—в при в розово- фиолетовый цвет. О п ы т 2. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала») Реактивы и материалы: формальдегид, 40%-ный водный раствор; аммиак, 2 н, раствор; нитрат серебра, 0,2 н. раствор. В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю раствора аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток (1—2 капли) раствора аммиака. Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделиться серебро в виде блестящего зеркального налета (комплексный ион металла восстанавливается до металлического серебра). Альдегид окисляется до кислоты, которая образует аммониевую соль. Химизм процесса: AgNO 3 +NH 3 OH --> AgOH+NH 4NO3, 2AgOH --> Ag2O+ H2O Ag 2 0 + 4NH 4 OH --> 2[Ag(NH3)2] OH +3H 2 O O O H—C +2[Ag(NH3)2]OH--> H— C H + 2Ag + 3NH3 + H2O ONH 4 Эта реакция также является качественной реакцией на альдегиды. Опыт 3. Окисление альдегидов гидроксидом меди (П). Реактивы и материалы: формальдегид, 40%-ный водный раствор; сульфат меди CuSO 4 , 0,2 н. раствор; едкий натр, 2 н. раствор. В пробирку помещают 4 капли раствора едкого натра, разбавляют его 4 каплями воды и добавляют 2 капля раствора сульфата меди. К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки. Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. В нагретой части пробирки выделяется желтый осадок гидроксида меди (I) СuОН, переходящий в красный оксид меди (I) Cu 2 О, а металлическая медь. иногда на стенках пробирки выделяется даже Химизм процесса: CuSO 4 + 2NaOH --> Cu(OH) 2 + Na 2 SO 4 O O H—C + 2Cu(OH)2 -->H—C + 2CuOH + H2O H H 2CuOH --> Cu 2 O + H 2 O Повторите этот опыт, заменив раствор формальдегида раствором уксусного альдегида. Эта реакция также является качественной реакцией на альдегиды. Опыт 4. Получение йодоформа из ацетона. Реактивы и материалы: ацетон; раствор иода в иодиде калия; едкий натр, 2 н. раствор. Помещают в пробирку 3 капли раствора иода в иодистом калии и 5 капель раствора едкого натра. Раствор обесцвечивается. К обесцвеченному раствору иодноватистокислого Мгновенно без нагревания натрия добавляют выпадает 1 каплю желтовато-белый ацетона. осадок с характерным запахом йодоформа. Химизм процесса: I 2 + 2NaOH --> NaOI +NaI+H 2 O CH3 —C—CH3 + 3NaOI--> CH3—C—CI3 +3NaOH O O CH 3 —C—CI3 + NaO H -->CH3—C—ONa + CHI3 O O Эта реакция очень чувствительная и используется для открытия ацетона (иодоформная проба на ацетон). Контрольные вопросы: 1. Функциональная группа альдегидов и кетонов. 2. Почему альдегиды и кетоны называются карбонильными соединениями? 3. Изомерия альдегидов. 4. Изомерия кетонов. 5. Рациональная номенклатура альдегидов. 6. Современная заместительная номенклатура альдегидов. 7. Рациональная номенклатура кетонов. 8. Современная заместительная номенклатура кетонов. 9. Способы получения карбонильных соединений. 10. Строение карбонильной группы. 11. Физические свойства карбонильных соединений. 12. Механизм реакции электрофильного присоединения к альдегидам и кетонам. 13. Реакции электрофильного присоединения. 14. Реакции замещения карбонильного кислорода. 15. Реакции полимеризации. 16. Реакции конденсации. 17. Окисление альдегидов. 18. Окисление кетонов. Л а б о р а т о р н а я р а б о т а 10 КАРБОНОВЫЕ КИСЛОТЫ Цель работы: Изучить химические свойства карбоновых кислот. Студенты должны знать: -функциональную группу карбоновых кислот; -номенклатуру карбоновых кислот; -химические свойства насыщенных карбоновых кислот; -химические свойства ненасыщенных кислот; -химические свойства двухосновных карбоновых кислот; -методику проведения опытов; -технику безопасности при проведении опытов. Уметь: -объяснить кислотные свойства карбоновых кислот; -проводить характерные реакции на карбоновые кислоты; -объяснить методику проведения опытов. Опыт 1. Окисление муравьиной кислоты перманганатом калия. Реактивы и материалы: муравьинокислый натрий; серная кислота, 2 н. раствор; перманганат калия, 0,1 н. раствор; баритовая вода, насыщенный раствор. Оборудование: газоотводная трубка. В пробирку помещают несколько крупинок муравьинокислого натрия, добавляют 2 капли раствора перманганата калия и 3 капли раствора серной кислоты. Отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опускают в пробирку с баритовой водой. Содержимое пробирки нагревают в пламени горелки. Через несколько секунд розовый раствор обесцвечивается, а баритовая вода во второй пробирке мутнеет. Химизм процесса: О О H–C-ONa +H2SO4 --> Н–С-ОН + NaHSO4 O O Н–С–ОН +[O] --> HO—C—OH -->H2O + CO2 СО2 + Ва(ОН)2 --> BaCO3+ H2O Муравьиная, кислота в отличие от других карбоновых кислот легко окисляется. Опыт 2. Разложение муравьиной кислоты при нагревании с концентрированной серной кислотой. Реактивы и материалы: муравьиная кислота безводная; серная кислота, концентрированная(d=l,84 г/см3). В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Бурно выделяется газ. При поджигании газ горит голубоватыми вспышками. Химизм процесса: О H2SO4, Н-С-ОН -----> CO+Н 2 О Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот. Опыт 3. Получение натриевой соли щавелевой кислоты. Реактивы и материалы: муравьинокислый натрий кристаллический; хлорид кальция, 0,1 н. раствор. В сухую пробирку помещают несколько крупинок муравьино-кислого натрия и сильно нагревают на пламени горелки. Расплавленная соль разлагается с выделением водорода. Содержимому пробирки дают остыть, добавляют к сплаву 3—4 капли воды и слегка нагревают до появления прозрачного раствора. В другую пробирку помещают несколько крупинок муравьинокислого натрия и добавляют 3—4 капли воды. В обе пробирки добавляют по 1 капле раствора хлорида кальция. В первой пробирке (с щавелевокислым натрием) образуется белый осадок нерастворимой в воде кальциевой соли щавелевой кислоты. В пробирке с раствором муравьинокислого натрия осадка не получается, так как кальциевая соль муравьиной кислоты растворима вводе. Химизм процесса: COONa 2H—COONa--->H 2 + COONa оксалат калия COONa COO + CaCl2 ---> COONa Ca + 2NaCl COO оксалат кальция 2H—COONa+CaCl2--> (H-COO)2Ca+ 2NaCl Получение щавелевой кислоты быстрым нагреванием формиата до 420°С является современным промышленным способом ее получения. Опыт 4. Разложение щавелевой кислоты при нагревании. Реактивы и материалы: щавелевая кислота кристаллическая; баритовая вода. Оборудование: газоотводная трубка с оттянутым концом. Несколько кристаллов щавелевой кислоты нагревают в пробирке с газоотводной трубкой, оттянутый конец которой опущен в пробирку с баритовой водой. Газ, выделяющийся при нагревании, вызывает помутнение баритовой воды. После этого газоотводную трубку вынимают из пробирки с баритовой водой и поджигают выделяющийся газ. Химизм процесса: СООН . нагревание · COOH 2H 2 O + 2H 2 O COOН СООН COOH нагревание CO 2 + H—COOH COOН Контрольные вопросы: 1. Функциональная группа карбоновых кислот. 2. Классификация карбоновых кислот. 3. Изомерия одноосновных кислот. 4. Номенклатура одноосновных кислот; 5. Способы получения одноосновных кислот; 6. Физические свойства одноосновных кислот; 7. Строение карбоксильной группы; 8. Химические свойства одноосновных кислот; 9. Изомерия непредельных одноосновных кислот. Номенклатура; 10. Способы получения непредельных одноосновных кислот; 11. Физические свойства непредельных одноосновных кислот; 12. Химические свойства непредельных кислот; 13. Номенклатура двухосновных кислот; 14. Способы получения двухосновных кислот; 15. Физические свойства двухосновных кислот; 16. Химические свойства двухосновных кислот. Л а б о р а т о р н а я р а б о т а 11 ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ Цель работы: Изучить химические свойства производных карбоновых кислот. Студент должен знать: - номенклатуру всех производных карбоновых кислот; - способы получения производных карбоновых кислот; - химические свойства производных карбоновых кислот; - методику проведения опытов; - технику безопасности при проведении опытов. Уметь: - проводить реакции, характеризующие химические свойства производных карбоновых кислот; - получить производные карбоновых кислот; - объяснить методику проведения опытов. Опыт 1. Получение уксусноэтилового эфира Реактивы и материалы; уксуснокислый натрий обезвоженный; этиловый спирт; серная кислота (d=l,84 г/см3). В сухую пробирку помещают немного порошка обезвоженного уксуснокислого натрия (высота слоя должна быть 1 — 1,5 мм) и 3 капли этилового спирта. Добавляют 2 капли концентрированной серной кислоты и осторожно нагревают над пламенем горелки. Вскоре появляется характерный приятный запах уксусноэтилового эфира. Важнейший карбоновых способ кислот со получения сложных эфиров — взаимодействие спиртами (реакция этерификации). В качестве катализаторов обычно применяют концентрированную H2SO4. Химизм процесса: O R – C – ONa +H2SO4 O R – С-ОН+NaHSО4 O O H+ R – C – OH+R˙— ОН↔R – C-OR˙+Н2О O O СН3-С-ОН + C2H5ОН↔СН3–С–OC2H5+ Н2О Реакция начинается с присоединения протона (образовавшегося при диссоциации минеральной кислоты) к карбонильному кислороду, имеющему частичный отрицательный заряд: R–C s+ –OH+Н + ↔ R – C + – OH Os- OH Вследствие этого увеличивается положительный заряд на атоме углерода карбоксильной группы, что делает его более способным к присоединению нуклеофильного реагента—спирта (за счет этого заряда осуществляется взаимодействие со свободной электронной парой атома кислорода спирта): OH H R—C+—OH + .. +R—O—H ↔ R—C : O—R .. OH OH Промежуточный комплекс стабилизуется путем отщепления воды и протона: Уксусноэтиловый эфир, или этилацетат, применяется в качестве растворителя. Опыт 2. Выделение свободных жирных кислот из мыла Реактивы и материалы: мыло, концентрированный раствор; серная кислота, 2 н. раствор. В пробирку помещают 5 капель концентрированного раствора мыла, добавляют 1 каплю раствора серной кислоты и слегка подогревают содержимое пробирки в пламени горелки. Всплывает белый маслянистый слой свободных жирных кислот, водный раствор осветляется. Содержимое пробирки оставляют для следующего опыта. Химизм процесса: С17Н35 -- COONa+ H2S04--->C17H35--COOH+ NaHSО4 стеариновая кислота Мыло—соли высших предельных и непредельных органических кислот. Твердое мыло — смесь натриевых солей пальмитиновой, стеариновой и олеиновой кислот. Опыт 3. Гидролиз спиртового раствора мыла Реактивы и материалы: этиловый спирт; мыло твердое; фенолфталеин,1%ный спиртовой раствор. В сухую пробирку помещают кусочек мыла, 4 капли спирта, энергично взбалтывают и добавляют 1 каплю фенолфталеина. Окраска раствора не меняется. К спиртовому раствору мыла прибавляют по каплям дистиллированную воду. По мере прибавления воды появляется розовое окрашивание. Интенсивность окраски постепенно увеличивается. Химизм процесса: C17H35COONa+ НОН → С17Н35СООН + NaOH C17H35COONa↔ [С17Н35СОО]- +Na+ [С17Н35СОО]- + НОН→С17Н35СООН+ОНРазбавление спиртового раствора мыла водой вызывает гидролиз мыла. В результате образуются малодиссоциированные жирные кислоты и едкий натр. Розовое окрашивание говорит о появлении в растворе гидроксильных ионов. Реакция водных растворов мыла всегда щелочная. Опыт 4. Образование нерастворимых кальциевых солей жирных кислот. Реактивы и материалы: мыло, раствор; хлорид кальция, 0,1 н. раствор. В пробирку помещают 2 капли раствора мыла, 1 каплю раствора хлорида кальция и взбалтывают содержимое пробирки. Выпадает белый осадок. Химизм процесса: 2 С17Н35CОONa+ СаС12→(CI7H35COO)2Ca+ 2NaCI стеарат кальция Кальциевые соли жирных кислот (кальциевое мыло) нерастворимы в воде. Кальциевое мыло выделяется при мытье в жесткой воде. Опыт 5. Получение фенолфталеина Реактивы и материалы: фталевый ангидрид; фенол жидкий; серная кислота (d=l,84 г/см3); едкий натр, 2 н. раствор; соляная кислота, 2 н. раствор. Оборудование: фильтровальная бумага. В сухую пробирку помещают несколько кристаллов фталевого ангидрида и 3 капли жидкого фенола. Добавляют 1 каплю серной кислоты. Содержимое пробирки осторожно нагревают над пламенем горелки до сплавления смеси (появляется темно-красное окрашивание). Дают смеси остыть и прибавляют 5—6 капель воды. Наносят каплю раствора на кусочек (3X3 см) фильтровальной бумаги, а когда капля впитается, помещают в центре пятна 1 каплю раствора едкого натра. Мгновенно появляется малиново-красное пятно. Часть малинового пятна смачивают 1 каплей раствора соляной кислоты— смоченный участок фильтровальной бумаги обесцвечивается. Если на этот участок поместить еще 1 каплю раствора щелочи, вновь появляется малиновая окраска. Фталевый ангидрид способен вступать в реакции конденсации со многими фенолами (с незамещенным атомом водорода в параположении). При этом образуются производные трифенилметана. Фенолфталеин получают конденсацией фталевого ангидрида с фенолом в присутствии серной кислоты: Фенолфталеин образует бесцветные кристаллы. При действии щелочей лактонное кольцо в фенолфталеине разрывается и получается фенолят—соль, содержащая хиноидную группу: в щелочной среде фенолфталеин окрашен в красный цвет. При действии кислоты происходит обратное превращение в лактоидную форму, в кислой среде красная окраска исчезает: Поэтому фенолфталеин применяется в качестве индикатора на щелочь. Контрольные вопросы: 1. Номенклатура галогенангидридов карбоновых кислот. 2. Способы получения галогенангидридов. 3. Химические свойства галогенангидридов. 4. Номенклатура ангидридов карбоновых кислот. 5. Способы получения ангидридов карбоновых кислот. 6. Химические свойства ангидридов карбоновых кислот. 7. Изомерия сложных эфиров. 8. Нахождение в природе и физические свойства сложных эфиров. 9. Способы получения сложных эфиров. 10. Химические свойства сложных эфиров. 11. Природные жиры. Состав жиров. 12. Техническая переработка жиров. 13. Способы получения амидов кислот. 14. Свойства амидов кислот. 15. Способы получения нитрилов кислот. 16. Свойства нитрилов кислот. Л а б о р а т о р н а я р а б о т а 12 НИТРОСОЕДИНЕНИЯ Цель работы: Получить нитросоединения и изучить его свойства. Студент должен знать: - строение нитросоединении; - получение ароматическихнитросоединении; - влияние нитрогруппы на бензольное ядро; - химические свойства нитросоединении; - методику проведения опытов; - технику безопасности при проведении опытов. Уметь: - объяснить влияние нитрогруппы на бензольное кольцо; - объяснить зависимость продуктов нитрированияот условии реакции; - объяснить методику проведения опытов. Опыт 1. Получение нитробензола. Реактивы и материалы: бензол; азотная кислота (d=l,4 г/см); серная кислота (d=l,84 г/см3). Оборудование: водяная баня; термометр. В сухую пробирку помещают 2 капли концентрированной азотной кислоты и 3 капли концентрированной серной кислоты. Полученную нитрующую смесь охлаждают и добавляют 2 капли бензола. Пробирку помещают в водяную баню, нагретую до 50—55 °С, на 2—3 мин, постоянно встряхивая содержимое пробирки. После этого выливают реакционную смесь в заранее приготовленную пробирку с водой. На дно опускается капля тяжелого, чуть желтоватого нитробензола, мутного от присутствия влаги. Химизм процесса: Активной формой нитрующего агента является катион нитрония NО+2, образующийся при действии серной кислоты на азотную: + - HO--NO2+ 2H2SО4<=>NO2 +2HSО4+ [Н3О]+ .. Ион гидроксония [Н 3 0] или H:O:H + образуется из .. H протона H+и молекулы воды в водных растворах минеральных кислот. Катион нитрония реагирует с ароматическим углеводородом: Скорость реакции нитрования зависит от объекта нитрования и состава нитрующей смеси. Для каждого соединения существует оптимальный состав. Опыт 2.Получение динитробензола. Реактивы и материалы: нитробензол; азотная кислота (d-1,4 г/см3); серная кислота (d—1,84 г/см3); Оборудование: водяная баня. В пробирку помещают 2 капли азотной кислоты и 3 капли серной кислоты. К горячей нитрующей смеси приливают 2 капли нитробензола и нагревают в кипящей водяной бане при постоянном взбалтывании 3—4 мин. Затем реакционную смесь охлаждают и выливают в пробирку с водой. Динитробензол вначале выделяется в виде тяжелой маслянистой капли, затем быстро переходит в кристаллическое состояние. Химизм процесса: Нитрогруппа относится к заместителям второго рода. Поэтому она уменьшает способность ароматического ядра к реакциям электрофильного замещения. Для введения второй нитрогруппы требуется большая длительность нитрования и более высокая температура, чем при получении мононитробензола. Для получения мононитробензола нужна температура 50 °С, а для получения динитробензола — 90°С. Опыт 3. Нитрование толуола Реактивы и материалы: толуол; азотная кислота(d=l,4г/см3); серная кислота (d=l,84 г/см3). В пробирке готовят нитрующую смесь из 2 капель концентрированной азотной кислоты и 3 капель концентрированной серной кислоты. К нитрующей смеси приливают 2 капли толуола и энергично встряхивают содержимое пробирки. Через 1—2 мин реакционную смесь выливают в пробирку с водой. На дно опускается тяжелая капля нитротолуола: При нагревании толуола получается смесь о- и n-нитротолуолов. В зависимости от условий нитрования относительные количества о- и n-изомеров в этой смеси различны. Гомологи бензола нитруются легче, чем бензол. Контрольные вопросы 1. Строение нитросоединений. 2. Изомерия нитросоединений. 3. Номенклатура нитросоединений. 4. Строение нитрогруппы. 5. Способы получения нитросоединений. 6. Физические свойства нитросоединений. 7. Химические свойства нитросоединений. 8. Таутомерия нитросоединений. 9. Влияние нитрогруппы на ароматическое ядро в реакциях элекрофильного замещения. 10. Способность ароматических нитросоединений к реакциям нуклеофильного замещения. 11. В чем разница нитрования алифатических углеводородов и аренов? Л а б о р а т о р н а я р а б о т а АМИНЫ Цель работы: Изучить химические свойства аминов. Студент должен знать: - строение аминов; - номенклатуру аминов; - химические свойства аминов; - качественные реакции анилина; - методику проведения опытов; - технику безопасности при проведении опытов. Уметь: - проводить качественные реакции на анилин; 13 - объяснить цветные реакции анилина; - объяснить влияние свободной электронной пары у атома азота на основность аминов; - объяснить методику проведения опытов. Опыт 1. Цветные реакции анилина Реактивы и материалы: анилин; хлорная известь, насыщенный раствор; дихромат калия, 0,5 н. раствор; соляная кислота(d-1,19 г/см 3 ); серная кислота, 2 н. раствор; лигнин (газетная бумага, лучинка). Оборудование: предметное стекло; стеклянная палочка. Цветная реакция с лигнином. В пробирку помещают 1 каплю анилина, 5 капель воды и по каплям добавляют соляную кислоту до образования прозрачного раствора солянокислого анилина. Каплю этого раствора наносят на полоску газетной бумаги. Появляется желто-оранжевое окрашивание. Лучинка, опущенная в раствор солянокислого анилина, также окрашивается в желто -оранжевый цвет. Окрашивание обусловлено присутствием в бумаге и древесине лигнина. Если раствором соли анилина смочить полоску фильтровальной бумаги, окрашивания не произойдет, так как фильтровальная бумага представляет собой чистую клетчатку без примеси лигнина. Цветная реакция с хлорной известью. Готовят раствор солянокислого анилина и каплю раствора наносят на предметное стекло. Добавляют каплю раствора хлорной извести. Появляется темно-зеленое окрашивание, переходящее в синее, а затем в черное. Эти реакции основаны на легкой окисляемости анилина. Конечным продуктом является «черный анилин»— краситель для хлопчатобумажных тканей, меха. Опыт 2. Бромирование анилина Реактивы в материалы: анилин (разбавленная анилиновая эмульсия); бромная вода, насыщенный раствор. В пробирку помещают 3 капли бромной воды и 1 каплю анилиновой воды. Выпадает белый осадок триброманилина: Являясь электронодонорным заместителем, аминогруппа повышает электронную плотность в ароматическом ядре, облегчая этим реакции электрофильного замещения. Вместо анилина можно использовать для этого опыта соли анилина. Они бромируются так же легко, как и сам анилин. Контрольные вопросы: 1. Строение аминов. 2. Изомерия аминов. 3. Номенклатура аминов. 4. Физические свойства аминов. 5. Способы получения аминов. 6. Амины — органические основания. 7. Химические свойства аминов. 8. Реакции азотной кислотой. 9. Цветные реакции анилина. Л а б о р а т о р н а я р а б о т а 1 4 УГЛЕВОДЫ Цель работы: Изучить химические свойства моносахаридов и олигосахаридов. Студент должен знать: - строение глюкозы; - качественные реакции на альдегидную группу глюкозы; - качественные реакции на спиртовые группы глюкозы; - формулы Фишера; - пирапозные и фуранозные формы моносахаридов формулы Хеуорса; - методику проведения опытов; - технику безопасности при выполнении опытов. Уметь: - доказать строение глюкозы; - пользоваться формулами Фишера и Хеуорса; - проводить качественные реакции на функциональные группы глюкозы; - объяснить методику проведения опытов. Опыт 1. Окисление глюкозы реактивом Фелинга Реактивы и материалы: глюкоза, 0,5%-ный раствор; реактив Фелинга В пробирку вводят 3 капли раствора глюкозы каплю реактива Фелинга (щелочного раствора медного алкоголята сегнетовой соли). Держа пробирку наклонно, осторожно нагревают верхнюю пусть раствора. При этом нагревая часть раствора окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I) СuОН, которая в дальнейшем переходит в красный осадок оксида меди (I) Сu 2 О. Реактивом Фелинга проводить окисление удобнее, чем гидроксидом меди Сu(ОН) 2 в присутствии щелочи, так как при добавлении большого количества сернокислой меди, может пройти побочная реакция образования избытка гидроксида меди (II) Сu(ОН) 2 и частично оксида меди (II) СuО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроксида меди (II) Сu(ОН) 2 и основная реакция окисления глюкозы протекает быстрее и более четко. Окисление реактивом Фелинга служит качественной реакцией на глюкозу. Опыт 2. Осмоление глюкозы щелочью. Реактивы и материалы: глюкоза, 0,5%-ный раствор; едкий натр, концентрированный раствор (40%-ный). В пробирку помещают 4 капли раствора глюкозы и добавляют 2 капли раствора едкого натра. Нагревают смесь до кипения и осторожно кипятят 2 3 мин. Раствор при этом желтеет, а затем становится темно-коричневым. При нагревании со щелочами моносахариды, подобно альдегидам, осмоляются и бурет, подвергаясь при этом расщеплению и отчасти окислению. Процесс осмоления ведет к образованию сложной смеси веществ. Продукты осмоления содержат несколько свободных гидроксильных групп и поэтому в отличие от альдегидной смолы хорошо растворимы в воде. Опыт 3. Окисление глюкозы аммиачным раствором оксида серебра (реакция «серебряного зеркала») Реактивы и материалы: глюкоза, 0,5%-ный раствор; нитрат серебра, 0,2 н. раствор; аммиак, 2 н. раствор; едкий натр, 2 н. раствор. В пробирку помещают каплю раствора нитрата серебра, 2 капли раствора едкого натра и приливают по каплям раствор аммиака до растворения образовавшегося осадка гидроксида серебра. Затем добавляют 1 каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания, и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налета. Химизм процесса: Моносахариды легко окисляются, причем в зависимости от условий получаются разнообразные продукты окисления. При осторожном окислении альдоз в кислой или нейтральной среде образуются альдоновые кислоты (одноосновные многоатомные оксикислоты). Кетозы (например, фруктоза) в этих условиях не окисляются. При окислении моносахаридов в щелочной среде происходит их глубокое расщепление с образованием ряда продуктов, в том числе очень легко окисляющихся. восстановителями. Поэтому моносахариды являются сильными При окислении моносахаридов в щелочном растворе не удается выделить продукты окисления с тем же числом углеродных атомов (как альдоновые кислоты при окисления альдоз в кислой среде). Подобно альдегидам, моносахариды восстанавливают аммиачный раствор оксида серебра с образованием осадка металлического серебра («серебряного зеркала»). Эту реакцию дают как альдозы, так и кетозы. Окисление оксидом серебра в щелочной среде служит качественной реакцией на моносахариды. Примечание. Пробирку для опыта необходимо тщательно вымыть (обезжирить) — прокипятить со щелочью и промыть водой. Если стенки пробирки грязные, то металлическое серебро выделяется в виде черного осадка. Опыт 4. Кислотный гидролиз сахарозы. Реактивы н материалы: сахароза, 1%-ный раствор; соляная кислота, 2 н. раствор; соляная кислота (d= 1,19 г/см 3 ); сульфат меди (II), 0,2 н. раствор; резорцин; лакмусовая бумага. В пробирку помещают 1 каплю раствора сахарозы, 1 каплю 2 н. соляной кислоты, 3 капли воды и осторожно нагревают над пламенем горелки 20 — 30сек. Половину раствора отливают в другую пробирку и добавляют к ней 4—5 капель раствора щелочи (до щелочной реакции на лакмус) и 3 —4 капли воды. Затем добавляют 1 каплю раствора сульфата меди и нагревают верхнюю часть синего раствора до кипения. Появляется оранжево -желтое окрашивание, доказывающее образование глюкозы. К оставшейся части гидролизованного раствора сахарозы (первая пробирка) прибавляют кристаллик резорцина 2 капли концентрированной соляной кислоты и нагревают до кипения. Появляется красноватое окрашивание, указывающее на образование фруктозы. Химизм процесса: Молекула сахарозы легко расщепляется при гидролизе на молекулу глюкозы и молекулу фруктозы. Оба моносахарида входят в состав сахарозы в циклических формах. В создании связи между ними участвуют оба гликозидных гидроксила. В сахарозе остаток фруктозы находится в виде непрочного пятичленного кольца — фуранозы; такие сложные сахара очень легко гидролизуются. Контрольные вопросы: 1. Какие вещества называют углеводами? Каков их состав? 2. Классификация углеводов. 3. Физические свойства углеводов. Их нахождения в природе. 4. Как доказать, что у глюкозы - нормальный углеродный скелет? 5. Как доказать наличие у глюкозы альдегидной группы? 6. Как доказать, что у глюкозы есть пять гидроксильных групп? 7. Проекционные формулы Фишера для моносахаридов. 8. Явление мутаротации. 9. Циклические (полуацетальные) формулы моносахаридов. 10. α и βформы моносахаридов. 11. Гликозиды. 12. Шестичленные циклические формы моносахаридов (пиранозные). 13. Пятичленные циклические формы моносахаридов (фуранозные). 14. Химические реакции на альдегидную группу глюкозы. 15. Химические реакции на гидроксильные группы глюкозы. 16. Спиртовое брожение гексоз. 17. Что такое олигосахариды? 18. Два типа дисахаридов. 19. Кислотный гидролиз сахарозы. Л а б о р а т о р н а я р а б о т а 15 ПОЛИСАХАРИДЫ Цель работы: Изучить химические свойства крахмала и клетчатки Студент должен знать: - строение крахмала; - строение клетчатки; - что происходит с полисахаридами при гидролизе; - химические свойства крахмала и клетчатки; - методику проведения опытов; - технику безопасности при выполнении опытов; Уметь: - объяснить строение и свойства крахмала; - объяснить строение и свойства клетчатки; - проводить характерные реакции на крахмал и клетчатку; - объяснить методику проведения опытов. Опыт 1. Образование фурфорола из пентозанов Реактивы и материалы: анилин; уксусная кислота ледяная; соляная кислота (d= 1,19 г/см); хлорид железа (III), 0,1 н. раствор; древесные опилки. Оборудование: стеклянная палочка; фильтровальная бумага; газоотводная трубка. В пробирку помещают щепотку древесных опилок, 5 капель соляной кислоты и 2 капли хлорида железа. Содержимое пробирки перемешивают стеклянной палочкой и осторожно нагревают 1—2 мин в пламени горелки. После этого отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опускают в пробирку-приемник, охлаждаемый ледяной пробирки, водой, и отгоняя продолжают фурфурол. нагревать На содержимое полоску реакционной фильтровальной бумаги помещают каплю отгона, каплю анилина и каплю ледяной уксусной кислоты. На бумаге образуется розово-красное пятно. Химизм процесса: В древесных опилках, сене, соломе, вишневом клее, отрубях, подсолнечной шелухе содержатся полисахариды пентозаны. Под действием энзимов или при нагревании с минеральными кислотами они гидролизуются и образуют пентозы. Реакция с солями анилина является одной из цветных реакций на фурфурол. Опыт 2. Реакция крахмала с иодом. Реактивы и материалы: крахмальный клейстер, 2%-ный раствор; иод, 0,1 н. водный раствор. В пробирку помещают 2 капли крахмального клейстера и 1 каплю раствора иода. Содержимое пробирки окрашивается в синий цвет. Полученную темно- синюю жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь. Крахмал представляет собой смесь двух полисахаридов — амилозы (20%) и амилопектина (80%). Амилоза растворима в теплой воде и дает с иодом синее окрашивание. И амилоза, и амилопектин состоят из остатков глюкозы, связанных α-гликозидными связями, но они отличаются формой молекул. Амилоза представляет собой линейный полисахарид, построенный из нескольких тысяч остатков глюкозы, обладающий структурой винта или спирали. Внутри спирали остается свободный канал диаметром около 5 мкм, в который могут внедряться посторонние молекулы, образуя особого типа комплексы — так называемые соединения включения. Одним из них является соединение амилозы с иодом, имеющее синее окрашивание. Строение амилозы схематически выражается следующей формулой: Амилопектин в теплой воде нерастворим, набухает в ней, образуя крахмальный клейстер. В состав амилопектина в отличие от амилозы входят разветвленные цепи глюкозных остатков. Амилопектин с иодом дает красновато - фиолетовое окрашивание. Опыт 3. Кислотный гидролиз крахмала. Реактивы и материалы: крахмальный клейстер, 2%-ный раствор; серная кислота, 2 н. раствор; раствор иода в КI, 0,1 н.; едкий натр, 2 н. раствор; реактив Фелинга; лакмусовая бумага красная. Оборудование: водяная баня; пипетка с капиллярным отверстием. B 7 пробирок помещают по 3 капли очень разбавленной почти бесцветной йодной воды. В фарфоровую чашку наливают 10 мл крахмального клейстера, добавляют 5 мл раствора серной кислоты и перемешивают содержимое стеклянной палочкой. Ставят чашку с раствором на асбестированную сетку и нагревают на маленьком пламени. Через каждые 30 сек. отбирают леткой с капиллярным отверстием 1 каплю раствора и переносят в очередную пробирку с йодной водой. Последовательные пробы постепенное изменение окраски при реакции с иодом. обнаруживают Проба Окраска Первая……………….Синяя Вторая……………….Сине-фиолетовая Третья ………………Красно-фиолетовая Четвертая…………….Красновато-оранжевая Пятая…………………Оранжевая Шестая……………….Оранжево-желтая Седьмая………………Светло-желтая (цвет йодной воды) Раствор охлаждают, нейтрализуют раствором щелочи по красной лакмусовой бумажке до сильнощелочной реакции, добавляют каплю реактива Фелинга и нагревают. Появление оранжевого окрашивания доказывает, что конечным продуктом гидролиза является глюкоза. Химизм процесса: (C 6 H 10 O 5 ) x + xH2O →xC6H12O6 Крахмал глюкоза При нагревании с разбавленными минеральными кислотами, а также под влиянием энзимов крахмал подвергается гидролизу. Гидролиз крахмала происходит ступенчато с образованием все более простых углеводов. Схема постепенного гидролиза крахмала такова: Первый продукт гидролиза—растворимый крахмал — не образует клейстера, с иодом дает синее окрашивание. При дальнейшем гидролизе образуются декстрины - более простые полисахариды, дающие с иодом окраску от сине-фиолетовой до оранжевой. Мальтоза, а затем глюкоза не изменяют обычную окраску иода. Опыт 4. Растворение клетчатки в реактиве Швейцера Реактивы и материалы: клетчатка (вата); реактив Швейцера; соляная кислота (d= 1,19 г/см 3 ). В пробирку помещают маленький кусочек гигроскопической ваты, и добавляют 6 капель реактива Швейцера (аммиачного раствора оксида меди). Содержимое пробирки перемешиваю стеклянной палочкой до полного растворения ваты. К полученному вязкому раствору приливают 4 капли воды и вновь перемешивают. При добавлении 1—2 капель концентрированной соляной кислоты выделяется клетчатка в виде белого студенистого осадка — гидратцеллюлозы. Выделившаяся клетчатка аналогична по составу исходной, по не имеет характерного волокнистого строения. Опыт 5. Взаимодействие клетчатки со щелочью Реактивы и материалы: клетчатка (фильтровальная бумага); едкий натр, концентрированный раствор; соляная кислота, 2 н. раствор. В пробирку помещают 5 капель воды и опускают в нее полоску фильтровальной бумаги, так чтобы она доходила дна пробирки. В другую пробирку помещают 5 капель раствора едкого натра и такую же полоску фильтровальной бумаги. Через 3 мин. вынимают бумажную полоску из воды и оставляют сохнуть. Затем вынимают полоску из щелочи, промывают водой, соляной кислотой (заранее наливают в третью пробирку), снова водой и сушат. Чтобы ускорить сушку, полоски, вынутые из жидкостей, слегка отжимаю между листами фильтровальной бумаги. Полоска, лежавшая в щелочи, плотнее и короче, чем полоска, лежавшая в воде. Клетчатка устойчива к действию щелочей. При обработке концентрированными растворами едких щелочей образуется прочное соединение щелочная клетчатка, или алкалицеллюлоза [(С6Н10О5) (С6Н9О5Nа)]х. Водой алкалицеллюлоза разлагается с образованием гидратцеллюлозы. Опыт 6. Кислотный гидролиз клетчатки Реактивы и материалы: клетчатка (фильтровальная бумага); серная кислота d 1,84 г/cм3); едкий натр. 2 н. раствор; реактив Фединга. Оборудование: водяная баня; стеклянная палочка. В пробирку помещают маленький кусочек фильтровальной бумаги, свернутый жгутом, добавляют 4 капли концентрированной серной кислоты и перемешиваю содержимое пробирки стеклянной палочкой. Волокна клетчатки постепенно растворяются. Образуется бесцветный густой раствор. Пробирку ставят на несколько минут в кипящую водяную баню. С помощью пипетки 2 капли раствора гидролизованной клетчатки помещают в отдельную пробирку, добавляют 6 капель раствора едкого натра, каплю реактива Фелинга, встряхивают содержимое пробирки и слегка нагревают в пламени горелки. Появляется желтое окрашивание, вызванное образованием гидроксида меди ( I ) СuОН. Химизм процесса: (C6H10O5)x +x H2O → x C6H12O6 Клетчатка глюкоза При нагревании с минеральными кислотами клетчатка подвергается гидролизу. Гидролиз идет постепенно, с образованием все более простых полисахаридов. В конечном итоге образуются целлобиоза и глюкоза, энергично восстанавливающие соединение окисной меди в щелочной среде. Контрольные вопросы: 1. Что такое полисахариды? 2. Где в природе встречается крахмал? 3. Амилоза и амилопектин. 4. Формула крахмала. 5. Гидролиз крахмала. 6. Качественная реакция на крахмал. 7. Применение крахмала. 8. Целлюлоза в природе. 9. Строение целлюлозы. 10. Свойства целлюлозы. 11. Применение целлюлозы. 12. Кислотный гидролиз крахмала. 13. Кислотный гидролиз клетчатки. Л а б о р а т о р н а я р а б о т а 16 БЕЛКОВЫЕ ВЕЩЕСТВА Цель работы: Изучить химические свойства белков. Студент должен знать: - строение белков; -цветные реакции на белки; - методику проведения опытов; -технику безопасности при проведении опытов. Уметь: - проводить цветные реакции на белки; - объяснить свойства белков; - объяснить методику проведения опытов. Опыт 1. Цветные реакции на белки. Реактивы и материалы: белки, водные растворы; едкий натр, 2 н. раствор; едкий натр, концентрированный раствор; азотная кислота (d=l,4 г/см 3 ); сульфат меди, 0,2 н. раствор; уксуснокислый свинец, 0,1 н. раствор; азотнортутный реактив; белая шерсть. 1.Биуретовая реакция. В пробирку помещают 2 капли исследуемого раствора белка, 1 каплю раствора щелочи и 1 каплю раствора сульфата меди. Жидкость окрашивается в фиолетовый цвет, который заметен даже в окрашенной водной вытяжке мяса. Биуретовая реакция связана с наличием в белках пептидных группировок—СО—NH—, которые и обусловливают появление окраски при взаимодействии с солями меди. 2.Ксантопротеиновая реакция. В пробирку вводят 3 капли водного раствора белка и 1 каплю азотной кислоты. Появляется белый осадок. При нагревании реакционной смеси раствор и осадок окрашиваются в ярко желтый цвет. Смесь охлаждают и добавляют 1—2 капли едкого натра. При этом желтое окрашивание переходит в ярко-оранжевое. Ксантопротеиновая реакция обусловлена наличием в белках ароматических аминокислот. Желтое окрашивание появляется как результат нитрования ароматических ядер. Появление оранжевой окраски определяется образованием более интенсивно окрашенных анионов. 3.Реакция на серу. В пробирку вводят комочек белой шерстяной пряжи, 2 капли раствора едкого натра, каплю раствора уксуснокислого свинца и нагревают содержимое пробирки в пламени горелки. Появляется коричнево черный осадок сульфида свинца. Эта реакция на содержание серы в белках. Ее дают белки, содержащие цистин, цистеин и метионин. 4.Азотнортутная реакция белков. В пробирку помещают 2 капли раствора белка и 1 каплю азотнортутного реактива, встряхивают содержимое пробирки и нагревают. Появляется характерное красное окрашивание. Эту реакцию дают белки, в состав которых входят аминокислоты, содержащие свободный фенольный гидроксил (тирозин, триптофан). Опыт 2. Обратимое осаждение белков из растворов. Реактивы и материалы: белки, водные растворы; сульфат аммония, насыщенный водный раствор. В пробирку помещают 2 капли раствора белка, 2 капли насыщенного раствора сульфата аммония и слегка взбалтывают. Появляется муть выпадающего в осадок белка (глобулина). Одну каплю мутного раствора приливают в другую пробирку с 3 каплями воды и встряхивают. Осадок растворяется. При добавлении к водным растворам белков концентрированных растворов минеральных солей белки осаждаются (высаливаются). При осаждении они не изменяют своих свойств и при разбавлении водой вновь переходят в раствор. Опыт 3. Свертывание белков при нагревании. Реактивы и материалы: белки, водные растворы; сульфат аммония, 2 н. раствор. В пробирку наливают 4 капли раствора белка и нагревают в пламени горелки до кипения. Белок при этом выпадает в виде мути или хлопьев. Содержимое пробирки слегка охлаждают, добавляют каплю раствора сульфата аммония и нагревают до начала кипения. Количество свернувшегося белка при этом увеличивается. Свертывание белков при нагревании характерно для большинства из них. Добавление нейтральных солей (сульфата аммония, хлорида натрия) облегчает и ускоряет свертывание белков при нагревании. Свертывание белков — процесс необратимого осаждения, так как белковые молекулы при этом меняют свою структуру. Контрольные вопросы 1. Что такое белки? Каков их состав? 2. Приведите пример белковых веществ. 3. Общие свойства белков. 4. Строение белков. Тип связи между остатками аминокислот. 5. В чем разнообразия белков? 6. Протеины и протеиды. 7. Пищевое и промышленное использование белков. Л а б о р а т о р н а я р а б о т а 17 ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Цель работы: С помощью качественных реакций доказать наличие функциональных групп в анализируемых веществах. Студент должен знать: - сущность проводимых анализов; - способность определения функциональных групп; - качественные реакции на органические соединения; - правила техники безопасности при выполнении работ; - методику выполнения работы. Уметь: - подобрать соответствующие реактивы; - провести качественный анализ органических соединений; - объяснить химизм протекающих реакций. Вариант 1 1. Изопропилуксусная кислота. 2. м – метиланилин Вариант 2 1. Вторбутилметанол 2. 2,3,3 – триметилбутаналь Вариант 3 1. 3 – хлорпентан 2. м – этилфенол Вариант 4 1. Пентанол - 2 2. Изобутилен Вариант 5 1. 2 - хлорпропан 2. 2,2 - диметилпропаналь Вариант 6 1. 2 – метилбутен - 1 2. этиленгликоль Вариант 7 1. трет - бутилацетилен 2. n – этиланилин Вариант 8 1. 2,3 – диметилбутановая кислота 2. n - изопропилфенол Вариант 9 1. Вторбутилхлорид 2. метилдиэтилуксусный альдегид Вариант 10 1. 3 – метилбутен - 2 2. диизопропилметан Вариант 11 1. 2,2 – диметил - 3 - хлоргексан 2. α – изобутил – β - пропилэтилен Вариант 12 1. м - изопропиланилин 2. 2,4 - диметилпентаналь Вариант 13 1. 2,3 – диметилпентан 2. 2,2 – диметил – 3 – этилгексен - 3 Вариант 14 1. Вторбутилэтилуксусная кислота 2. о - изопропиланилин Вариант 15 1. Пропандиол – 1,2 2. α – изопропил – β - этилэтилен Вариант 16 1. 2,6 - диметилфенол 2. изомасляный альдегид Вариант 17 1. 2,3 - диметилбутанол 2. Вторбутилхлорид Вариант 18 1. Изобутилацетилен 2. α, β - дитретбутилэтилен Вариант 19 1. Манноза 2. Изомасляная кислота Вариант 20 1. 2 – метилгексанол - 3 2. 2 - вторбутилфенол Вариант 21 1. Триэтилуксусный альдегид 2. 2,3 – диметил – 3 - хлорбутан Вариант 22 1. Диизопропилкарбинол 2. 2,4 - диметилгексаналь Вариант 23 1. Третбутилэтилметанол 2. Изопропилдиметилуксусная кислота Вариант 24 1. 2,4 - диизопропилфенол 2. 2,2,5 – триметилгексин - 3 Вариант 25 1. n - вторбутиланилин 2. 2,2,5,5 – тетраметилгептин - 3 Вариант 26 1. Галактоза 2. 2,3 – диметилпентен - 2 Вариант 27 1. Изобутилдиметилметан 2. 3,3 – диметилбутин - 1 Вариант 28 1. 2,2,3 – триметилгексановая кислота 2. 2,3 - диметилфенол Вариант 29 1. Изобутилхлорид 2. о - третбутиланилин Вариант 30 1. 2,2,3 - триметилгексаналь 2. вторбутилизопропилметанол Контрольные вопросы 1. Определение углерода. 2. Определение водорода. 3. Определение хлора. 4. Действие бромной воды на алканы, алкены и алкины. 5. Действие перманганата калия на алканы, алкены и алкины. 6. Качественное определение спиртов. 7. Качественные реакции на фенолы. 8. Качественные реакции на альдегиды, кетоны. 9. Качественное определение карбоновых кислот. 10. Качественная реакция на амины. 11. Качественное определение крахмала. 12. Качественное определение клетчатки (целлюлозы). 13. Цветные реакции на белок. Литература 1. Т.Н. Захарова, Н.А. Головлева, Органическая химия, М., Академия, 2012г