№ п/п - Лицей №6
реклама
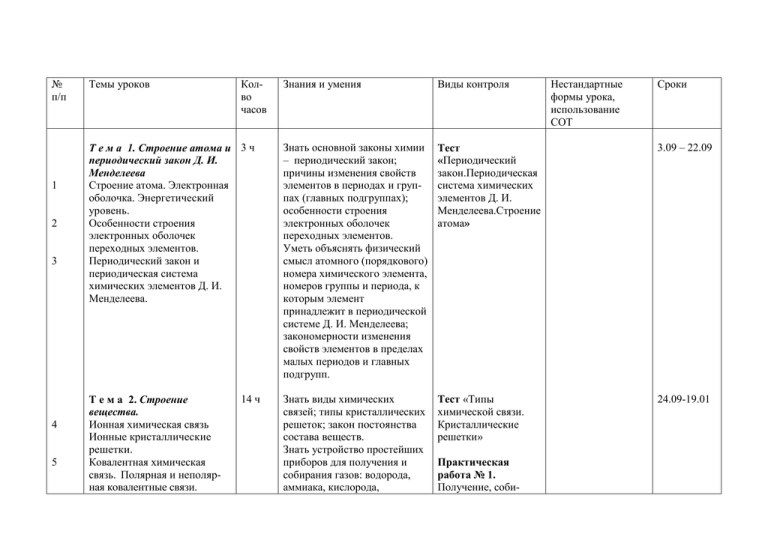
№ п/п 1 2 3 4 5 Темы уроков Колво часов Т е м а 1. Строение атома и 3 ч периодический закон Д. И. Менделеева Строение атома. Электронная оболочка. Энергетический уровень. Особенности строения электронных оболочек переходных элементов. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Т е м а 2. Строение вещества. Ионная химическая связь Ионные кристаллические решетки. Ковалентная химическая связь. Полярная и неполярная ковалентные связи. 14 ч Знания и умения Виды контроля Знать основной законы химии – периодический закон; причины изменения свойств элементов в периодах и группах (главных подгруппах); особенности строения электронных оболочек переходных элементов. Уметь объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д. И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп. Тест «Периодический закон.Периодическая система химических элементов Д. И. Менделеева.Строение атома» 3.09 – 22.09 Знать виды химических связей; типы кристаллических решеток; закон постоянства состава веществ. Знать устройство простейших приборов для получения и собирания газов: водорода, аммиака, кислорода, Тест «Типы химической связи. Кристаллические решетки» 24.09-19.01 Практическая работа № 1. Получение, соби- Нестандартные формы урока, использование СОТ Сроки 6 7 8 9 10 11 12 13 14 15 16 17 Молекулярные и атомные кристаллические решетки. Металлическая химическая связь и металлическая кристаллическая решетка. Водородная химическая связь. Полимеры. Пластмассы. Волокна. Неорганические полимеры. Газообразное состояние вещества. Практическая работа № 1. Получение, собирание и распознавание газов. Жидкое состояние вещества. Жесткость воды и способы ее устранения. Твердое состояние вещества. Аморфные твердые вещества в природе и в жизни человека, их значение и применение. Кристаллическое строение вещества. Дисперсные системы. Состав вещества и смесей. Закон постоянства состава веществ. Решение задач с использованием понятия «доля» и ее разновидности: массовая (доля элементов в углекислого газа. Уметь объяснять зависимость физических свойств веществ от типа кристаллической решетки. Уметь вычислять массовую долю химического элемента в веществе по формуле; массу или объем продукта реакции по известной массе или объему одного из исходных веществ, содержащего массовую долю примеси; вычислять массовую долю выхода продукта реакции от теоретически возможного; вычислять массовую (объемную) долю вещества в растворе. рание и распознавание газов. Письменная работа по решению задач на массовую долю вещества соединении, доля компонента в смеси — доля примесей, доля растворенного вещества в растворе) и объемная. Доля выхода продукта реакции от теоретически возможного. 18 19 20 21 22 23 24 8ч Т е м а 3. Химические реакции Типы химических реакций. Скорость химической реакции. Обратимость химических реакций. Способы смещения химического равновесия. Роль воды в химической реакции. Кислоты, основания и соли с точки зрения теории электролитической диссоциации. Гидролиз органических и неорганических соединений. Биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке. Окислительновосстановительные реакции. Электролиз. Практическое применение электролиза. Электролитическое получение алюминия. Знать закон сохранения массы веществ; типологию химических реакций по различным признакам; факторы, определяющие скорость химических реакций и состояние химического равновесия; сущность электролитической диссоциации. Уметь составлять полные и сокращенные ионные уравнения химических реакций; определять по составу солей реакцию среды раствора, определять направление смещения химического равновесия при изменениях температуры, давления, концентрации веществ; проводить расчеты по химическим формулам и уравнениям с участием органических и неорганических веществ. Тест «Типы Урок «Типы химических реакций» химических реакций» (с Тест «Скорость использованием химической реакции» сайта созданного учащимися МОУ Тест «Смещение лицея № 6) химического равновесия» Контрольная работа № 1 21.01-15.03 25 26 27 28 29 30 31 32 33 34 Контрольная работа № 1. Т е м а 4. Вещества и их 9ч свойства Металлы и их свойства. Коррозия металлов. Способы защиты металлов от коррозии. Неметаллы и их свойства. Кислоты неорганические и органические. Химические свойства кислот: Основания неорганические и органические. Основания, их классификация. Химические свойства оснований. Соли. Классификация солей. Химические свойства солей. Генетическая связь между классами неорганических и органических соединений. Практическая работа № 2. Решение экспериментальных задач на идентификацию органических и неорганических соединений. Контрольная работа № 2. Знать классификацию и свойства важнейших классов неорганических веществ в свете теории электролитической диссоциации и с позиции окисления-восстановления; способы защиты металлов от коррозии. Уметь объяснять сущность коррозии, процессов происходящих при электролизе расплавов и растворов веществ; уметь характеризовать: общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; разъяснять взаимосвязь органических и неорганических соединений, причинноследственную зависимость между составом, строением, свойствами и практическим использованием веществ. Уметь обращаться с лабораторным оборудованием; соблюдать правила техники Тест «Кислоты» Тест «Основания» Тест «Соли» Контрольная работа № 2. Урок – презентация «Коррозия металлов» 17.03-24.05 безопасности; выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ. № п/п Тема урока Т е м а 1. Строение атома и периодический закон Д. И. Менделеева 1 Строение атома. Электронная оболочка. Энергетический уровень. 2 Особенности строения электронных оболочек переходных элементов. 3 Периодический закон и периодическая система химических элементов Д. И. Менделеева. Колво часов Знания и умения Вид контроля 3ч Нестандартные формы урока, использование СОТ Сроки 3.09 – 22.09 Знать: основной законы химии – периодический закон; - причины изменения свойств элементов в периодах и группах (главных подгруппах); - особенности строения электронных оболочек переходных элементов. Уметь объяснять физический смысл атомного порядкового номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д. И. Менделеева; - закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп. Тест «Периодический закон. Периодическая система химических элементов Д. И. Менделеева. Строение атома» Т е м а 2. Строение вещества. 4 Ионная химическая связь Ионные кристаллические решетки. 5 Ковалентная химическая связь. Полярная и неполярная ковалентные связи. 6 Молекулярные и атомные кристаллические решетки. 7 Металлическая химическая связь и металлическая кристаллическая решетка. 8 Водородная химическая связь. 9 Полимеры. Пластмассы. Волокна. Неорганические полимеры. 10 Газообразное состояние вещества. 11 Практическая работа № 1. Получение, собирание и 14 ч 24.09-19.01 Знать: - виды химических связей; - типы кристаллических решеток; - закон постоянства состава веществ; - устройство простейших приборов для получения и собирания газов: водорода, аммиака, кислорода, углекислого газа. Уметь: - объяснять зависимость физических свойств веществ от типа кристаллической решетки; - вычислять массовую долю химического элемента в веществе по формуле; - вычислять массу или объем продукта реакции по известной массе или объему одного из исходных веществ, содержащего массовую долю примеси; -вычислять массовую долю выхода продукта реакции от теоретически возможного; вычислять массовую (объемную) долю вещества в С использованием ИКТ Тест «Типы химической связи. Кристаллические решетки» Практическая работа № 1 распознавание газов. 12 Жидкое состояние вещества. Жесткость воды и способы ее устранения. 13 Твердое состояние вещества. Аморфные твердые вещества в природе и в жизни человека, их значение и применение. Кристаллическое строение вещества. 14 Дисперсные системы. 15 Состав вещества и смесей. Закон постоянства состава веществ. 16-17 Решение задач с использованием понятия «доля» и ее разновидности: массовая (доля элементов в соединении, доля компонента в смеси — доля примесей, доля растворенного вещества в растворе) и объемная. Доля выхода продукта реакции от теоретически возможного. растворе. Письменная работа по решению задач на массовую долю вещества Т е м а 3. Химические реакции 18 Типы химических реакций. 19 Скорость химической реакции. 20 Обратимость химических реакций. Способы смещения химического равновесия. 21 Роль воды в химической реакции. Кислоты, основания и соли с точки зрения теории электролитической диссоциации Гидролиз органических и неорганических соединений. Биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке. 22 23 Окислительновосстановительные реакции. 24 Электролиз. Практическое применение электролиза. Электролитическое получение алюминия. 8ч 21.01-15.03 Знать: - закон сохранения массы веществ; - типологию химических реакций по различным признакам; - факторы, определяющие скорость химических реакций и состояние химического равновесия; - сущность электролитической диссоциации. Уметь: составлять полные и сокращенные ионные уравнения химических реакций; - определять по составу солей реакцию среды раствора; - определять направление смещения химического равновесия при изменениях температуры, давления, концентрации веществ; - объяснять сущность процессов происходящих при электролизе расплавов и растворов веществ; - проводить расчеты по С использованием ИКТ Тест «Типы химических реакций» Тест «Смещение химического равновесия» 25 химическим формулам и уравнениям с участием органических и неорганических веществ. Контрольная работа № 1 Т е м а 4. Вещества и их свойства 26 Металлы и их свойства. 27 Коррозия металлов. Способы защиты металлов от коррозии. 28 Неметаллы и их свойства. 29 Кислоты неорганические и органические. Химические свойства кислот: 30 Основания неорганические и органические. Основания, их классификация. Химические свойства оснований. 31 Соли. Классификация солей. Химические свойства солей. 32 Генетическая связь между классами неорганических и органических соединений. Контрольная работа № 1 9ч 17.03-24.05 Знать: классификацию и свойства важнейших классов неорганических веществ в свете теории электролитической диссоциации и с позиции окисления-восстановления; - способы защиты металлов от коррозии. Уметь: объяснять сущность коррозии; - характеризовать общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; - разъяснять взаимосвязь органических и неорганических соединений, причинноследственную зависимость между составом, строением, свойствами и практическим использованием веществ. С использованием ИКТ Тест «Кислоты» Тест «Основания» Тест «Соли» 33 Практическая работа № 2. Решение экспериментальных задач на идентификацию органических и неорганических соединений 34 Контрольная работа № 2 - обращаться с лабораторным оборудованием; - соблюдать правила техники безопасности; выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ. Практическая работа № 2. Контрольная работа № 2 МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ЛИЦЕЙ № 6 Рассмотрено на заседании кафедры и рекомендовано к утверждению протокол №_____от_______2007 г. заведующий кафедрой___________ УТВЕРЖДАЮ Директор МОУ лицея №6 ____________Е.Ю.Мицук приказ №____от_____2007 г. КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ХИМИЯ 11 М, Ф, Г, Э КЛАССЫ (34 часа, 1 час в неделю) Составлена на основе программы курса химии для 10—11 классов общеобразовательных учреждений (базовый уровень) Сост. О. С. Габриелян Москва: Дрофа, 2005 Учитель высшей категории Дробот С.С. г. Тольятти 2007 г.

