Качественный и количественный состав органических соединений. Вывод формулы.
реклама
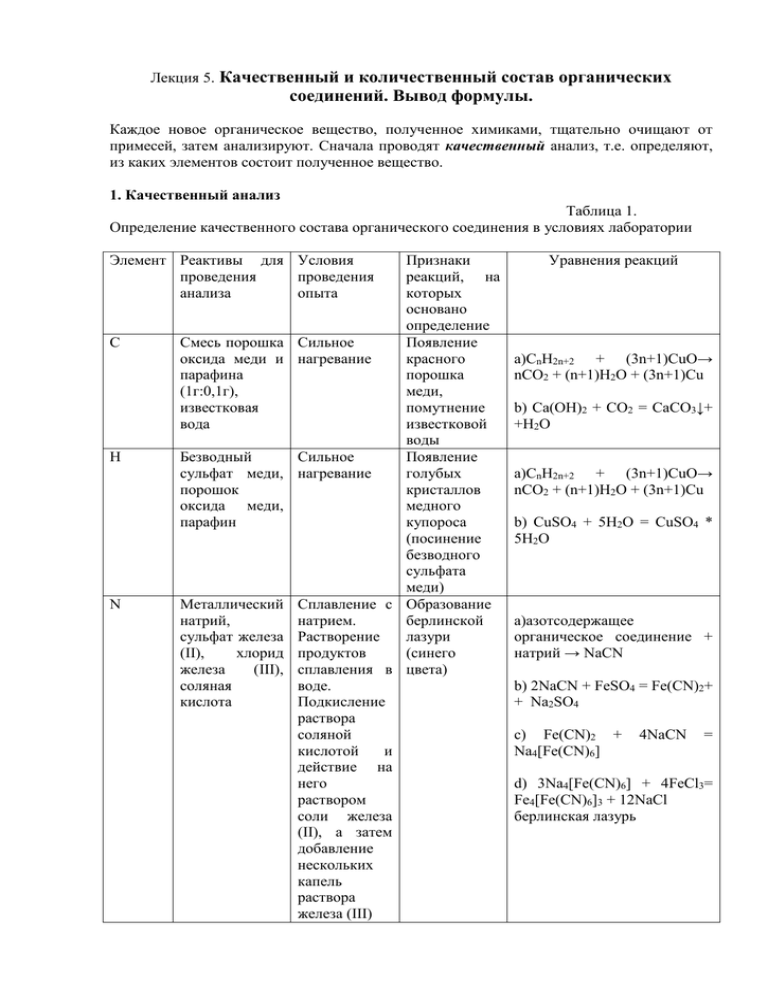
Лекция 5. Качественный и количественный состав органических соединений. Вывод формулы. Каждое новое органическое вещество, полученное химиками, тщательно очищают от примесей, затем анализируют. Сначала проводят качественный анализ, т.е. определяют, из каких элементов состоит полученное вещество. 1. Качественный анализ Таблица 1. Определение качественного состава органического соединения в условиях лаборатории Элемент Реактивы для Условия проведения проведения анализа опыта С H N Признаки реакций, на которых основано определение Смесь порошка Сильное Появление оксида меди и нагревание красного парафина порошка (1г:0,1г), меди, известковая помутнение вода известковой воды Безводный Сильное Появление сульфат меди, нагревание голубых порошок кристаллов оксида меди, медного парафин купороса (посинение безводного сульфата меди) Металлический Сплавление с Образование натрий, натрием. берлинской сульфат железа Растворение лазури (II), хлорид продуктов (синего железа (III), сплавления в цвета) соляная воде. кислота Подкисление раствора соляной кислотой и действие на него раствором соли железа (II), а затем добавление нескольких капель раствора железа (III) Уравнения реакций а)СnH2n+2 + (3n+1)CuO→ nCO2 + (n+1)H2O + (3n+1)Cu b) Ca(OH)2 + CO2 = CaCO3↓+ +H2O а)СnH2n+2 + (3n+1)CuO→ nCO2 + (n+1)H2O + (3n+1)Cu b) CuSO4 + 5H2O = CuSO4 * 5H2O а)азотсодержащее органическое соединение + натрий → NaCN b) 2NaCN + FeSO4 = Fe(CN)2+ + Na2SO4 c) Fe(CN)2 + Na4[Fe(CN)6] 4NaCN = d) 3Na4[Fe(CN)6] + 4FeCl3= Fe4[Fe(CN)6]3 + 12NaCl берлинская лазурь S Cl Металлический натрий, соляная кислота, ацетат свинца Свернутая спиралью медная проволока Сплавление с натрием. Растворение продуктов реакции в воде, действие на раствор соляной кислотой, а затем раствором ацетата свинца Прокаливание медной проволоки, внесение её в органическое вещество, а затем опять в пламя Запах сероводорода, а) органическое соединение, появление содержащее серу + натрий → черного Na2S осадка b) Na2S + 2HCl=2NaCl + H2S↑ c) H2S+(CH3COO)2Pb→PbS↓+ + 2CH3COOH Изумруднозелёное окрашивание пламени а) 2Сu + O2 = 2CuO b) вещество, содержащее хлор + CuO→CuCl2 + CuCl + + CO2 + H2O пары Кислород в составе органических соединений нельзя открыть простыми качественными реакциями, поэтому о его наличии судят по данным количественного анализа. Определяют массовое содержание С и Н, пересчитывая на них содержание продуктов окисления: СО2 и Н2О (СО2→С, Н2О→2Н). Если сумма массового содержания С и Н меньше 100, то делают вывод о том, что исследуемое вещество содержит кислород. 2. Количественный анализ Проводят путем сожжения микроколичеств (3-5 мг) исследуемого вещества в токе кислорода, количественно фиксируя прибором продукты сгорания. Если вещество содержит только С и Н, то продуктами сгорания являются СО2 и Н2О; если С, N, H, то продукты сгорания - N2 ,СО2 ,Н2О и т.д. По содержанию элементов определяют химическую формулу вещества. Химические формулы бывают простейшие и истинные. Простейшая формула показывает простейшее соотношение чисел атомов элементов в веществе или наиболее простой атомный состав вещества. Истинная формула показывает действительное число атомов каждого элемента в молекуле (для веществ молекулярного строения и называется для них молекулярной) или в элементарном фрагменте кристалла (для веществ кристаллических, немолекулярного строения). Для вывода простейшей формулы вещества достаточно знать его качественный и количественный состав. Для вывода истинной формулы, кроме качественного и количественного состава, необходимо вычислить любым из известных способов молярную или относительную молекулярную массу, иметь данные о массе, объеме, количестве вещества, формулу которого выводим. Молярную массу находят любым известным способом, например, измеряя давление пара, понижение температуры застывания бензола - криоскопия, повышение температуры кипения растворителя – эбулиоскопия и т.д. Для газов молярную массу при н.у. можно вычислить по формуле: ρ = M / Vm , где ρ – плотность газа, Vm – молярный объем газа (22,4 л/моль). В условиях, отличных от нормальных, молярную массу вычисляют по уравнению Менделеева-Клапейрона: М = mRT / pV , где m - масса вещества; V- объем данной массы вещества; р – давление; Т – абсолютная температура (по шкале Кельвина); R – универсальная газовая постоянная (8,31 Дж/К·моль). Расчет молярной массы можно вести через относительные плотности. Относительная плотность газа – это безразмерная величина, показывающая соотношение плотности данного газа с плотностью воздуха (обозначается Dвозд), водорода (DН2), др.газов. Dвозд = Мr (газа) / Мr (воздуха) = Мr (газа) /29 Примеры вычислений. Задача 1 Вывести простейшую формулу углеводорода, массовая доля С в котором 85,7%, Н – 14,3%. Дано: ω (С) = 85,7% ω (Н) = 14,3% Прост.формула -? Расчет ведем на 100 г вещества. В 100 г вещества содержится 85,7 г С и 14,3 г . ν (С) :ν (Н) = 85,7/12 + 14,3/1 = 7,15:14,3 = 1:2 Следовательно, в этом углеводороде на 1 атом С приходится 2 атома Н, т.е. его простейшая формула СН2. Истинную формулу установить нельзя, так как не хватает данных для вычисления молярной массы. Задача 2 Выведите молекулярную формулу вещества, содержащего углерод (массовая доля 85,7%) и водород (14,3%). Плотность паров по водороду равна 21. Дано: ω (С) = 85,7% ω (Н) = 14,3% DH2 = 21 Молекулярная формула -? СхHy Решение: Расчет ведем на 100 г вещества. ν (С) = 85,7/12 = 7,14 моль атомов С ν (Н) = 14,3/1 = 14,3 моль атомов Н ν (С) :ν (Н) = 1:2 М (СхHy) = 2·21 = 42 г/моль Формула вещества, исходя из полученного соотношения атомов С и Н: СnH2n Cоставляем уравнение: 12·n + 1·2n = 42 14n = 42 ; находим n = 3 Следовательно, формула вещества С3Н6 Задача 3 При сжигании газообразного углеводорода объемом 2,24 л (н.у.) получено 13,2 г оксида углерода (IV) и 7,2 г воды. Плотность газа по воздуху составляет 1,52. Найти молекулярную формулу газа. Дано: m(CO2) = 13,2 г m(Н2О) = 7,2 г Dвозд = 1,52 Мгаза - ? СxHy - ? Решение: С + О2 = СО2 2Н2 + О2 = Н2О 1. Находим число молей газа, атомов С и Н ν(С) = ν(СО2) = 13,2 / 44 = 0,3 моль ν(Н) = 2ν(Н2О) = 2·7,2 / 18 = 0,8 моль ν(газа) =2,24 / 22,4 = 0,1 моль 2. Составляем пропорцию: ν(газа) : ν(С) : ν(Н) = 0,1 : 0,3 : 0,8 = 1:3:8 т.е. 1 моль газа содержит 3 ат С и 8 ат Н – формула газа С3Н8 3. Проверим правильность выведенной формулы: Мгаза = 29 Dвозд = 29·1,52 = 44 г/моль М(С3Н8) = 3·12 + 8·1 = 44 г/моль Следовательно, формула газа С3Н8 Задача 4 Вывести молекулярную формулу газообразного углеводорода по следующим экспериментальным данным: массовая доля углерода – 92,3%, водорода – 7,7%, масса 1 л при н.у. равна 1,16 г. Дано: углеводород ω(С) = 92,3% ω(Н) = 7,7% ρ = 1,16 г/л Решение: 1. Вычисляем молярную массу углеводорода численно равную относительной молекулярной массе : М = ρ ·Vm = 1,16·22?4 = 26 г/моль 2. Находим число атомов С и Н в 1 моле углеводорода: Молекулярная формула - ? n(С) = 0,923 ·26 / 12 = 1,9998 = 2 СхHy - ? n(H) = 0,077·26 /1 = 2 Следовательно, истинная формула газа С2Н2 Задача 5 Определить молекулярную формулу вещества по следующим данным: сожгли газ массой 0,29 г, получили оксид углерода (IV) объемом 0,448 л и воду массой 0.45 г. Относительная плотность горючего газа по воздуху 2. Дано: m(газа) = 0,29 г m(Н2О) = 0,45 г V(CO2) = 0,448 л Dвозд = 2 Молекулярная Решение: 1.Определим качественный состав: углерод, водород и, возможно, кислород (так как при сжигании образовались Н2О и CO2). Чтобы проверить это, вычислим: формула вещества -? а) массу С в СО2: 0,448 л СО2 х − С 1 моль 22,4 л 1 моль 12 г Х = 0,448 · 12 / 22.4 = 0.24 г С б) массу водорода в Н2О 0.45 г х Н2О - 2Н 18 г 2г Х = 0,45 · 2 / 18 = 0,05 г Н Суммарная масса углерода и водорода составляет 0,24 + 0,05 = 0,29 г Следовательно, кислорода в составе вещества нет – это углеводород. 2.Количественный состав. Определим: а) молярную массу углеводорода M: М численно равна относительной молекулярной массе Мr, т.е. Мr = Dвозд ·Мr(возд) = 2 ·29 = 58 г/моль б) рассчитываем количество вещества горючего газа, продуктов сгорания, атомов С и Н: ν (газа) = m /M = 0.29 / 58 = 0,005 моль ν(СО2) = V / Vm = 0,448 / 22,4 = 0,02 моль → ν (С) = 0,02моль ν(Н2О) = m /M = 0,45 / 18 = 0,025 моль → ν (Н) = 0,05 моль 3. Найдем истинную формулу углеводорода: ν (газа) : ν(С) : ν(Н) = 0,005 : 0.02 : 0,05 = 1:4:10 Значит, 1 моль углеводорода содержит 4 моль атомов С и 10 моль атомов Н. Следовательно, молекулярная формула углеводорода С4Н10 - бутан Задача 6 При сгорании вещества массой 2,3 г образуется 4,4 г оксида углерода (IV), 2,7 г воды. Плотность паров этого вещества по воздуху 1,59. Вывести молекулярную формулу вещества. Дано: m(в-ва) = 2,3 г m(СО2) = 4,4 г m(Н2О) = 2,7 г Dвозд (в-ва) = 1,59 Молекулярная формула вещества -? Решение: 1. Принадлежность сгоревшего вещества к определенному классу не указана, но по продуктам сгорания можно сделать заключение о том, что его качественный состав: С, Н и, возможно, кислород. 2. Находим молярную массу вещества М численно равна относительной молекулярной массе Мr, т.е. Мr = Dвозд ·Мr(возд) = 1,59 ·29 = 46 г/моль 3. Вычисляем массы элементов С и Н в веществе по схемам: 4,4 г х СО2 − С 1 моль 44 г 1 моль 12 г Х = 4,4 · 12 / 44 = 1,2 г С 2,7 г х Н2О - 2Н 18 г 2г Х = 2,7 · 2 / 18 = 0,3 г Н 4. Сумма масс углерода и водорода 1,2 + 0,3 = 1,5 г, а масса сгоревшего вещества 2,3 г. Следовательно, в его составе есть третий элемент – кислород. Его масса равна 2,3 – 1,5 = 0.8 г 5. Найдем отношение числа атомов: n(C): n(Н): n(О) = 1,2 /12 : 0,3 /1 : 0,8 / 16 = 0,1 : 0,3 : 0,5 = 2 : 6 : 1 Молекулярная формула С2Н6О совпадает с вычисленной молярной массой. Это может быть либо этиловый спирт (этанол) С2Н5ОН, либо диметиловый эфир СН3 - О - СН3 . 3. Установление структурной формулы вещества Анализ органических веществ с целью установления их строения всегда являлся одной из главных задач органической химии. Поэтому очень важно правильно решить задачу по установлению структуры органических веществ. Информация может быть получена, исходя из метода синтеза соединения, его химических реакций, тестов на наличие функциональных групп. Появление физико-химических методов анализа (ИК-, УФ-, ЯМР-спектроскопии и т.д.) значительно расширило возможности химиков-органиков и ускорило развитие органической химии. Чаще всего используются физические методы, основанные на взаимодействии вещества с электромагнитным полем. При воздействии электромагнитного излучения на вещество может происходить изменение энергии молекул вещества в соответствии с уравнением Планка. Различные виды излучения оказывают воздействие на определённые структуры вещества, вызывая соответствующие изменения, которые фиксируются спектрометрами. Пример. Установить структурную формулу вещества С5Н10, если при его озонировании и последующем гидролизе озонида образуются ацетон и уксусный альдегид. Решение. 1. Соединение, имеющее формулу С5Н10 – алкен. 2. Краткая запись условия задачи: 3. В данном случае установить строение исходного углеводорода легко, следует только соединить двойные связи от ацетона и уксусного ангидрида, предварительно убрав кислород: 4. Проверяем, подставляя структурную формулу вещества в схему: Для самостоятельного решения: 1. Определите молекулярную формулу вещества, содержащего углерод (массовая доля 83,2%) и водород (16,28%), если молярная масса вещества равна 86. (С6Н14) 2. При сожжении вещества, содержащего углерод, водород и хлор, было получено 13,2 г СО2 и 6,3 г Н2О. При определении хлора из такой же навески вещества получили хлорид серебра массой 14,35 г. Определите формулу вещества, если плотность его паров по воздуху равна 2,707. (С3Н7Сl) 3. Определите молекулярную формулу газообразного вещества, если его плотность по воздуху равна 2, а массовая доля С 82,76% и Н 17,24%. (С4Н10) 4. При сжигании газообразного углеводорода образовалось 3,3 г диоксида углерода и 2,02 г воды. Плотность его по воздуху составляет 1,04. Напишите структурную формулу углеводорода. (С2Н6) 5. При сжигании вещества массой 2,5 г, содержащего 23% азота, образовались вода массой 3,42 г и оксид углерода((IV) массой 5,57 г. Вывести молекулярную формулу вещества. Если этой формуле соответствует несколько веществ, то написать их структурные формулы и назвать их. (С3Н9N) 6. При сгорании органического вещества массой 3,45 г, состоящего из водорода, углерода и кислорода, образовались оксид углерода (IV) массой 6,6 г и вода массой 4,05 г. Плотность паров этого вещества по воздуху 1,59. Определите молекулярную формулу этого вещества и напишите структурные формулы, учитывая явление изомерии.