Тема урока: «Жесткость воды и способы ее устранения». Цель урока:
реклама
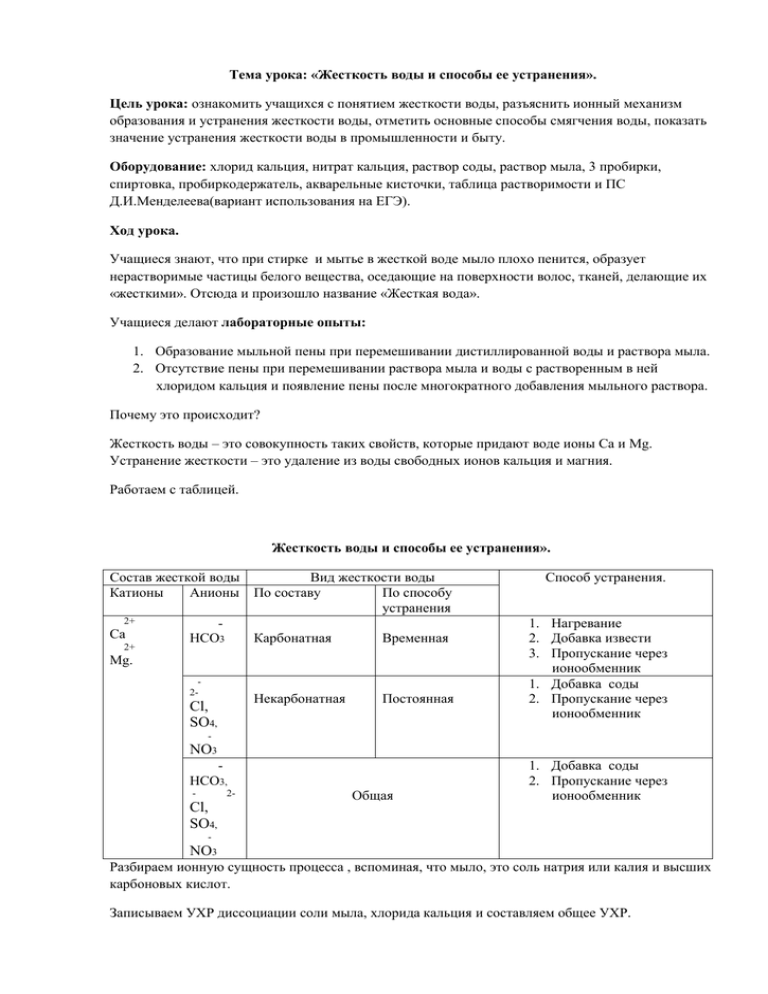
Тема урока: «Жесткость воды и способы ее устранения». Цель урока: ознакомить учащихся с понятием жесткости воды, разъяснить ионный механизм образования и устранения жесткости воды, отметить основные способы смягчения воды, показать значение устранения жесткости воды в промышленности и быту. Оборудование: хлорид кальция, нитрат кальция, раствор соды, раствор мыла, 3 пробирки, спиртовка, пробиркодержатель, акварельные кисточки, таблица растворимости и ПС Д.И.Менделеева(вариант использования на ЕГЭ). Ход урока. Учащиеся знают, что при стирке и мытье в жесткой воде мыло плохо пенится, образует нерастворимые частицы белого вещества, оседающие на поверхности волос, тканей, делающие их «жесткими». Отсюда и произошло название «Жесткая вода». Учащиеся делают лабораторные опыты: 1. Образование мыльной пены при перемешивании дистиллированной воды и раствора мыла. 2. Отсутствие пены при перемешивании раствора мыла и воды с растворенным в ней хлоридом кальция и появление пены после многократного добавления мыльного раствора. Почему это происходит? Жесткость воды – это совокупность таких свойств, которые придают воде ионы Са и Mg. Устранение жесткости – это удаление из воды свободных ионов кальция и магния. Работаем с таблицей. Жесткость воды и способы ее устранения». Состав жесткой воды Вид жесткости воды Катионы Анионы По составу По способу устранения 2+ Са НСО3 Карбонатная Временная 2+ Mg. 2- Некарбонатная Cl, SO4, Постоянная Способ устранения. 1. Нагревание 2. Добавка извести 3. Пропускание через ионообменник 1. Добавка соды 2. Пропускание через ионообменник - NO3 НСО3, - 2- Cl, SO4, Общая 1. Добавка соды 2. Пропускание через ионообменник - NO3 Разбираем ионную сущность процесса , вспоминая, что мыло, это соль натрия или калия и высших карбоновых кислот. Записываем УХР диссоциации соли мыла, хлорида кальция и составляем общее УХР. NaR=Na+R CaCl2 = Ca+2Cl Na+2R+Ca+2Cl = CaR +2Na +2Cl Учащиеся выполняют Л.О., размешивая смесь раствора мыла и жесткой воды с помощью акварельной кисточки. На ее волосках хорошо видны крупинки нерастворимых солей кальция и магния и высших карбоновых кислот. Рассматриваем посуду, дно и стенки которой покрыты белым налетом, накипью. Отчего это происходит? Л.О.Наливаем в пробирку воды из под крана, закрепляем пробирку в пробиркодержатель и нагреваем воду на пламени спиртовки до кипения, обращаем внимание на появление белого налета на стенках пробирки – это накипь!!!! Как она образовалась? Записываем УХР перехода гидрокарбонатов в карбонаты. Как удалить накипь? Обращаемся к таблице растворимости. Какие соли кальция и магния растворимы в воде? Значит нужно провести ХР, чтобы нерастворимые соли , перешли в растворимые. Проводим этот опыт, в качестве кислоты используем уксусную кислоту. Почему? Даю Д/З: провести домашний эксперимент по удалению накипи с чайника, используя кислоты, имеющиеся дома: уксусную и лимонную. Делаем вывод, подводим итог урока. Задача: Сколько осадка образуется при продолжительном кипячении 1 тонны воды, содержащей 8, 1% гидрокарбоната кальция? Раздаточный материал на столы учащихся. Жесткость воды и способы ее устранения». Состав жесткой воды Вид жесткости воды Катионы Анионы По составу По способу устранения 2+ Са НСО3 Карбонатная Временная 2+ Mg. 2- Некарбонатная Cl, SO4, Постоянная Способ устранения. 4. Нагревание 5. Добавление извести 6. Пропускание через ионообменник 3. Добавление соды 4. Пропускание через ионообменник - NO3 НСО3, - Общая 2- Cl, SO4, 3. Добавление соды 4. Пропускание через ионообменник - NO3 Задача: Сколько осадка образуется при продолжительном кипячении 1 тонны воды, содержащей 8, 1% гидрокарбоната кальция? Жесткость воды и способы ее устранения». Состав жесткой воды Вид жесткости воды Катионы Анионы По составу По способу устранения 2+ Са НСО3 Карбонатная Временная 2+ Mg. 2- Некарбонатная Cl, SO4, Постоянная Способ устранения. 1. Нагревание 2. Добавление извести 3. Пропускание через ионообменник 1. Добавление соды 2. Пропускание через ионообменник - NO3 НСО3, - 2- Cl, SO4, Общая 1. Добавление соды 2. Пропускание через ионообменник - NO3 Задача: Сколько осадка образуется при продолжительном кипячении 1 тонны воды, содержащей 8, 1% гидрокарбоната кальция?
