Лекция 2 .
реклама

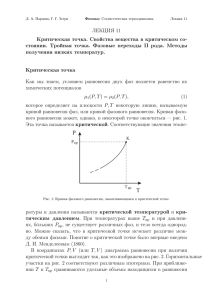
Лекция №2 1. Фазовые переходы жидкость-пар Условия устойчивости однокомпонентной жидкости Эти условия выводятся в общем курсе термодинамики, исходя из очень простого и, в сущности, очевидного утверждения: система находится в состоянии устойчивого равновесия, если минимальная работа A , необходимая для вывода системы из этого состояния, положительна. Надо признать, что для того, чтобы получить выражение для минимальной работы, нам потребовались в том же курсе термодинамики не очень сложные, но довольно тонкие рассуждения. Результат этих рассуждений может быть сформулирован в виде простого неравенства A E T S PV 0 Здесь E , S и V изменения энергии, энтропии и объема системы при ее отклонении от равновесия, а T и P - температура и давление, которые в процессе этого отклонения поддерживаются постоянными. Так как мы рассматриваем лишь малые отклонения от равновесия, величину E можно представить в виде E E S V S V V S E 2E 2E 1 2 E 2 2 2 S 2 V S V ... 2 2 S V V S V S Учитывая, что в соответствии с определениями температуры и давления E T , а S V E P, V S получаем выражение для минимальной работы в виде квадратичной формы 2 E 2 E 1 2 E 2 2 A 2 S 2 V S V . 2 2 S V S V V S В соответствии с условием устойчивости ( A 0 ) эта квадратичная форма должна быть положительно определенной. Условия положительной определенности квадратичной формы сводятся к двум условиям на ее коэффициенты: а) положительности коэффициента перед величиной S 2 2 E T T 0, 2 S S C V V V S ( CV - изохорная теплоемкость системы, равная по определению CV T ) T V б) положительности определителя 2E 2E ; 2 S V V S 2E 2E ; 2 V S V S 2 2E 2E 2E 2 2 0. V S S V V S Не трудно показать, что последнее условие сводится к виду 2 2 2 E 2 E 2 E 2 E 2 E 2 E 2 2 2 2 V S S V V S S V V S V S 2 T P P Cv V S S V T T S Cv V 2 E S 2 V P 0. V T Таким образом, для устойчивости однокомпонентной жидкости необходимо, чтобы ее изохорная теплоемкость CV была положительной, а производная P V T отрицательной Cv 0; P v T 0 . Эти условия имеют совершенно понятный даже с житейской, бытовой точки зрения смысл. Положительность теплоемкости означает, что, если хотите нагреть систему (увеличить ее температуру: T 0 ), гоните в систему тепло ( Q 0 ). Если хотите охладить систему ( T 0 ), то придумайте способ, как отобрать у нее тепло ( Q 0 ). Q и T всегда имеют один и тот же знак. Отрицательность производной P V T означает, что при изотермическом расширении системы ( V 0 ) давление всегда уменьшается сжатии ( V 0 ) давление может только расти ( P 0 ). v ( P 0 ), а при и P всегда имеют противоположные знаки. Что с той же самой бытовой точки зрения также вполне очевидно. Нарушение любого из этих условий приводит к коллапсу системы. Мне неизвестно ни одного случая, когда бы нарушалось условие положительности теплоемкости, т.е. первое из приведенных условий. Второе условие ( P V T 0 ) вещь более деликатная, и поэтому рассмотрим его более подробно. Предположим, что уравнение состояния системы нам известно, т.е. предположим, что нам известна зависимость давления от температуры и объема системы. Например, это может быть уравнение ван-дер-Ваальса или какое-либо другое уравнение состояния. P P T , v На рисунке 1 приведены рассчитанные по уравнению ван-дер-Ваальса зависимости давления от объема при нескольких фиксированных температурах. В случае использования любого другого уравнения (а их известно много десятков) эти кривые качественно имеют совершенно аналогичный вид. Рис. 1 Перечислим основные характерные черты этих кривых. При высоких температурах система близка к идеальному газу. Действительно, температура средняя kBT ( k B характеризует среднюю кинетическую энергию молекул: Eкинетич постоянная Больцмана). Соответственно, при повышении температуры кинетическая энергия молекул растет и, в конечном счете, окажется много больше характерной энергии их взаимодействия. Но это и есть условие того, что система представляет собой идеальный газ. Уравнение состояния идеального газа имеет вид N RT RT ; V v N - полное число молей в газе; v - объем одного моля; R - универсальная газовая постоянная. Соответственно, зависимость давления от объема при этих температурах близка к гиперболе. При понижении температуры на кривой зависимости давления от объема появляется точка перегиба. Наконец, при некоторой температуре касательная к кривой P v, T const в точке перегиба оказывается горизонтальной. Условие перегиба с горизонтальной касательной имеют вид P P v T 0; P v 2 2 T 0; P v 3 3 T 0 Очевидно, что условие P v T 0 в этой точке нарушается. Это очень специальная и очень важная точка, определяющая все основные свойства той или иной конкретной жидкости. Если зависимость давления от температуры и объема нам известна, то условия P v T 0; 2 P v 2 0 сводятся к двум T уравнениям относительно двух неизвестных: критической температуры Tc и критического объема vc . Решая эти уравнения и подставляя найденное решение в уравнение состояния P P T , v , мы найдем критическое давление Pc . В случае, когда температура системы выше критической температуры, имеет место взаимно однозначное соответствие между давлением и объемом системы. Это означает, что рассматриваемый нами флюид при указанных температурах всегда находится в однофазном состоянии. Из рисунка видно, что в случае, когда температура оказывается меньше критической температуры, характер кривых P v, T const меняется. Появляется область давлений, в которой каждому данному давлению соответствуют три различные значения объема. Это означает, что в этой области параметров система может находиться в двухфазном состоянии. В критической точке имеет место фазовый переход из однофазного в двухфазное состояние. Другими словами, в критической точке мы имеем фазовый переход из однородного в неоднородное состояние. Я хочу обратить ваше внимание на эти слова: однородное состояние и неоднородное состояние. Эти слова означают, что в критической точке имеет место изменение симметрии системы. Изменение симметрии системы является наиболее общим признаком фазового перехода Наконец, последнее замечание, которое я хотел бы сделать в этом разделе. Вопрос: почему при температурах ниже критической, мы говорим только о двухфазном равновесии, несмотря на то, что при заданном давлении существует три различных значения объема? Ответ состоит в том, что, как видно из рисунка, промежуточному значению объема соответствует производная P v T 0 . А это значит, что система в этой области абсолютно неустойчива. Описанное поведение типично для любой жидкости. Нам теперь предстоит ответить на принципиальный вопрос: коль скоро при любой температуре, ниже критической, существует целый интервал давлений, внутри которого возможно двухфазное равновесие, то, как найти то единственное, истинное давление, которое соответствует двухфазному равновесию системы при заданном значении температуры.