Номер урока Содержание (разделы, темы) Кол
реклама
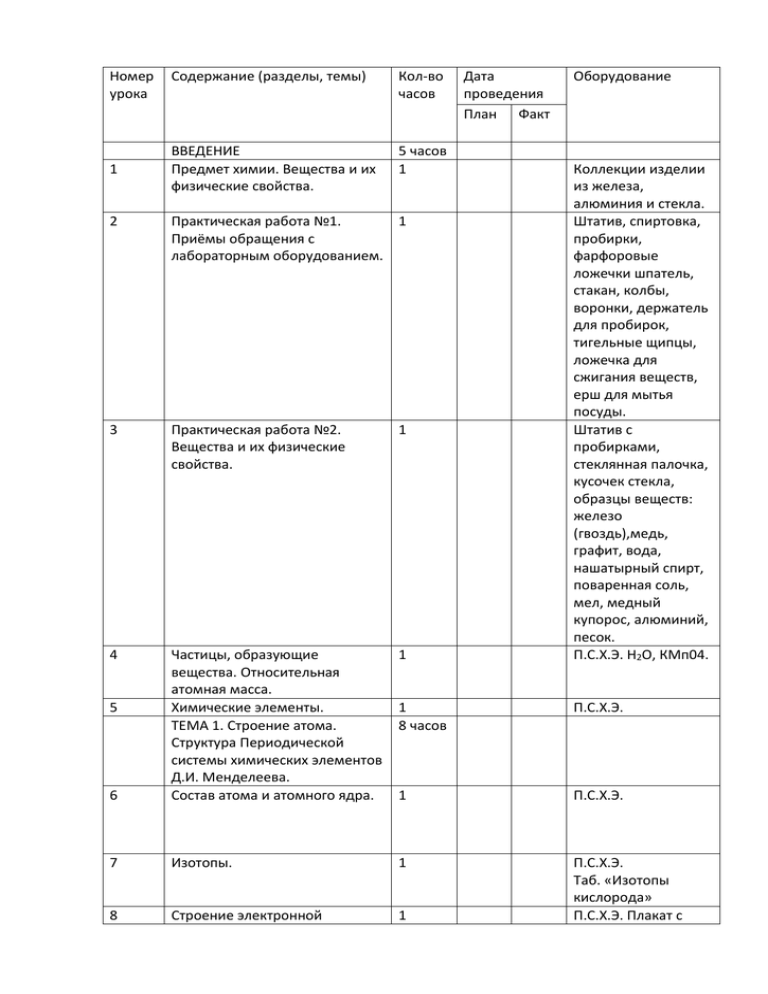
Номер урока 1 Содержание (разделы, темы) Кол-во часов ВВЕДЕНИЕ Предмет химии. Вещества и их физические свойства. 5 часов 1 2 Практическая работа №1. 1 Приёмы обращения с лабораторным оборудованием. 3 Практическая работа №2. Вещества и их физические свойства. 1 4 1 6 Частицы, образующие вещества. Относительная атомная масса. Химические элементы. ТЕМА 1. Строение атома. Структура Периодической системы химических элементов Д.И. Менделеева. Состав атома и атомного ядра. 7 8 5 Дата проведения План Факт Оборудование Коллекции изделии из железа, алюминия и стекла. Штатив, спиртовка, пробирки, фарфоровые ложечки шпатель, стакан, колбы, воронки, держатель для пробирок, тигельные щипцы, ложечка для сжигания веществ, ерш для мытья посуды. Штатив с пробирками, стеклянная палочка, кусочек стекла, образцы веществ: железо (гвоздь),медь, графит, вода, нашатырный спирт, поваренная соль, мел, медный купорос, алюминий, песок. П.С.Х.Э. H2O, КМп04. 1 8 часов П.С.Х.Э. 1 П.С.Х.Э. Изотопы. 1 Строение электронной 1 П.С.Х.Э. Таб. «Изотопы кислорода» П.С.Х.Э. Плакат с оболочки атомов элементов первого и второго периодов. 9 Строение электронной оболочки атомов третьего и четвертого периодов. 1 10 Структура Периодической системы химических элементов Д.И. Менделеева. Периодическое изменение некоторых характеристик и свойств атомов химических элементов. Характеристика химического элемента на основе его положения в Периодической системе. Контрольно-обобщающий урок по теме «Строение атома. Структура периодической системы». ТЕМА 2. Химическая связь. Строение вещества. Химические формулы. Относительная молекулярная масса вещества. Вычисления по химическим формулам. Простые и сложные вещества. Л.о.1. 1 электронными схемами атомов водорода, гелия, лития и неона. П.С.Х.Э. Плакат с электронными схемами атомов натрия, аргона, калия и кальция. П.С.Х.Э. 1 П.С.Х.Э. 1 П.С.Х.Э. 1 П.С.Х.Э. 11 12 13 14 15 16 17 18 13 часов 1 1 1 Итоговый урок. Систематизация 1 и обобщение изученного материала. Контрольная работа №1 по 1 темам «Строение атома. Структура Периодической системы химических элементов». Си-медная проволока, NaClповаренная соль, графит-стержень карандаша, сахар, S, O2, H2SO4, NaHCO3питьеваявода, I2, H2O, F, Al,медный купорос, CH3COOHуксусная кислота. 19 Ковалентная связь. 20 Ковалентная полярная и 1 неполярная связь. Электроотрицательность атома. 21 Вещества молекулярного строения. Закон постоянства состава. 1 22 Ионная связь. Вещества ионного строения. 1 23 Количество вещества. Моль. Молярная масса. 1 24 Упражнения в вычислениях с использованием физических величин. Степень окисления. Составление химических формул бинарных соединений по степеням окисления. ТЕМА №3. Классификация сложных неорганических веществ. Оксиды. Определение, состав. Номенклатура и классификация. Основания. Определение, состав. Номенклатура и классификация. 1 Кислоты. Определение, состав. Классификация и 1 25 26 27 28 29 1 1 1 Плакат со схемами образования ковалентной связи. Плакат со схемами образования ковалентной полярной и неполярной связи. Модели молекулярных кристаллических решеток сахара, углекислого газа и йода. Плакат со схемами образования связи. Модель кристаллической решетки поваренной соли. Образцы ионных соединений. Различные соединения количеством вещества 1 моль. П.С.Х.Э. П.С.Х.Э. 6 часов 1 П.С.Х.Э. 1 П.С.Х.Э. Таб. «Растворимость кислот, оснований и солей в воде». Образцы оснований растворимых и нерастворимых в воде. П.С.Х.Э. образцы без кислородных и номенклатура. 30 Соли. Определение, состав. Классификация и номенклатура. Л.о.2. 1 31 Итоговый урок. Систематизация и обобщение знаний по темам «Химическая связь. Строение вещества» и «Классификация сложных неорганических веществ». Контрольная работа №2. «Химическая связь. Строение вещества» и «Классификация сложных неорганических веществ». Тема № 4. Химические реакции. Физические и химические явления. Химические реакции.Л.о.3 Л.о.4. 1 34 Закон сохранения массы веществ. Уравнения химической реакции. 1 35 Практическая работа №3. Признаки химических реакций. 1 32 33 кислородсодержащ их кислот. Образцы солей без кислородных и кислородсодержащ их кислот. Таб. «Растворимость кислот, оснований и солей в воде». HCl, CaO, NaCl, KNO3, NaHCO3,CO2, Ba(OH)2, SiO2, Ca3 (PO4)2, Na2CO3, H2SO4, Mg(OH)2. 1 8 часов 1 Спиртовка, фарфоровая ложечка, парафин, р-р КI, CLг- хлорная вода, р-р BaCL2,р-р H2SO4, HCL, Zn, р-р Na2S, лучина. Стеклянная трубка, медная пластинка, держатель. Весы с разновесами, колба с ргом FeCb, пробирка с р-ом КОН. Штатив с пробирками , лучинка, спички, фарфоровая ложечка, СаСО3кусочки мела,НСL, рр NaОН, мыло, фенолфталеин, порошок СаО, дистиллированная вода 36 Основные типы химических реакций. Основные типы химических реакций. Л.о.5 1 Расчеты по уравнения химических реакций. Итоговый урок. Систематизация и обобщение знаний по теме «Химические реакции». Контрольная работа №3по теме «Химические реакции». ТЕМА №5. Растворы. Электролитическая диссоциация. Чистые вещества и смеси веществ. Способы разделения смесей. 1 42 Практическая работа № 4. Очистка поваренной соли. 1 43 Понятие о растворах. Процесс растворения. Кристаллогидраты. Л.о.6. Выражение количественного состава раствора. Практическая работа № 5. Приготовление раствора и измерение его плотности. 1 37 38 39 40 41 44 45 1 Спиртовка, держатель, медная пластина. Пробирка с Си(ОН)2. Р-р СuSO4, железный гвоздь. 1 1 14 часов 1 Штатив, стакан, Целительная воронка, смесь растительного масла и воды. 2хим.стакана, фильтровальная бумага, ножницы, хим.воронка, стеклянная палочка с резиновым наконечником, фарфоровая чашка, штатив с кольцом, огнезащитная прокладка, спиртовка, спички, фарфоровая ложечка, поваренная соль, дистиллированная вода. Пробирка с СLLSO4,Н2O. 1 1 Медный цилиндр, ареометр, стакан, стеклянная палочка 46 Электролитическая диссоциация. 1 47 Основные положения теории электрической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Кислоты и основания в свете представлений об электролитической диссоциации. Соли в свете представлений об электролитической диссоциации. Среда водных растворов электролитов. Л.о.7. 1 Практическая работа №6.Определение рН среды. 1 48 49 50 51 с резиновым наконечником, весы с разновесами, фарфоровая ложечка, часовое стекло, испытуемый раствор и поваренная соль, дистиллированная вода. Прибор для наблюдения электропроводности веществ, дистиллированная вода NaCL(сухая соль), р-р NACL,р-р HCL,р-р сахара. CH3COOH разной концентрации. 1 1 1 3 пробирки с дистиллированной водой, лакмус, метилоранж, фенолфталеин, 3 пробирки с НСL,3пробирки с р-р NaOH. Штатив с пробирками, пробка, стеклянная палочка, штатив с кольцом, фильтровальная бумага, ножницы хим.воронка, стаканы, фарфоровая ступка с пестиком, мелкая терка, песок, универсальная индикаторная бумага, испытуемый раствор, почва, кипяченная вода, плоды, ягоды, р-ры: NaOH,H2SO4 . 52 Контрольно-обобщающий урок по теме «Растворы. Электролитическая диссоциация». Реакции ионного обмена. Ионно-молекулярные уравнения реакции. Л.О - 8 1 Условия протекания реакций ионного обмена. Л.О. - 9 1 Тема № 6. Важнейшие классы неорганических соединений, способы их получения и химические свойства. Оксиды. Способы получения и классификация. Основные оксиды. Л.о.10 12 часов 56 Кислотные и амфотерные оксиды. Л.о.11. 1 57 Основания. Способы получения и свойства. Л.о.12. 1 58 Кислоты. Способы получения и свойства. Л.о.13. 1 59 Кислоты. Взаимодействие с металлами. Ряд активности металлов. Амфотерные гидроксиды. Способы получения и свойства. Л.о.14. Положение химических 1 53 54 55 60 61 1 1 1 1 Таб. «Растворимость кислот, оснований и солей в воде». Р-ры: BaCL2, H2SO4, K2SO4. Р-ры: CaCL2, NaCl, AgNO. Р-ры: FeCL3, NaOH,Na2C63,HCI. Фенолфталеин. Р-ры KNO3,NaCL. СаО,Н2О, индикаторы. НСI,HNO3. MgO, HCi, р-р H2SO4. СО2, Н2О, индикаторы. Р-р Са(ОН)2.ZnO,HCI, NaOH. К2СО3, Са(ОН)2, HCL. P-p NaOH, лакмус, рр Н2SO4. Фарфоровая чашка, штатив с кольцом, спиртовка. HCL,NaOH, CaO, ZnO, AgNO3.P-pы: H2So4,KOH,лакмус, фенолфталеин. HCL, Zn, Cu.Ряд активности металлов. Р-ры: ZnCL2,NaOH,HCL. П.С.Х.Э. 62 63 64 65 66 67 68 элементов в Периодической системе и кислотно-основные свойства их оксидов и гидроксидов. Соли. Способы получения и свойства. Обобщающий урок по теме «Важнейшие классы неорганических соединений. Способы их получения и химические свойства». Обобщающий урок по теме «Важнейшие классы неорганических соединений. Способы их получения и химические свойства». Генетическая связь между классами неорганических веществ. Контрольная работа №4 по теме «Важнейшие классы неорганических соединений. Способы их получения и химические свойства». Важнейшие классы неорганических соединений. Оксиды, основания. Важнейшие классы неорганических соединений. Кислоты, соли. ИТОГО: 68 часов Практические работы: 6 часов Контрольные работы: 4 часов 1 1 1 1 1 1 час 1час СаСL2, NaPO4,CuSO4,Fe, MgCL2,Ca,NaOH, H2SO4

