1 ФОРМУЛИРОВКА ЗАДАНИЯ И ЕГО ОБЪЕМ Контрольная
advertisement
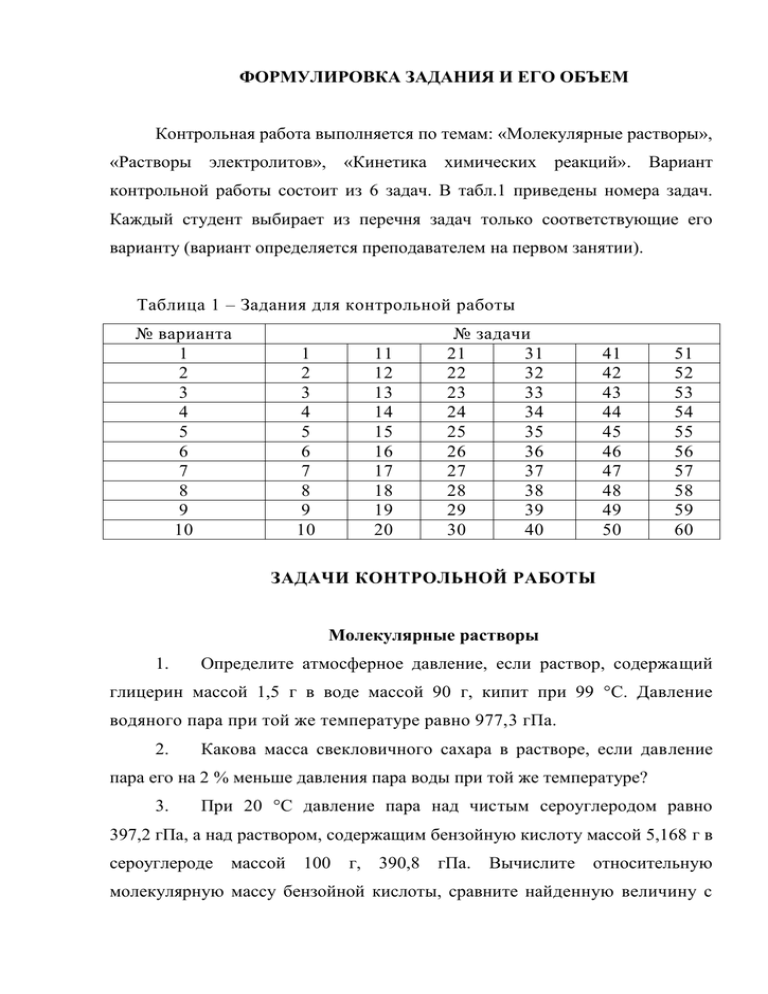
ФОРМУЛИРОВКА ЗАДАНИЯ И ЕГО ОБЪЕМ Контрольная работа выполняется по темам: «Молекулярные растворы», «Растворы электролитов», «Кинетика химических реакций». Вариант контрольной работы состоит из 6 задач. В табл.1 приведены номера задач. Каждый студент выбирает из перечня задач только соответствующие его варианту (вариант определяется преподавателем на первом занятии). Таблица 1 – Задания для контрольной работы № варианта 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 № задачи 21 31 22 32 23 33 24 34 25 35 26 36 27 37 28 38 29 39 30 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 ЗАДАЧИ КОНТРОЛЬНОЙ РАБОТЫ Молекулярные растворы 1. Определите атмосферное давление, если раствор, содержащий глицерин массой 1,5 г в воде массой 90 г, кипит при 99 °С. Давление водяного пара при той же температуре равно 977,3 гПа. 2. Какова масса свекловичного сахара в растворе, если давление пара его на 2 % меньше давления пара воды при той же температуре? 3. При 20 °С давление пара над чистым сероуглеродом равно 397,2 гПа, а над раствором, содержащим бензойную кислоту массой 5,168 г в сероуглероде массой 100 г, 390,8 гПа. Вычислите относительную молекулярную массу бензойной кислоты, сравните найденную величину с 2 табличной и объясните полученный результат. 4. Вычислите давление пара над раствором, содержащим дифениламин (C6H5)2NH массой 0,514 г в бензоле массой 50 г (раствор взят при 20 °С). Давление пара бензола при этой температуре равно 100,2 гПа. 5. Определите массовую долю глюкозы в растворе, если давление пара над ним равно при той же температуре давлению пара раствора, содержащего мочевину массой 1,56 г и воду массой 90 г. 6. Температура замерзания бензола 5,5 °С, а раствора, содержащего в бензоле массой 25,04 г неизвестное вещество массой 0,4678 г, 4,872 °С. Криоскопическая постоянная бензола 5,12 К∙кг/моль. Вычислите относительную молекулярную массу неизвестного вещества. 7. Сколько бензойной кислоты (С7Н6О2) растворено в уксусной кислоте массой 100 г, если температура замерзания последней понизилась на 0,824 °С? Криоскопическая постоянная уксусной кислоты 3,9 К∙кг/моль. 8. Нафталин массой 0,5685 г, растворенный в n-толуидине (C7H9N) массой 25 г, дал понижение точки замерзания раствора на 0,942 °С. Температура плавления чистого n-толуидина равна 43 °С. Определите криоскопическую постоянную и скрытую теплоту плавления n-толуидина. 9. Какова массовая доля водного раствора фруктозы, который замерзает при температуре -0,524°С? Криоскопическая постоянная воды 1,86 К∙кг/моль. 10. Температура плавления нафталина 80,1 °С. Она понижается на 0,832 °С при растворении серы массой 3,122 г в нафталине массой 100 г. Удельная теплота плавления нафталина равна 149,5 Дж/г. Найдите молекулярную формулу серы в нафталинном растворе. 11. Температура замерзания водного раствора глицерина равна -0,5 °С. Давление пара над чистой водой при этой температуре 5,89 гПа. Криоскопическая постоянная воды 1,86. Определите давление пара раствора. 3 12. Вычислите температуру замерзания водного раствора глюкозы, если давление пара его равно 98,5 % давления пара чистой воды при той же температуре. Криоскопическая постоянная воды 1,86 К∙кг/моль. 13. Раствор, содержащий бензальдегид массой 1,612 г в эфире массой 100 г, кипит при температуре 34,806 °С. Температура кипения эфира равна 34,5 °С, а эбуллиоскопическая постоянная его равна 2. Вычислите относительную молекулярную массу бензальдегида и относительную ошибку опыта в процентах по сравнению с найденной в справочнике. 14. массой При растворении камфоры (С10Н15О) массой 0,298 г в бензоле 21,2 г температура кипения повысилась на 0,236 °С. Эбуллиоскопическая постоянная бензола 2,6. Вычислите относительную молекулярную массу камфоры и относительную ошибку опыта в процентах по сравнению с величиной, найденной в справочнике. 15. Определите температуру кипения раствора, содержащего 0,006 моль камфоры в ацетоне массой 20 г. Температура кипения ацетона 56,3 оС, а удельная теплота его испарения при этой температуре 540,0 Дж/г. 16. Раствор бензойной кислоты в эфире (массовой долей 2 %) кипит при такой же температуре, как раствор, содержащий неизвестное вещество массой 0,645 г в эфире массой 22,5 г. Вычислите относительную молекулярную массу неизвестного вещества. Эбуллиоскопическая постоянная эфира равна 2 К∙кг/моль. 17. Из опыта найдено, что при растворении бензила (С14Н10О2) массой 0,374 г в хлороформе массой 33,05 г повышение температуры кипения было равно 0,202 °С. Вычислите эбуллиоскопическую постоянную хлороформа и удельную теплоту его испарения при температуре кипения 61,2 °С. 18. Вычислите осмотическое давление раствора, содержащего в 250 мл воды 0,538 г фруктозы, при 27 °С? 19. Определите осмотическое давление 5 %-го свекловичного сахара при 15 °С. Плотность раствора 1,019 г/см3. раствора 4 20. Какова молярная концентрация раствора мочевины, если при 17 °С он производит давление, равное 86,6 кПа? 21. Сколько граммов глюкозы должно содержаться в растворе объемом 1 л, чтобы осмотическое давление его при 20 °С было равным 113,3 кПа? 22. При 15,5 °С осмотическое давление раствора, содержащего в 1 л воды свекловичный сахар массой 9,968 г, равно 69,8 кПа. Вычислите величину константы R. 23. При 20 °С осмотическое давление раствора, содержащего в 1 л раствора 71,19 г неизвестного вещества, равно 513,2 кПа. Вычислите относительную молекулярную массу неизвестного вещества. 24. При 0 °С осмотическое давление раствора, содержащего в 100 мл его 1 г свекловичного сахара, равно 66,86 кПа. Вычислите относительную молекулярную массу свекловичного сахара и относительную ошибку (в %) по сравнению с величиной, найденной в справочнике. 25. Осмотическое давление раствора, содержащего в 200 мл его 0,276 г мочевины, при 18 °С равно 57,05 кПа. Вычислите относительную молекулярную массу мочевины. Полученную величину сравните с величиной, найденной в справочнике. 26. -0,184 °С. Температура замерзания водного раствора глюкозы равна Вычислите осмотическое давление раствора при 0 °С. Криоскопическая постоянная воды 1,86 К∙кг/моль. 27. При 60 °С давления пара бензола и толуола соответственно равны 523 и 186 гПа. Смесь этих веществ практически идеальна. Вычислите ее состав в молярных долях (%), если общее давление равновесного с ней пара равно 333 гПа. Каков состав пара над этой смесью? 28. Вычислите активности и коэффициенты активности ацетона и хлороформа в растворе, содержащем ацетон молярной долей 65,5 %. При 55,1 °С парциальные давления паров ацетона и хлороформа над раствором 5 равны соответственно 605 и 215 гПа, а давления паров чистых ацетона и хлороформа при той же температуре соответственно 989 и 844 гПа. Сравните активности компонентов с молярными долями. 29. Раствор, содержащий тростниковый сахар массой 48,59 г в воде массой 100 г, замерзает при -3,052 °С. Криоскопическая постоянная воды 1,86. Определите активность сахара в растворе. 30. Водный раствор этилового спирта массовой долей 39 % замерзает при -28,7 °С. Криоскопическая постоянная воды 1,86. Определите активность этилового спирта в растворе. 31. При 25 °С коэффициент распределения хлорида ртути (II) между водой и бензолом равен 11,9. Найдите активность и коэффициент активности соли в водном растворе молярной концентрации 0,1578 моль/л. В бензольном растворе, находящемся в равновесии с водным, молярная концентрация HgCl2 равна 0,0122 моль/л, этот раствор можно считать идеальным. Растворы электролитов 32. калия Определите осмотическое давление при 25 °С раствора хлорида молярной концентрации 0,1 моль/л. Кажущаяся степень диссоциации КС1 в этом растворе 83 %. 33. Вычислите осмотическое давление при 17 °С раствора хлорида магния массовой долей 3,7 %. Плотность раствора равна 1,03 г/см3, а кажущаяся степень диссоциации соли 70,5 %. 34. При 18 °С осмотическое давление раствора хлорида натрия молярной концентрации 0,5 моль/л равно 2,1∙106 Па. Вычислите кажущуюся степень диссоциации NaCl в этом растворе. 35. Найдите молярную концентрацию раствора мочевины, который изотоничен с раствором хлорида бария молярной концентрации 0,01 моль/л 6 при 20 °С. Кажущаяся степень диссоциации ВаС1 2 равна 87 %. 36. При 17 °С осмотическое давление раствора сульфата калия молярной концентрации эквивалента 0,1 моль/л равно 300,8 кПа. Вычислите изотонический и осмотический коэффициенты. 37. Определите молярную концентрацию ионов А13+ и С1- в растворе хлорида алюминия молярной концентрации эквивалента 0,1 моль/л, если кажущаяся степень диссоциации соли равна 65 %. 38. Вычислите молярную концентрацию эквивалента сульфата калия, если кажущаяся степень диссоциации соли в этом растворе 63 %, а молярная концентрация иона К+ равна 0,315 моль/л. 39. Сколько безводного ацетата натрия нужно добавить к 0,5 л раствора с(СН3СООН) = 1 моль/л, чтобы рН раствора стал равным 4? Константа диссоциации уксусной кислоты К = 1,8∙10-5, (соли) = 1. 40. Определите рН смеси аммиака и хлорида аммония, если она приготовлена из растворов молярной концентрации, равной 0,1 моль/л этих веществ в отношении 1 : 9. КNH4ОН = 1,8∙10-5. Диссоциацию соли считать полной. 41. Найдите рН фосфатной буферной смеси, приготовленной из раствора NaH2PO4 объемом 50 мл молярной концентрации эквивалента 0,2 моль/л и раствора Na2HPO4 объемом 20 мл молярной концентрации эквивалента 0,4 моль/л. КН2РО4 = 1∙10-7. Степень диссоциации Na2HPO4 на ионы Na+ и НРО42- считать равной 1. 42. К раствору гидроксида аммония объемом 25 мл молярной концентрации 0,5 моль/л добавлен раствор хлороводородной кислоты объемом 25 мл молярной концентрации 0,1 моль/л. Определите рН полученного раствора, если КNH4OH = 1,8∙10-5. 43. К раствору уксусной кислоты объемом 100 мл молярной концентрации 0,3 моль/л, добавлен раствор едкого натра объемом 30 мл молярной концентрации, равной 0,1 моль/л. Найдите рН полученного 7 раствора, если КСН3ООН = 1,8∙10-5. 44. Чтобы изменить рН на 1, к ацетатной буферной смеси объемом 10 мл потребовалось добавить раствор щелочи объемом 0,52 мл молярной концентрации 1 моль/л. Найти буферную емкость этой смеси. 45. Определите коэффициент активности и активности иона Na+ в растворе, содержащем 0,01 моль NaCl, 0,01 моль CuС12 и 0,002 моль ZnSO4 в 1 кг воды. 46. Воспользовавшись уравнением Дебая и Гюккеля, вычислите средний коэффициент активности ионов и их активность в растворе b(CuCl 2 /H2 O) = 0,001 моль/кг. А = 0,5117. 47. Применяя уравнение Дебая и Гюккеля, вычислите средний коэффициент активности K2SO4 в растворе, содержащем 0,001 моль K2SO4 и 0,002 моль MgCl2 в 1кг воды. А = 0,5117. 48. Растворимость РbI2 в воде равна 1,4∙10-3 моль/л. Вычислите произведение растворимости этой соли с учетом коэффициентов активности. 49. Растворимость Са(ОН)2 в воде равна 0,165 г в 100 г воды. Вычислите произведение растворимости Са(ОН)2 с учетом коэффициента активности. 50. При 18 С эквивалентная электропроводность раствора Mg(NO3)2 равна 62,57 Ом-1∙см2∙г-экв-1. Найти степень диссоциации этого раствора, если эквивалентная электропроводность при бесконечном разбавлении (λ∞) равна 109,8 Ом-1∙см2∙г-экв-1. 51. Удельная электропроводность 1,225 ∙ 10-3 Ом-1∙см-1. Определить электропроводности раствора. 0,01н. раствора KCl равна величину эквивалентной 52. Определить нормальную концентрацию раствора KNO3, величины удельной и эквивалентной электропроводностей которого соответственно равны 0,0805 Ом-1∙см-1 и 80,5 Ом-1∙см2∙г-экв-1. 8 Кинетика химических реакций 53. Сколько времени потребуется для омыления гидроксидом натрия 99 % уксуснометилового эфира, если начальные молярные концентрации растворов эфира 0,015, а гидроксида натрия 0,03 моль/л? Константа скорости реакции равна 2,5 л∙моль-1∙мин-1. 54. Во сколько раз увеличится скорость реакции при повышении температуры на 100 °С, если температурный коэффициент скорости реакции равен 2? 55. повышении Во сколько раз увеличится скорость химической реакции при температуры от 200 до 500 °С, если температурный коэффициент скорости реакции равен 2? 56. При 150 °С химическая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитайте, через сколько минут закончилась бы эта реакция при 200 °С и при 80 °С. 57. Скорость некоторой реакции при охлаждении с 60 до 30 °С уменьшилась в 8 раз. Чему равен температурный коэффициент этой реакции? 58. Скорость реакции при нагревании на 20 °С возросла в 9 раз. Определите температурный коэффициент скорости реакции. 59. Температурный коэффициент скорости реакции равен 2,5. При какой температуре следует проводить реакцию, если нужно скорость реакции, проводимой при 50 °С, уменьшить в 10 раз? 60. Реакция между А и В выражается уравнением А + 2В = С. Начальная концентрация с(А) равна 0,3моль/л, а с(В) − 0,5моль/л. Константа скорости реакции равна 0,4 л 2∙моль-2∙мин-1. Чему будет равна скорость реакции в момент ее начала и по истечении некоторого времени, когда с (А) уменьшится на 0,1 моль? 9 СТРУКТУРА КОНТРОЛЬНОЙ РАБОТЫ, ОБЩИЕ ТРЕБОВАНИЯ К ЕЕ НАПИСАНИЮ Работа должна быть выполнена в отдельной тетради – аккуратно, четко; выводы должны быть обоснованными; все расчеты приведены полностью без сокращений. В каждой задаче должны быть приведены исходные данные, ответы представлены в системе СИ. Если в работе были допущены серьезные ошибки, то работа над ошибками должна быть проведена в той же тетради. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Основная: 1. Физическая химия. В 2 кн. Кн. 1. Строение вещества. Термодинамика: учеб. для вузов / К. С. Краснов [и др.]; под ред. К. С. Краснова. – 3-е изд., испр. – М. : Высш. шк., 2001. – 512 с. 2. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ : учеб. для вузов / К. С. Краснов [и др.]; под ред. К. С. Краснова.– 3-е изд., испр. – М. : Высш. шк., 2001. – 319 с. 3. Задачи по физической химии : учебное пособие / В. В. Еремин [и др.].– М. : Экзамен, 2003.– 320с. 4. Краткий справочник физико-химических величин. Изд. 9-е / под ред. А. А. Равделя, А. М. Пономаревой.− СПб. : Специальная литература, 1998. 5. Артеменко, А. И. Справочное руководство по химии : справ. пособие / А. И. Артеменко, В. И. Тикунова, В. А. Малеванный.− 2-е изд., перераб. и доп.− М. : Высш. шк., 2003.− 367с. 10 Дополнительная: 6. Стромберг, А. Г. Физическая химия : учеб. для хим. спец. вузов / А. Г. Стромберг, Д. П. Семченко; под ред. А. Г. Стромберга.− 3-е изд., испр. и доп.− М. : Высш. шк., 1999.− 527 с. 7. Бокштейн, Б. С. Краткий курс физической химии : учеб. пособие. Издание 2-е, исправленное / Б. С. Бокштейн, М. И. Менделев.– М. : ЧеРо, 2001.− 232 с. 8. Киселева, Е. В. Сборник примеров и задач по физической химии / Г. С. Каретников, И. В. Кудряшов.− М. : Высшая школа, 1976.− 350 с.

