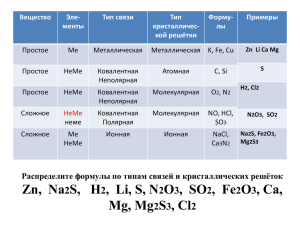
Document 5094944
advertisement

Проверь себя Схемаконспект Положение неметаллов в ПСХЭ Д.И. Менделеева Нахождение в природе Характеристика элемента неметалла Строение атомов неметаллов Окислительно-восстановительные возможности атомов неметаллов Изменение свойств атомов неметаллов в периоде и группе Характеристика простых веществ неметаллов Строение неметаллов Физические свойства неметаллов Химические свойства неметаллов Водородные соединения Соединения неметаллов Оксиды и гидроксиды НеМе Генетический ряд главная Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов Интерактив Тест «Неметаллы» (базовый уровень) Кроссворд Тест «Общая характеристика НеМе» Задачи (базовый и углубленный уровень) Рабочая тетрадь (для углубленного изучения химии) Тренажер «Оксиды» Тренажер «Степени окисления НеМе» Положение в ПСХЭ Д.И. Менделеева главная Гр у п п ы э л е м е н т о в I 1 1 (H) 2 2 3 3 II III IV V VI VII Н В 5 10,811 Бор С 6 12,0112 Углерод Водород 7 8 N 14,0067 O 15,9994 F Азот 14 Р Si 28,086 Кремний 1 1,00797 Кислород 15 S 30,9738 Фосфор 9 18,9984 Фтор 16 Cl 32,064 Сера VIII 2 He 4,0026 Гелий Ne 10 20,163 Неон 17 Ar 18 39,948 35,453 Хлор Аргон 4 4 5 6 5 7 8 6 9 В ПСХЭ Д.И. Менделеева граница, отделяющая металлы от неметаллов, проходит по следующим неметаллам – элементам главных подгрупп: B; Si; As; Te; At. Неметаллы располагаются правее и выше этой границы. 33 34 35 36 Kr 83,80 As 74,9216 Se 78,96 Br 79,904 Мышьяк Селен Бром Криптон 52 53 Xe 131,30 54 Te 127,60 I 126,904 Теллур Иод Ксенон 86 At 85 210 Rn [222] Астат Радон 7 10 Высшие оксиды ЛВС R2O RO R2O 3 RO2 R2O 5 RO3 R2O 7 RH4 RH3 H 2R HR RO4 Неметаллы в природе главная Гр у п п ы э л е м е н т о в I 1 1 (H) 2 2 3 3 4 4 II III IV V В 5 10,811 Бор 98,5% от массы растений С 6 12,0112 Углерод Высшие оксиды ЛВС Азот Кислород 15 S 30,9738 Фосфор O2; N2; CO2; 7 7 10 7 8 N 14,0067 O 15,9994 F Мышьяк 5 9 Водород 14 Р Si 28,086 Кремний 1 1,00797 9 18,9984 Фтор 16 Cl 32,064 Сера 17 35,453 Хлор 33 34 35 As 74,9216 Se 78,96 Br 79,904 6 6 VII Н 5 8 VI Селен 52 53 Te 127,60 I 126,904 Теллур Н2О 97,6% от массы человека R2O RO R2O 3 Бром 49% кислород, 27% кремний от массы земной коры Иод At 85 210 Астат RO2 R2O 5 RO3 R2O 7 RH4 RH3 H 2R HR VIII Химических элементовнеметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть НеМе – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами НеМе. RO4 Cтроение атомов неметаллов главная Гр у п п ы э л е м е н т о в 1 1S1 1 Н 1,00797 1 Водород 2 2 3 II III IV 4 5 В 5 10,811 Бор 5 7 8 С 6 12,0112 Азот Кислород Кремний Фосфор Сера 14 Р Si 28,086 22P1 ) ); 1S22S +92 3) ); 1S22S22P5 2 7 15 30,9738 S 7 10 Высшие оксиды Мышьяк 25 Селен ЛВС Фтор 17 35,453 Хлор Бром Вывод: +? НеМе …) от 4 до 8e Исключение: Н (1ē); В (3ē) 52 I 53 Te 127,60 126,904 Теллур Иод At 85 210 +6 +8Н +1 O C +7 N RO 9 34 35 33 Se 78,96 Br 79,904 As 74,9216 +5 В+17 22S 22S 212P 22P 63S 2 23P5 4 ); 1S +1 2 2 3 ) ) ); 1S 1S +6 +8 ) ); 1S 2S 2P +7 2 28 6 47 1 R2O VIII 18,9984 16 32,064 Cl 6 9 VII 7 8 N 14,0067 O 15,9994 F Углерод +5 6 VI 2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5 3 4 V Астат R2O 3 RO2 RH4 R2O 5 RO3 R2O 7 RH3 H 2R HR RO4 Окислительно-восстановительные возможности атомов неметаллов НеМе0 + (8 – n) e окислитель главная НеМе - (8 – n) (восстановление) Окислительные свойства атомов, т.е. способность принимать ē, характерны только для НеМе и изменяются в ПСХЭ периодически: в периодах возрастают, в группах убывают главная Окислительно-восстановительные возможности атомов неметаллов НеМе0 – ne НеМе +n (окисление) Восстановитель; исключение F Таким образом НеМе в большей степени являются окислителями, хотя могут проявлять и В чем причины такого восстановительные изменения окислительносвойства, а значит им присущи как отрицательные, восстановительных свойств так и положительные атомов НеМе? степени окисления. Восстановительные свойства атомов неметаллов, т.е. способность отдавать ē, изменяются в ПСХЭ периодически: в периодах убывают, группах возрастают. главная Причины изменения окислительновосстановительных свойств атомов НеМе: радиус атомов (нм) 0,088 0,077 0,117 0,070 0,110 0,066 0,104 0,064 0,099 Радиус атомов в периодах периодически уменьшается к концу периода. Это объясняется увеличением заряда ядра в атоме и большим притяжением е к ядру главная Причины изменения окислительновосстановительных свойств атомов НеМе: радиус атомов (нм) Радиус атомов в группах периодически увеличивается сверху вниз. Причина увеличение числа энергетических уровней в атоме. 0,066 0,064 0,104 0,099 0,117 0,114 0,137 0,133 главная Причины изменения окислительновосстановительных свойств атомов НеМе: заряд ядра +9 +5 +6 +7 +8 +17 +9 +35 Заряды ядер атомов в периодах и главных подгруппах увеличиваются +53 +85 главная Причины изменения окислительновосстановительных свойств атомов НеМе: количество ē на внешнем слое +5 )) 23 +6 )) 24 +7 )) 25 +8 )) 26 +9 +9 )) 27 )) 27 +17 ))) 287 +35 )))) 28 187 +53 Количество ē на внешнем уровне в группах не изменяется, а в периодах периодически возрастает от 1 (у Н) до 7 ) ) ) ) ) 2 8 18 18 7 +85 ) ) ) ) ) ) 2 8 18 32 18 7 Итог: В периоде Изменение свойств атомов неметаллов главная В группе Окислительных Восстановительных Причины: Заряд ядра Ra (НеМе) Электроны на внешнем слое Const Строение НеМе (искл. Инертные газы) Ковалентная неполярная связь H : H ¨ ¨ : O ¨ O: ¨ ¨ ¨ Способность атомов Кристаллическая решётка одного химического [С]n,[Si]n, [S] атомная n элемента образовывать несколько простых веществ кремний углерод (графит) Аллотропия Кристаллическая решётка (Н2, О2, N2, F2) молекулярная N ¨¨¨ N примеры йод бром Аллотропия озон главная красный кислород [О]n м.кр.р. графит белый желтый [Р]n а.кр.р. [Р]4 м.кр.р. [Р]n а.кр.р. алмаз фуллерен [С]n а.кр.р. Физические свойства неметаллов главная тв. Ц Атомная кристаллическая решётка Н2О Возгонка (сублимация)переход> вещества Tºпл Tºкип из твёрдого состояния сразу в газообразное, минуя жидкое летучие Ц Молекулярная кристаллическая решётка Йод возгонка Br2 плохо Н2О < Tºпл Tºкип Очень низкая электро- и теплопроводимость ? главная Химические свойства неметаллов Cl20 +2Na0→ 2NaCl Ме 0 +Na0→ Cl22PCl 5Cl20 +2P0 → 5 НеМе < электроотр. НеМе0 ок-ль + 0 +P0 → 0 Cl Cl2 +2NaI→2NaCl+I 2 2 соль< акт. НеМе ? Cl20 + CO→ClCOCl 0 +NaI→ 2 ? Cl20 +CO→ ? 2фосген оксид НеМе (вос-ль) ? C + CuO → Cu + CO НеМе0 вос-ль Ме) + H SO + NO + H O S + HNO3 →оксид Cu(NO 3 2 2 4 2 2 C +CuO→ Расставьте коэффициенты методом электронного баланса + кислота (ок-ль) C+HNO3→ подробнее ? ? Химические свойства неметаллов главная Неметаллы могут: окислять металлы (вещества более или менее склонные отдавать электроны): 3F2 + 2Al = 2AlF3 S + Fe = FeS (tº) O2 + 2Mg = 2MgO (с предв. tº) 2C + Ca = CaC2 (tº) окислять другие неметаллы (менее склонные принимать электроны): 2F2 + C = CF4 (tº) S + H2 = H2S (tº) O2 + S = SO2 (с предв. tº) окислять многие сложные вещества: 4F2 + CH4 = CF4 + 4HF Cl2 + 2HBr = Br2 + 2HCl 3O2 + 4NH3 = 2N2 + 6H2O (tº) вытеснять менее активные НеМе из солей: Hal2 + F2 = 2НаlF ,где Наl = Сl, Вr, I Cl2 + 2NaBr = Br2 + 2NaCl Химические свойства неметаллов главная Неметаллы способны: (особенно графит и водород) проявлять восстановительные св-ва: 2С + MnO2 = Mn + 2CO 4H2 + Fe3O4 = 3Fe + 4H2O См. окислять другие неметаллы (менее Хлор в левой части уравнения имеетсклонные степень принимать окисления электроны): 0. В результате реакции у одних атомов как восстановители реагировать с болееокисления электротрицательными хлора степень стала -1 (в НСl), у других +1 неметаллами: (в?хлорноватистой кислоте НОСl). Такая реакция — Si + 2F2 = SiF4 C пример + O2 = COреакции C + 2S = CS2 2 самоокислениясамовосстановления, или диспропорционирования вступать в реакции самоокисления-самовосстановления ? Сl2 + Н2О = НСl + НСlO - 25 кДж. реакции самоокисления-самовосстановления со щелочами Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде) ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагрев.) главная Итог: Строение Ков.пол.связь Кристал.решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. Ц не раств. в воде > Tºпл Tºкип Г Ж плохо раств. в воде Ц < Tºпл Tºкип Химические свойства неметаллов Окислительные НеМе ок-ль Ме НеМе < электроотр. соль< акт. НеМе оксид НеМе (вос-ль) Восстановительные оксид Ме НеМе вос-ль кислота (ок-ль) самоокислениясамовосстановления I 1 2 3 4 1 Н II III IV 6 1 He 4,0032 Водород Гелий B 2 5 10,811 Бор C 6 12,011 Углерод Si 3 14,00 Азот 14 28,086 Кремний 7 N Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S 32,064 Сера 9 F 18,998 Фтор Cl Хлор ЛВС 10 Ne20,179 Неон 17 35,453 18 Ar 39,948 Аргон 4 As 5 33 74,922 R-4Н4+1 6 8 R+1Н-1 Селен R-3Н3+1 78,96 Br Бром 35 79,904 Н2+1R-2 Te R+3Н3-1 7 Se Теллур 52 127,60 36 83,80 Криптон 126,906 Xe131,30 54 85 Rn 86 53 I Иод Ксенон R+2Н2-1 At 9 1 Нелетучие водородные 0 Летучие водородные соединения соединения RH Kr Н+1R-1 Астат 7 VIII 1.008 Мышьяк 5 главная Группы элементов V VI VII RH2 RH3 RH4 RH3 H2 R HR (210) (222) Радон I 1 2 3 4 5 6 7 ВО ЛВС 1 Н II III IV 1 NН3- основные свойства 1.008 Водород B 2 5 10,811 Бор C 6 12,011 Углерод Si 3 14 28,086 Кремний 4 5 6 7 8 9 1 0 главная Группы элементов V VI VII 7 N 14,00 Азот Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S Сера 32,064 VIII НF- кислотные свойства Гелий F 9 10 Ne20,179 18,998 Фтор Cl Хлор Неон 17 18 Ar 39,948 35,453 Аргон В периодах слева РН - основные свойства НCl-сильная кислота 3 направо с 33 Se 35 As 74,922 Br 79,904 возрастанием 78,96 Мышьяк Селен Бром заряда ядра атомов и увеличением отрицательной 52 I 53 Te 127,60 126,906 степени окисления Теллур Иод усиливаются кислотные свойства 85 водородных At (210) Астат соединений НеМе в водных растворах R2 O RO R2O3 RO2 RH4 R2O5 RH3 RO3 H2 R He 4,0032 R2O7 HR RO4 Kr 36 83,80 Криптон Xe131,30 54 Ксенон Rn 86 (222) Радон ] Или сокращенно Н2О-2 + НF-1 Н3О+ + F-1 : : : [ : Н :F: главная Н -1 Н :O: Н + :F: : Н :О: Н + -1 : : : -2 + I 1 2 3 4 5 6 7 ВО ЛВС 1 Н II III IV 1 NН3- основные свойства 1.008 Водород B 2 5 10,811 Бор C 6 12,011 Углерод Si 3 14 28,086 Кремний 4 5 6 7 8 9 7 N 14,00 Азот Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S Сера 32,064 Мышьяк Селен Te Теллур 52 He 4,0032 Гелий F 9 10 Ne20,179 18,998 Фтор Cl Хлор Бром 127,60 VIII НF- слабая кислота РН3- слабое основание В группах сверху 33 Se As 74,922 Br 78,96 вниз с увеличением атомных радиусов соответствующих анионов кислотные свойства усиливаются, а основные ослабевают главная Группы элементов V VI VII Неон 17 18 Ar 39,948 35,453 Аргон НCl-сильная кислота Kr 35 79,904 Иод At 126,906 Xe131,30 54 85 Rn 86 Ксенон (210) (222) Радон Астат 1 0 R2 O RO R2O3 RO2 RH4 R2O5 RH3 RO3 H2 R 83,80 Криптон 53 I 36 R2O7 HR RO4 - ][ ] : : : Н2О-2 + Н3N-3 [ : Н:О : Н + Н:N:Н Или сокращенно Н Н Н:N: Н + :О:Н Н : : : : -2 -3 + главная NН4+ + OH- ? I 1 2 3 4 5 6 7 ВО ЛВС 1 Н II III IV 1 He 4,0032 Водород Гелий B 5 10,811 Бор C 6 12,011 Углерод Si 3 14 28,086 Кремний 5 6 VIII 1.008 2 4 главная Группы элементов V VI VII Водородные соединения НеМе, обладающие в водных растворах кислотными свойствами, реагируют со щелочами 7 N 14,00 Азот Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S 32,064 Сера F 9 Фтор Cl Хлор Неон 17 As 33 74,922 Мышьяк Se Селен Te Теллур 78,96 52 127,60 Br HCl + NaOH = NaCl + H2O Бром 35 53 I Иод 126,906 At 85 (210) Астат 1 0 RO R2O3 RO2 RH4 Аргон 79,904 8 R2 O 18 Ar 39,948 35,453 NH3 + HCl = NH4Cl 7 9 10 Ne20,179 18,998 R2O5 RH3 RO3 H2 R R2O7 HR Kr 36 83,80 Криптон Водородные соединения НеМе, обладающие в водных растворах основными свойствами, реагируют с кислотами RO4 Xe131,30 54 Ксенон Rn 86 (222) Радон I 1 2 3 4 5 6 7 ВО ЛВС 1 Н II III IV 1 He 4,0032 Водород Гелий B 5 10,811 Бор C 6 12,011 Углерод Si 3 14 28,086 Кремний 5 6 7 8 9 VIII 1.008 2 4 главная Группы элементов V VI VII С возрастанием порядкового номера элемента в подгруппе радиус атома увеличивается. Прочность связи Э-Н в этом же направлении уменьшается. 7 N 14,00 Азот Р 15,998 Кислород 15 30,9738 Фосфор As 8 O 33 74,922 Мышьяк 16 S Сера Se Селен Te Теллур 32,064 78,96 52 127,60 F 9 18,998 Фтор Cl Хлор Br Бром 17 HCl 35 79,904 Иод At 126,906 85 (210) Астат 1 0 R2 O RO R2O3 RO2 RH4 R2O5 RH3 RO3 H2 R R2O7 HR 10 Ne20,179 Неон 18 Ar 39,948 35,453 53 I HF HBr HI Способность к распаду на ионы возрастет, т.е. сила кислот увеличивается RO4 Аргон Kr 36 83,80 Криптон Xe131,30 54 Ксенон Rn 86 (222) Радон I 1 2 3 4 5 6 1 Н II III IV 1 Гелий B 5 10,811 C 6 12,011 Углерод Si 3 14 28,086 Кремний 8 7 N 14,00 Азот Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S Сера 32,064 F 9 18,998 Фтор Cl Хлор Окислительная активность водородных соединений НеМе в группах сверху вниз сильно увеличивается. As 33 74,922 Мышьяк Se Селен Te Теллур 78,96 52 127,60 Br Бром Иод At 9 ВО 35 79,904 126,906 85 (210) ЛВС 1 0 R2 O RO R2O3 RO2 RH4 R2O5 RH3 RO3 H2 R 18 Ar 39,948 HCl Астат 7 Неон 17 53 I 10 Ne20,179 HF 35,453 Окислить можно 4 7 He 4,0032 Водород Бор 6 VIII Окислить F хим. путем нельзя 1.008 2 5 главная Группы элементов V VI VII R2O7 HR HBr Аргон Kr 36 83,80 Криптон Xe131,30 54 HI Ксенон В группах сверху вниз резко возрастают атомные радиусы, отдача ē облегчается RO4 Rn 86 (222) Радон I 1 2 3 4 1 Н II III IV 1 He 4,0032 Водород Гелий B 5 10,811 Бор C Углерод Si 3 6 12,011 14 28,086 Кремний 4 SiO2 14,00 Азот Р 6 7 ВО ЛВС H2SiO3 15 30,9738 33 74,922 9 15,998 16 S 32,064 Сера Se Селен 52 Te В периодах слева направо свойства высших оксидов постепенно изменяются от основных к кислотным 1 0 R2 O RO 78,96 H3PO4 7 8 8 O Кислород Фосфор P2O5 As 5 7 N Мышьяк 5 VIII 1.008 2 6 главная Группы элементов V VI VII R2O3 RO2 RH4 R2O5 RH3 Теллур 127,60 F 9 10 Ne20,179 18,998 Фтор Cl Хлор Неон 17 18 Ar 39,948 35,453 Аргон SO3 35 Br 79,904 Cl2O7 H2SO4 HClO4 Kr Бром Иод Xe131,30 54 126,906 Ксенон В группах сверху вниз кислотные свойства 85 At (210) высших оксидов Астат постепенно ослабевают RO3 H2 R R2O7 HR 83,80 Криптон 53 I 36 RO4 Rn 86 (222) Радон I 1 2 3 4 1 Н II III IV 6 VIII 1 1.008 Водород B 2 5 10,811 Бор C Углерод Si 3 6 12,011 14 28,086 Кремний 7 N 14,00 Азот Р 8 O 15,998 Кислород 15 30,9738 Фосфор 16 S Сера 32,064 F 9 18,998 Фтор Cl Хлор 17 35,453 4 As 5 33 74,922 Мышьяк 5 главная Группы элементов V VI VII Селен 78,96 Br Бром 35 79,904 R2+7O7-2 6 7 8 Se R2+5O5-2 R+6O3-2 Te Теллур 52 127,60 53 I Иод 126,906 R+4O2-2 At 9 85 (210) Астат 7 ВО ЛВС Возрастание кислотных свойств высших оксидов соответствую щих элементов в периодах слева направо объясняется постепенным возрастанием положительно го заряда ионов этих элементов. 1 0 R2 O RO R2O3 RO2 RH4 R2O5 RH3 RO3 H2 R R2O7 HR RO4 He 4,0032 Гелий 10 Ne20,179 Неон 18 Ar 39,948 Аргон Kr 36 83,80 Криптон Xe131,30 54 Ксенон Rn 86 (222) Радон I 1 2 3 4 1 2 3 Н II III 6 7 ВО ЛВС IV HNO2 SO2 B B2O3 5 10,811 Бор H3BO3 Si 7 N 14,00 Азот 14 28,086 Кремний H2SO3 ClVIII 2O7 Гелий 9 HClO4 HClO3 Неон Р 8 O F 15,998 Кислород 15 30,9738 Фосфор Фтор 16 S Сера H3PO4 HPO3 As2O5 H3AsO4 As 33 74,922 Мышьяк TeO3 As2O3 H6TeO6 HAsO2 Cl 32,064 Хлор Se Селен 78,96 Br 17 35,453 SeO3 H2SeO4 R2O3 RO2 RH4 R2O5 RH3 35 79,904 10 Ne20,179 18 Ar 39,948 Аргон HBrO4 SeO2 He 4,0032 HBrO3 Kr 36 83,80 Криптон H2SeO3 Te Теллур 52 127,60 H2TeO3 1 0 RO Бром 53 I Иод TeO2 At 9 R2 O 18,998 H2SiO3 P2O5 6 8 6 12,011 Углерод SiO2 CO2 7 C главная H2SO4 Водород H2CO3 5 S2O3 N2Oэлементов Группы 3 V VI VII HNO3 1 1.008 4 5 N2O5 RO3 H2 R I2O7 126,906 85 I2O5 R2O7 HR Ксенон H5IO6 Rn 86 (210) Астат Xe131,30 54 (222) HIO3 Радон RO4 главная Неметалл кислотный оксид растворимая кислота cоль ? ? ? ? главная Неметалл кислотный оксид соль кислота кислотный оксид неметалл ? ? ? Si SiO2 Na2SiO3 ? ? ? H SiO SiO2 Si 2 3