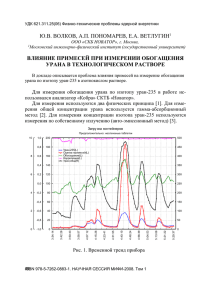
«Физические и химические методы анализа ядерных материалов» НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
реклама

НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ «Физические и химические методы анализа ядерных материалов» ЛЕКЦИЯ 5 ЛЮМИНЕСЦЕНТНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ УРАНА, ПЛУТОНИЯ, ТОРИЯ. Лектор: профессор каф. ХТРЭ ФТИ Жерин И.И. Томск 2015 г. Люминесценция – это свечение атомов, молекул, ионов и других частиц, возникающее в рез-те электронного перехода в этих частицах при их возвращении из возб. состояния в осн. то есть это вторичное излучение (реизлучение) Часто Л. называют свечением холодных тел. Люм-щие в-ва могут находиться в любом Виды люминесценции Способ возбуждения Вид люминесценции Электромагнитное излучение (УФ, ВО) ФотоЛюм. Энергия химических реакций ХемиЛюм. Рентгеновское излучение Поток электронов (катодные лучи) Ультразвук Рентгенолюминесценция Механическое воздействие Триболюминесценция Радиоактивное излучение Радиолюминесценция Катодолюминесценция Сонолюминесценция Сущность явления Л. Схема распределения световых потоков в Люм. анализе Простейшая энергетическая модель люминесценции г б а в г д Ев – возбуждённое энергетич. состояние 2 1 0 подуровни осн. уровня Ен – осн. (нормальное) энергетич. сост. Ев0 Ев1 Ев2 Строгая модель – диаграмма Яблонского: Молекула, поглощая квант света, переходит из основного состояния S0 в возбужденное электронное состояние S1 : Синглетное осотояние S2 Триплетное состояние T1 Фосфоресценция Интерконбинационная конверсия Флуоресценция Поглощение Синглетное состояние S1 Основное состояние (S0) – S0 – основное состояние и его колебательные подуровни; – S1 – возбужденное состояние и его колебательные подуровни; – T1 – метастабильное состояние и его колебательные подуровни; – S0 и S1 – синглетное состояние (в котором суммарный спин электронов равен нулю), этот переход происходит с высокой вероятностью; – T1 – триплетное состояние (в котором суммарный спин электронов равен 1, переход с Т1 на S0 уровень происходит с низкой вероятностью и с низкой скоростью. синглетное основное состояние синглетное триплетное возбуждённое возбуждённое состояние состояние Ориентация электронных спинов в синглетном и триплетном состояниях Возвращение из нижнего колебательного состояния S1 в невозбужденное состояние S0 может произойти тремя путями: 1) потеря энергии волнистая стрелка); в виде теплоты (длинная 2) возвращение на любой колебательный подуровень основного состояния с испусканием энергии в виде кванта света без изменения спина электрона (флуоресценция); 3) переход молекулы из возбужденного состояния S1 в метастабильное состояние Т1, а затем в основное состояние S0 (фосфоресценция). закон Стокса-Ломмеля спектр флуоресценции в целом и его максимум сдвинуты по сравнению со спектром поглощения и его максимумом в сторону длинных волн. Спектр люминесценции – это это зависимость интенсивности люминесценции от длины волны I = f(λ) или I = f(v) (в общем случае это цвет свечения) «смещение Стокса» Смещение спектра люминесценции относительно спектра поглощенного света Характеристики молекулярной люминесценции основные свойства флюоресценции Спектр возбуждения (поглощения) и спектр Фл.; II. Выход Фл.; I. III. Длительность Фл.; IV. Поляризация Фл-го излучения Испускание квантов Л. всегда происходит с низшего электронно-возбужденного уровня молекулы. Поэтому спектр Л. будет всегда одним и тем же независимо от того, на какой энергетический уровень попал электрон в результате поглощения фотона. правило Каши: форма спектра люминесценции не зависит от длины волны возбуждающего света Спектр люминесценции не зависит от длины волны возбуждающего света; он является важнейшей характеристикой индивидуальности люминесцирующего вещества, то есть по цвету свечения можно судить о присутствии элемета, способного к люминесценции – качественный анализ Спектр люминесценции как характеристика вещества Качественное определение не связано с измерением величины интенсивности излучения, а связано лишь с наличием Л. Для соединений урана Фл. свойственна только тем, в которых он находится в 6-валентной форме: UO3·nH2O, UF6, Na2U2O7 и др. Особенно сильно люминесцируют соединения урана, в которых он находится в форме иона уранила, например, UO2(NO3)2, UO2SO4 и др. при этом Л. возбуждается УФ-излучением. II. Выход люминесценции Различают : энергетический выход Л. Вэн., равный отношению излучаемой Nфл энергии к поглощенной: Bкв N погл квантовый выход Вкв., равный отношению числа излучаемых квантов к числу поглощенных квантов Е фл светового потока: Bэн Епогл (55) . видно, что: Вэн h фл Nфл h погл N погл фл погл Вкв Вкв ν погл фл Из з-на Стокса-Ломмеля: Поэтому Вкв > Вэн, фл погл 1 погл фл Вывод аналитич. уравнения з-сти аналитич. сигнала (Iфл) от конц. (с) 1) I фл пропорциональна числу квантов Nфл : I фл К N фл К N погл Вкв При этом N погл К I 0 I 2) С учётом з-на Бугера – Ламберта – Бера cl I I0 e можно записать: Iфл К I 0 Bкв 1 е c l Выражение (е–εcl) разложим в ряд: e c l c l 2 1 cl 2! c l 3 3! и т.д. 3) Ограничиваясь первыми двумя членами ряда: I фл К I 0 Bкв c l 4)При малых конц. в-ва Вкв = const и при стандартных условиях анализа (I0, ε, l = const) получаем уравнение количественного люминесцентного анализа: Iфл=kc Влияние концентрацииции люминесцирующего вещества Для количественных определений пригодна область линейной зависимости. Для большинства в-в область линейной зависимости лежит в пределах (10 –7 – 10 –4) мольл –1. Т.о., люминесцентный метод применим для определения незначительных количеств веществ в растворах Причины гашения: 1.Сближение молекул и → измен-е их энергетич. уровней и → ув-е количества переходов без излуч-я. 2.При сближении молекул они вз-ют между собой и с молекулами растворителя с образованием НЕлюм. ассоциатов. и т.д. Упрощенная схема спектрофлуориметра МЕТОДЫ КОЛИЧ. ЛЮМ. АНАЛИЗА: 1) Л. по свечению водных растворов; 2) Л. кристаллофосфόров (твёрдых растворов); 3) Л. реакции с образованием тройных компл. с-ний; 4) Л. твёрдых тел. 1) Л. по свечению UO22+ в водн. р-рах Различают: 1. а) Л. непосредственно водных р-ров солей и 1. б) Л. р-ров комплексных соединений. 1. а) Л. по свечению водн. р-ров солей; Впервые в 1947 г. разработана методика Л. опр-я UO22+ в сернокислых р-рах. ** Возбуждение: УФ-свет, λ = 253 нм. ** Максимум Фл.: λ = 550 нм, (ВО спектра) – Ж-З свечение. ** Ч-сть: ~ 0,01 мг урана в 200 мл раствора высокая. Спектры люминесценции уранил-иона в H2SO4 (1 – [H2SO4] = 0,05 M; 2 – [H2SO4] = 2,5 M) Замена среды с на фосфорнокислую в присутствии F повышает ч-сть до 1 мкг U в 200 мл. Линейная з-сть: от 5·10 – 4 до 10 – 7 г U·мл –1 [UO2(SO4)3]4– < [UO2F3]– < [UO2(H2PO4)3]– < [UO2(PO4)]– 1. б) Л. реакции комплексообразования в водных растворах Это косвенные методы. Здесь используется Л. компл. с-ний с органич. реагентами. Т.о., эти м-ды применимы для в-в, самостоятельно не Л. Типы Л. реакций комплексообразования: 1) возникновение Л. в присутствии определяемого катиона при использовании неЛ. реагента; 2) изменение спектра Л. реагента в присутствии определяемого катиона; 3) гашение Л. реагента в присутствии определяемого катиона. Оксихинолин дает реакцию первого типа, т.е. сам реагент не Л. и Л. возникает только в присутствии определенных катионов (2-4-зарядных) (Al, Be, Ga, In, Sc, V, Zr, Th, Pu): Возбуждение: УФ-свет. Цвет излучения: жёлто-зелёный. Морин – дает реакции второго типа, в присутствии нек-рых катионов изменяется интенсивность и окраска Фл. Это 5-основная кислота R(OH)5. Диссоциирует по 2 первым ступеням из 5: 1) R(OH)5 [RO(OH)4]– + H+ ; 2) [RO(OH)4]– [RO2(OH)3]2– + H+. Аналитическая реакция: R(OH)5 + Men+ [RO2(OH)3]Me(n – 2)+ + 2H+ Характеристика морина в люм. анализе Элемент Условия Ч-сть, мкгмл –1 Al3 + Be2 + Zr4 + Th4 + F– pH = (3 – 4) 2 N HCl 0,035 N HCl pH = (2,5 – 5) pH = 5 + изб. Al 5 · 10 –4 10 –3 10 –3 4 · 10 –4 10 –3 метод чрезвычайно чувствителен !!! 2) Л. кристаллофосфόров Нек-рые неорг. кристаллы при внедрении в решётку посторонних элементов-активаторов приобретают способность Фл. Оч. высокая ч-сть: **уран (кр.-ф. на основе NaF) – до 10 –5 мкг; **сурьма (кр.-ф. на осн. CaO) – до 10 –6 мкг; **РЗЭ (кр.-ф. на основе ThO2) – до 10 –6 мкг Для урана очень широко применяется Фл-я кристаллофосфóра на основе NaF : при освещении УФ-светом он очень ярко Л. (желто-зеленое свечение) – интенсивнее, чем многие соли уранила. Свечение в темноте под действием УФ-света плава урановой соли со фторидом натрия Спектры свечения перлов с различной концентрацией урана [г U/ г NaF] (Т = 20 °С) 2 – 1*10–3 λфл.max = 520-600 нм Зависимость интенсивности свечения перла NaF – U от концентрации урана (в логарифмической шкале) Влияние примесей на Л. кр-ф Некот. примеси окрашивают основу: Mn придает коричн. цвет, Ni и Cu – зеленый. Это наблюдается лишь при их высоких конц-ях (превышение содержания урана на 3 – 4 порядка. Т.о., этот тип практич. примесей не мешает определению Некот. примеси с NaF сами Люм-ют: Nb Остальные примеси – обычные гасители: *** сильные гасители – Pt, Co, Ni, РЗЭ; *** средние – Fe, Zn, Th, *** слабые гасители – W, Tl. *** восстановители: Fe2+, Sn2+ и др. U(VI) → U(IV) При введении известной добавки инт-сть Л. ув-ся:→ I ---→ xд л k сx с0 сд I сд сx с 0 x I Iл x л xд л Методики определения урана по Л. кристаллофосфоров Метод изумительно прост и легко осуществим. На практике получили распространение две методики: метод дисков - метод перлов. «Петелька» из платиновой проволоки для наплавления «королька» фторида натрия в методе перлов При содержании урана в перлах 10–9 – 10–6 г погрешность определения не превышает ± (5-15) % отн. 3) Л. реакции с образованием тройных комплексных соединений (цветные твёрдофазные реакции) В этих реакциях происходит образование суспензии, т.е. взвешенных твёрдых частиц в растворе. Здесь реагенты – оснόвные красители – производные аминов – родамины, например, родамин 3Б. . Диссоциирует он по схеме: RCl R Cl Сам этот реагент Л. слабо, но при взаимодействии с анионным комплексом дает тройные интенсивно люминесцирующие комплексы: [MenAm](m–n) + RCl = [MenAmR](m–n–1) + Cl– здесь Ме – (Pu4+, U4+, Th4+, Zr4+ … ). Ч-сть: до 1мкг Pu в 1л р-ра; λфл. max = 580 нм. Недостаток - низкая точность из-за низкой воспроизводимости оптических св-в суспензий. НО: метод высокоизбирателен и наиболее чувствителен: он позволяет подавить помехи со стороны двух- и трёхзарядных ионов. 4) люминесценция твёрдых тел. Из актиноидов оч. хор. люм-ют соединения 6-валентного урана. В люм. анализе тв. тел, содержащих уран, участвует только поверхность образца, т. е. метод является довольно грубым, но очень чувствительным; используется для качественного определения уран-содержащих минералов. люминесценция твёрдых тел. Свечение урановой руды под действием УФ-излучения Спектр фл. можно установить с помощью карманного спектроскопа. Минералы, в состав которых входят U(IV), не люминесцируют. Люминесцентная способность минералов, содержащих уранил, зависит от других катионов и анионов, присутствующих в минералах. Люм. анализ может быть использован для определения урана : в воздухе производственных помещений, в природных и сточных водах, в почвах, в биологических материалах и т.д.