pptx Термохимия Размер: 498 кБ
advertisement

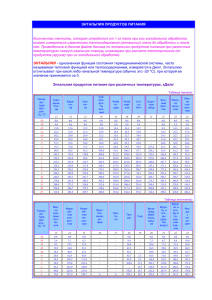
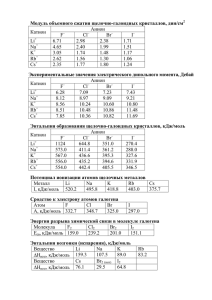
К эксперименту: Реакция Бриггса — Раушера Компоненты: серная кислота, КIO3 малоновая кислота, MnSO4, крахмал H2 O 2 Mn2+ + H2O2 → Mn3+ + H2O CH2(COOH)2 + IO3- + Н+→ I - + CO2 + Н2О I- + H2O2 → I2 (жёлтый) + H2O I2 + крахмал→ [I2 + крахмал] [I2 + крахмал] + H2O2 →IO3- + H2O Термохимия -раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций и установление их взаимосвязей с различными физикохимическими параметрами «Химическая термодинамика это наука о зависимости направления и пределов превращений веществ от условий, в которых эти вещества находятся» Почему происходит реакция ? термодинамика • Возможно ли протекание процесса? • Каковы условия протекания процесса? • Достижимо ли равновесие? Уильям Томсон, лорд Кельвин «Должна существовать некоторая эквивалентность между механической работой и теплотой» 1848 г. Томсон ввел "абсолютную термометрическую шкалу". Он объяснил ее название следующим образом: "Для этой шкалы характерна полная независимость от физических свойств какого-либо конкретного вещества". Он отмечает, что "бесконечный холод должен соответствовать конечному числу градусов воздушного термометра ниже нуля", а именно: точке, "соответствующей объему воздуха, уменьшенному до нуля, что будет отмечено на шкале как -273 °С". Термодинамическая система - объект исследования, выделенный из окружающего мира реальными или воображаемыми границами. Е вещество Cистема характеризуется функциями состояния (однозначно определяют состояние термодинамической системы их значение зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние) - U, S, G Состояние системы определяется: термодинамическими параметрами состояния (Т, р, V, C) В неизолированной системе изменение внутренней энергии ΔU равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой против внешних сил или внешних сил над системой. Uсистемы = - Q + Aнад системой V = const QV = -U p = const Qp = -H Энтальпия H = U + pV энтальпия – «теплосодержание» [кДж] Тепловой эффект реакции − теплота, выделяющаяся или поглощающаяся при химической реакции. Условия: • Т продуктов = Треагентов • не совершается никакой работы, кроме A=pΔV • V = const (изохорный процесс) QV = U2−U1 = ΔU или p = const (изобарный процесс) Qp = U2−U1 + p(V2−V1) = (U2 + pV2)− (U1 + pV1) = H2−H1 =ΔH ΔH = ΔU + pΔV Экзотермические реакции: Q > 0, ΔH < 0 Эндотермические реакции: Q < 0, ΔH > 0 Экзотермический процесс Пьер Эжен Марселен Бертло Эндотермический процесс «спонтанными могут быть только экзотермические реакции». Стандартная энтальпия образования простого вещества (устойчивой аллотропной модификации) при при стандартных условиях принята равной нулю Стандартные условия: p = 105 Па 1 атм ; Т = 298 К • • • • • • двухатомные молекулы газообразных водорода или кислорода, одноатомные благородные газы и т.п. α - форма твердого урана, β - форма (графит) для углерода, жидкие ртуть и бром исключения – фосфор белый, β-олово (белое олово). Нуль отсчета - совокупность всех химических элементов в виде простых веществ, находящихся в наиболее устойчивых формах при 25 º С. Стандартные энтальпии образования Вещество Состояние ΔH0ƒ,298, кДж/моль Ag Al As Au B Ba С (графит) С (алмаз) C O2 О3 P (г) P (белый) P (красный) I2 I к к к к к к к к г г г г к к к г 0 0 0 0 0 0 0 2,3 716 0 142,3 316,5 0 17,4 0 62,24 Стандартная энтальпия образования соединения (ΔHf0) - энтальпия реакции образования 1 моль соединения из простых веществ в стандартном состоянии 4Na + O2 = 2Na2O; 2NaOH = Na2O + H2O; 2Na + 1/2O2 = Na2O 2H2(г)+О2(г) = 2Н2О(ж); H++ОH = Н2О(ж); H2(г)+1/2О2(г) = Н2О(ж); H2(г)+ 1/2О2(г) = Н2О(г) Н2Ож Н2Ог – 44 кДж/моль H=44 кДж/моль Энтальпия реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода её из одного состояния в другое. (Г.И.Гесс,1841 г.) Следствия: Определение энтальпии реакции по данным значениям энтальпий образования Следствия: 1.Энтальпия реакции равна разности сумм энтальпий образования продуктов и исходных веществ реакции с учётом их стехиометрических коэффициентов. 2CO + O2 2CO2 Определение энтальпии реакции по данным значениям энтальпий образования Следствия: 1.Энтальпия реакции равна разности сумм энтальпий образования продуктов и исходных веществ реакции с учётом их стехиометрических коэффициентов. 2C (графит), 2 О2 2CO + O2 2CO2 Определение энтальпии реакции по данным значениям энтальпий образования Следствия: 1.Энтальпия реакции равна разности сумм энтальпий образования продуктов и исходных веществ реакции с учётом их стехиометрических коэффициентов. 2C (графит), 2 О2 2CO + O2 2CO2 Стандартные энтальпии образования Вещество СО СО2 O2 Состояние г г г ΔH0ƒ,298, кДж/моль -110,5 -393,5 0 Определение энтальпии реакции по данным значениям энтальпий образования Следствия: 1.Энтальпия реакции равна разности сумм энтальпий образования продуктов и исходных веществ реакции с учётом их стехиометрических коэффициентов. 2C (графит), 2 О2 2∙(-110,5) 2CO + O2 2∙(-393,5) 2CO2 Вещество СО СО2 O2 Состояние г г г ΔH0ƒ,298, кДж/моль -110,5 -393,5 0 Определение энтальпии реакции по данным значениям энтальпий образования Следствия: 1.Энтальпия реакции равна разности сумм энтальпий образования продуктов и исходных веществ реакции с учётом их стехиометрических коэффициентов. 2C (графит), 2 О2 2∙(-110,5) 2CO + O2 ∆Н р-ии = - 566 кДж ∆Н сгор.(СО)= - 283 кДж/моль 2∙(-393,5) 2CO2 Определение энтальпии реакции по данным значениям энтальпий сгорания Следствия: 2. Энтальпия реакции равна разности сумм энтальпий сгорания исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. 2CO2(г) 2C(графит) + O2(г) 2CO(г) Следствия: 2. Энтальпия реакции равна разности сумм энтальпий сгорания исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. 2CO2(г) 2∙(-393,5) 2∙(-283,0) 2CO(г) 2C(графит) + O2(г) Энтальпии сгорания Вещество ∆H0298, кДж/моль C графит СО г -393,5 -283,0 Следствия: 2. Энтальпия реакции равна разности сумм энтальпий сгорания исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. 2CO2(г) 2∙(-393,5) ∆Н р-ии = - 221 кДж 2∙(-283,0) ∆Н f(СО)= - 110,5 кДж/моль 2CO(г) 2C(графит) + O2(г) Энтальпии сгорания Вещество ∆H0298, кДж/моль C графит СО г -393,5 -283,0 Следствия: 3.Энтальпия реакции равна разности сумм энергий связи исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. H2 + CI2 2HCI Следствия: 3.Энтальпия реакции равна разности сумм энергий связи исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. Следствия: 3.Энтальпия реакции равна разности сумм энергий связи исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. 2 H(газ), 2 Cl(газ) 436,0+239,2 H2 + CI2 2∙431,6 2HCI Следствия: 3.Энтальпия реакции равна разности сумм энергий связи исходных веществ и продуктов реакции с учётом их стехиометрических коэффициентов. ∆Н р-ии = - 188 кДж 2 H(газ), 2 Cl(газ) 436,0+239,2 H2 + CI2 2∙431,6 2HCI ∆Н f(HCl)= - 94 кДж/моль Определение энтальпии гидратации по данным значениям энтальпий растворения Следствия: 4. Энтальпия гидратации равна разности сумм энтальпий растворения безводной соли и кристаллогидрата. CuSO4 (раствор) CuSO4 CuSO4∙5H2O Энтропия В изолированной системе самопроизвольно протекают только процессы, которые сопровождаются увеличением энтропии: S > 0 1872 – Л.Больцман: S = k lnW • Энтропия идеального кристалла при абсолютном нуле равна 0. Только 1 микросостояние W = 1 lnW = 0 So -? Н2О(ж.) = Н2О(г.) 3Н2 + N2 = 2NH3 BaCl2 (р-р) + Н2SO4 (р-р) = BaSO4 (тв.) + 2HCl(р-р) Стандартные энтальпии образования и стандартные энтропии некоторых веществ Вещество Состояние ΔH0ƒ,298, кДж/моль S0298, Дж/моль К С (графит) С (алмаз) CO CO2 H2 H2O H2O к к г г г г ж 0 1,897 – 110,5 – 393,5 0 – 241,84 – 285,84 5,74 2,38 197,5 213,7 130,52 188,74 69,96 Условие самопроизвольного протекания реакции: ∆G<0 ∆G = ∆Н - T∆S (уравнение Гиббса) ∆G<0 ∆Н - T∆S ∆Н T> ∆S <0 ∆G<0 ∆G = ∆Н - T∆S Go -? So -? Ho -? MgO(k) + CO2 (г) → MgСO3(k) Al2O 3 (k)+3SO3 (ж)= Al2(SO4)3 (k) СаСO3(к) → СаO(к) + CO2 (г) ∆G<0 ∆G = ∆Н - T∆S Go -? So -? Ho -? MgO(k) + CO2 (г) → MgСO3(k) Al2O 3 (k)+3SO3 (ж)= Al2(SO4)3 (k) СаСO3(к) → СаO(к) + CO2 (г) Go < 0 So < 0 Ho < 0 ∆G = ∆Н - T∆S 2NO2 г = N2O4 г CaCO3 тв = СаОтв + СО2 г ∆G<0 ∆G = ∆Н - T∆S 2NO2 г = N2O4 г ∆G<0 H < 0, S < 0 CaCO3 тв = СаОтв + СО2 г Н > 0, S > 0 Go > 0 ? So< 0 Ho > 3O2(г) = 2O3(г) N2 (г)+O2 (г)= 2NO (г) 6СO2(г) +6H2O(ж)= С6Н12О6(к) Вещество NO О3 Состояние г г 0 ΔH0ƒ,298, кДж/моль 90,37 142,3 С Cреаг N2 + 3H2 2NH3 [NH 3 ]2 K [N 2 ][H 2 ]3 Спрод t ∆G0 = – R∙T∙lnK= – 2,303 R∙T∙lgK ∆G = – R∙T∙lnK+ R∙T∙ln aпродуктов aисходных ( изотерма Вант-Гоффа) Окислительно-восстановительные реакции в растворах Fe + Cu2+→ Cu + Fe2+ ≠ Окислительно-восстановительные реакции в растворах Ряд напряжений металлов E0 –3.04 –2.98 –2.93 –2.92 –2.91 –2.90 –2.87 –2.8 –2.71 –2.6 –2.52 –2.37 –2.37 –2.34 Окисленная форма Li+ Rb+ K+ Cs+ Ba2+ Sr2+ Ca2+ Ra2+ Na+ Ac3+ La3+ Y3+ Mg2+ Ce3+ Восстан. форма Li Rb K Cs Ba Sr Ca Ra Na Ac La Y Mg Ce E0 –1.63 –1.23 –1.19 –0.91 –0.45 –0.40 –0.33 –0.28 –0.26 –0.14 –0.13 –2.08 Окисленная форма Al3+ Ti3+ Mn2+ Cr2+ Fe2+ Cd2+ In3+ Co2+ Ni2+ Sn2+ Pb2+ Sc3+ Восстан. форма Al Ti Mn Cr Ni Sn Pb Sc Be 0 0.20 0.851 0.951 1,15 1.18 1.498 E0 Окисленная форма Восстан. форма H+ Sb3+ H2 Sb 0.3 0.308 –0.76 Zn2+ Zn 0.342 Re Bi3+ Cu2+ Re Bi Cu Fe 0.455 Ru2+ Ru Cd 0.76 In 0.80 Co 0.85 –1.85 Be2+ Rh3+ Ag+ Os2+ Hg2+ Pd2+ Ir3+ Pt2+ Au3+ Rh Ag Os Hg Pd Ir Pt Au Окислительно-восстановительные реакции в растворах φ0Fe2+/Fe Fe + Cu2+→ Cu + Fe2+ ≠ 0 = -0,44 B φ Cu2+/Cu = 0,34 B ЭДС реакции >0 ∆G = – nFε – для ОВР 0 a в .ф. RT ln nF а ок.ф.