Гидроксид железа (III)
advertisement

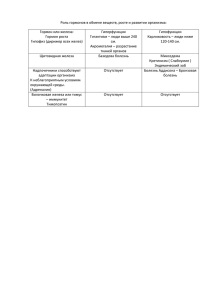
Соединения железа Выполнила учитель химии Т .В. Александрова Fe В ПРИРОДЕ ЖЕЛЕЗО РЕДКО ВСТРЕЧАЕТСЯ В ЧИСТОМ ВИДЕ, ЧАЩЕ ВСЕГО ОНО ВСТРЕЧАЕТСЯ В СОСТАВЕ ЖЕЛЕЗО-НИКЕЛЕВЫХ МЕТЕОРИТОВ. РАСПРОСТРАНЁННОСТЬ ЖЕЛЕЗА В ЗЕМНОЙ КОРЕ — 4,65 % (4-Е МЕСТО ПОСЛЕ O, SI, AL[2]). СЧИТАЕТСЯ ТАКЖЕ, ЧТО ЖЕЛЕЗО СОСТАВЛЯЕТ БО́ЛЬШУЮ ЧАСТЬ ЗЕМНОГО ЯДРА. Гематит (кровавик) красный железняк Fe2O3 Пирит FeS2 Магнети́т (магнитный железняк) FeO•Fe2O3 Лимонит Fe2O3* н2о бурый железняк Сидерит (карбонат железа, железный шпат) Сидерит, добытый в Бразилии Вивиани́т (синяя земля, синяя железная болотная руда) — минерал, водный фосфат железа Fe3(PO4)2•8H2O. • По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде — 1•10−5—1•10−8 %. Гидротерамальные источники с железистой водой Так в Casteljaloux еще в 19-ом веке, были известны два источника железистой воды, где лечили анемию и нарушения пищеварения. С 1997 здесь открыт новый термальный (42,5°C) источник железистой воды, которая с глубины 1237 м поступает в закрытые и открытые бассейны центра. Fe 2+ Гидроксид Fe(OH)2 Физические свойства Оксид железа (II) Порошок черного цвета Нерастворимый в воде Тугоплавкое (1377) Гидроксид железа (II) Белые или светлозеленые кристаллы Нерастворимый в воде Химические свойства С какими веществами реагирует оксид железа (II) ? HCl H2O NaOH Записать уравнения реакций. FeO +2HCl → FeCl2 + H2O Химические свойства С какими веществами реагирует гидроксид железа (II) ? NaOH H2SO4 H2O CaO AlCl3 Записать уравнения реакций. Fe(OH)2 + H2SO4 → FeSO4 + 2H2O Fe 3+ Оксид Fe2O3 Гидроксид Fe(OH)3 Физические свойства Оксид железа (III) Порошок краснокоричневого цвета Нерастворимый в воде Тугоплавкий (1566) Гидроксид железа (III) Красновато – коричневые кристаллы Трудно растворим в воде Температура разложения (500) Химические свойства С какими веществами реагирует оксид железа (III) ? Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3 H2O ¾ Реагирует с твердыми щелочами и с карбонатами при высокой температуре, образуя соли – ферриты. Fe2O3 + 2NaOH = 2NaFeO2 + H2O Химические свойства С какими веществами реагирует гидроксид железа (III) ? Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 + NaOH = Na[Fe(OH)4 ] Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании. Fe(OH)3 + 3NaOH = Na3[Fe(OH)6] Качественные реакции на ионы железа ( II ) Реактивом для обнаружения Fe 2+ гексацианоферрат калия (красная кровяная соль) образуется темно-синий осадок. 2 К3[Fe(CN)6 ] +3 FeSO4 = Fe3[Fe(CN)6]2↓ + 3K2SO4 турнбуллева синь Турнбуллева синь служила красителем. Названа по имени одного из основателей шотландской фирмы по производству красителей «Артур и Турнбуль». Качественные реакции на ионы железа ( III ) Реактивом для обнаружения катиона Fe 3+ гексацианоферрат (II) калия (желтая кровяная соль). 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl берлинская лазурь Также катионы Fe 3+ легко обнаружить с помощью роданида аммония NH4SCN. Роданид от греческого "родеос" красный. FeCl3 + 3NH4SCN = Fe(SCN)3 + 3 NH4Cl Обнаружение ионов железа щелочью Реакция со щелочью – еще один способ обнаружения ионов железа ( II ) и ионов железа ( III ) FeSO4 +2 NaOH = Fe(OH)2 ↓ + Na2 SO4 серо-зеленый FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl бурый Таким образом, железо в различных степенях окисления имеет разные свойства. Соединения железа (III), подобно алюминию, проявляют амфотерные свойства, а соединения железа (II) - основные. Железо в организме человека Входя в состав гемоглобина, железо обусловливает красный цвет этого вещества, от которого, в свою очередь, зависит цвет крови. В организме взрослого человека содержится 3 г железа, из них 75 % входят в состав гемоглобина, благодаря которому осуществляется важнейший биологический процесс дыхание. Применение Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих черно-белых лазерных принтерах. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Применение FeSO4·7H20 1.В основном используются для лечения и профилактики железодефицитной анемии. 2. В смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Пищевые добавки Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий. Осуществить превращения Fe → FeCl3→ Fe(OH)3→ K [ Fe(OH)4] Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe