chemical_reac
реклама

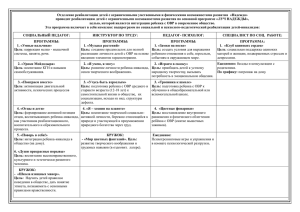
Повторение и обобщение темы «Химические реакции» 11 класс (базовый уровень) Карелия МБОУ СОШ п. Надвоицы Балиевич Людмила Ивановна, учитель химии “Нет без явного трудолюбия ни талантов, ни гениев” (Д.И.Менделеев) Повторить, систематизировать и обобщить материал по теме “Химические реакции”; подготовиться к контрольной работе. Входной контроль 1. Укажите схему реакции соединения, экзотермическую, обратимую, ОВР : а) S + O2 = SO2 + Q б) 5FeO + 2P = 5Fe + P2O5 + Q в) 2CO+ O2 ↔ 2CO2 +Q г) CO2 + H2O ↔ H2CO3 +Q Входной контроль 2. Какие факторы влияют на скорость химической реакции: а) Природа реагирующих веществ б) Концентрация реагирующих веществ в) Температура г) Присутствие катализатора Входной контроль 3. Во сколько раз увеличится скорость реакции при нагревании 700С до 1100С, если температурный коэффициент равен 2? а) б) в) г) в 4 раза в 64 раза в 16 раз в 8 раз Входной контроль 4. Во сколько раз увеличится скорость реакции в системе H2+СI2 ↔2HСI, если концентрацию водорода увеличить в два раза, а концентрацию реагирующих веществ в три раза? а) б) в) г) в 4 и 10 раз в 2 и 9 раз в 6 и 18 раз в 8 и 81раз Входной контроль 5.Какие факторы смещают вправо равновесие процесса 2CO(г) + O2(г)↔ 2CO2(г)+Q : а) Увеличение концентрации СO2 б) Изменение природы катализатора в) Увеличения давления г) Понижение температуры Входной контроль 6. Найдите сумму коэффициентов перед всеми веществами в ОВР Fe + H2O + O2↔ Fe(OH)3: а) б) в) г) 12 13 15 17 Входной контроль 7. В водных растворах, каких солей лакмус красный: а) NH4NO3 б) Na3PO4 в) AI(NO3)3 г) K2SO4 Входной контроль 8. Какая пара ионов участвует в образовании осадка при сливании растворов K2CO3 и BaCI2: а K+ и CO32б) K+ и CI- ) в) Ba2+ и CO32г) CI- и CO32- Ответы: 1-в 2 - абвг 3- в 4–б 5 – вг 6–г 7 – ав 8-в Классификация химических реакций Признак реакции Число и состав реагентов и продуктов Тип реакции Тепловой эффект Cтепень окисления 1. Соединение 2. Разложение 3. Замещение 4. Обмен 1. Экзотермические (+Q) 2. Эндотермические (-Q) 1. ОВР 2. Не ОВР Фазовое состояние 1. Гомогенные 2. Гетерогенные Катализатор 1. Каталитические 2. Некаталитические Направление реакции 1. Обратимые 2. Необратимые Дайте полную характеристику по разным признакам классификации реакции, уравнения которой: NаОН(ж)+ НСl(ж) = NаСl(ж) + Н2О(ж)+ 57,5 кДж. обмен экзотермическая не ОВР гомогенная некаталитическая необратимая К какому типу следует отнести реакцию: H+ + OH- = H2O к реакции обмена или соединения? Скорость химических реакций Скорость реакции зависит от: 1. Природы реагирующих веществ 2. Концентрации реагирующих веществ (ЗДМ) 3. Катализатора 4. Поверхности соприкосновения веществ 5. Температура (правило Вант-Гоффа) Во сколько раз изменится скорость химической реакции 2NO + O2 → 2 NO2, если увеличить концентрацию оксида азота(II) в 2 раза, а концентрацию реагирующих веществ в 3 раза? Решение: 2NO + O2 ↔ 2NO2 a)V1 = [NO]2.[O2] V2 = [2NO]2.[O2] V= 22 =4 b) V3 = [3NO]2.[3O2] V= 32.3 =27 Ответ: a) Vх.р. увеличится в 4раза b) Vх.р. увеличится в 27раз Во сколько раз увеличится скорость химической реакции при нагревании 800 до 1200, если температурный коэффициент равен 3? Решение: t2 – t1 Vt2 = Vt1.γ 10 Vпри120 = 0 Vпри800. 120-80 10 3 Vпри1200 = Vпри800.3 4 Ответ: Vх.р. увеличится в 81 раз Обратимость химических реакций Химическое равновесие Химическое равновесие смещают: концентрация (г,ж) температура (тепловой эффект) давление (объем системы) Какие факторы смещают равновесие вправо: Fe2O3(тв) +3H2(г) ↔ 2Fe(тв) + 3H2O(г) - Q 1.Увеличить концентрацию H2 2. увеличить поверхность Fe2O3 3.увеличить температуру 4. давление не изменит равновесие Окислительновосстановительные реакции -2 +5 +6 +2 3H2S +8HNO3 =3H2SO4+ 8NO +4H2O -2 +6 3 8e = S S +5 +2 N + 3e=N 8 окисление восстановление HNO3 - окислитель H2S - восстановитель Гидролиз солей Напишите уравнения реакций гидролиза солей: 1.Ca(NO3)2 2.Na2S 3.CrCI3 1.Гидролизу не подвергается 2. Гидролиз по аниону: Na2S + H2O ↔ NaHS + NaOH 3. Гидролиз по катиону: CrCI3 + H2O ↔ CrOHCI2 + HCI Реакции ионного обмена Приведите реакции(молекулярное и полное ионное) соответствующее сокращенному ионному уравнению: Fe3+ + 3OH- = Fe(OH)3↓ Fe3+ +3CI-+3Na++3OH-=Fe(OH)3+3Na++3CI- FeCI3+3NaOH=Fe(OH)3+3NaCI Выходной контроль 1. Укажите схему реакции замещения, экзотермическую, необратимую, ОВР: 1) S + O2 = SO2 + Q 2) 5FeO + 2P = 5Fe + P2O5 + Q 3) 2CO+ O2 ↔ 2CO2 +Q 4) CO2 + H2O ↔ H2CO3 +Q Выходной контроль 2. Во сколько раз увеличится скорость реакции при нагревании 700С до 1000С, если температурный коэффициент равен 4? 1) 2) 3) 4) в в в в 4 раза 64 раза 16 раз 8 раз Выходной контроль 3. Во сколько раз увеличится скорость реакции в системе 2CO+ O2 ↔ 2CO2, если концентрацию угарного газа увеличить в три раза, а концентрацию реагирующих веществ в два раза? 1) 2) 3) 4) в в в в 4 2 4 9 и и и и 10 раз 9 раз 27 раз 8 раз Выходной контроль 4.Какие факторы смещают влево равновесие процесса 2CO(г) + O2(г)↔ 2CO2(г)+Q : 1) 2) 3) 4) Увеличение концентрации СO2 Изменение природы катализатора Уменьшение давления Понижение температуры Выходной контроль 5. Найдите сумму коэффициентов перед всеми веществами в ОВР P + KCIO3 → KCI + P2O5: 1) 2) 3) 4) 6 3 15 19 Выходной контроль 6. В водных растворах, каких солей лакмус синий: 1) NH4NO3 2) Na2СO3 3) AI(NO3)3 4) K2S Выходной контроль 7. Какие пары ионов участвуют при образовании сокращенного ионного уравнения 2H+ + CO32- = CO2 + H2O: 1 K+ и S2- ) 2) Na+ и NO33) K+ и CI4) Ca2+ и SO42- Спасибо за сотрудничество Литература •Габриелян О.С., Лысова Г.Г. Химия. 11 класс. М.: Дрофа, 2008; •Габриелян О.С., Лысова Г.Г., Введенская А.Г. Настольная книга учителя. Химия. 11 класс. В 2-х ч. Ч.1. М.: Дрофа, 2004; •Габриелян О.С., Лысова Г.Г. Химия. 11 класс. Методическое пособие. М.: Дрофа, 2002; • Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах, упражнениях. 11 класс. М.: Дрофа, 2003.