Металлы часть 1
advertisement

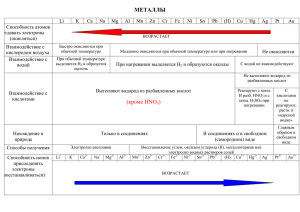
Общие химические свойства металлов Взаимодействие с простыми веществами 1. С галогенами: 2Fe0 + 3Cl02 → 2Fe+3Cl3 -1 Fe0 - 3ē → Fe+3 восстановитель Cl20 + 2ē → 2Cl -1 в - ся, ок - ль 2. С серой: 2Na0 + S0 → Na+2S- 2 Na0 - 1ē → Na+ восстановитель S0 + 2ē → S -2 в - ся, ок - ль 3. С водородом: 2K0 + H20 → 2K+1H -1 K0 - 1ē → K+1 восстановитель H20 + 2ē → 2H - 1 в - ся, ок - ль 4. С азотом: Mg0 + N20 → Mg3+2N2-3 Mg0 - 2ē → Mg+2 восстановитель N20 + 2●3ē → 2N-3 в - ся, ок - ль 5. С углеродом Ca0 + 2C0 → Ca+2C2- 1 Взаимодействие с простыми веществами 6. С кислородом воздуха Возрастает способность отдавать электроны (окисляться) Li K Ca Na Mg Al Zn Fe Pb Быстро окисляются при обычной температуре H Cu Hg Ag Pt Au Окисляются при нагревании Не окисляются Взаимодействие с водой Li K Ca Na Mg Al Zn Fe Pb При обычной температуре выделяется водород и образуется гидроксид При нагревании выделяется Н2 и образуются оксиды Водород из воды не вытесняют ZnO NaOH Al(OH)3 KOH H Cu Hg Ag Pt Au Fe2O3 PbO + H2 Взаимодействие с кислотами Li K Ca Na Mg Al Zn Fe Pb Вытесняют водород из разбавленных кислот + H2 H Cu Hg Ag Pt Au Не вытесняют водород из разбавленных кислот + H2