Презентация к уроку по теме "Оксиды"
реклама

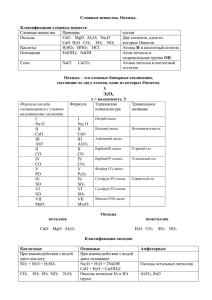
Оксиды Оксиды – это соединения двух элементов, один из которых кислород. Общая формула оксидов: ЭmOn Названия оксидов Историческое: 1. CO-угарный газ 2. CaO-негашеная известь 3. CO2-углекислый газ 4. Fe2O3-окись железа 5. SO2-сернистый газ 6. SiO2-кварц, или кремнезём 7. Al2O3-глинозем, или корунд 8. N2O-веселящий газ 9. Na2O-натр едкий Современное: оксид углерода (II) оксид кальция оксид углерода (IV) оксид железа (III) оксид серы оксид кремния оксид алюминия (III) оксид азота (I) оксид натрия Физические свойства оксидов Агрегатное состояние: 1.Твёрдые (K2О, Al2O3, P2O5) 2. Жидкие (SO3, N2O4) 3. Газообразные (CO2, NO2, SO2) Растворимость в воде: 1. Растворимые (SO2, CO2, K2O) 2. Нерастворимые (CuO, FeO, SiO2, Al2O3) Классификация оксидов Солеобразующие оксиды - это оксиды, которые образуют соли при взаимодействии с кислотами или основаниями. Например: Na2O + 2HCl = 2NaCl + H2O Оксид+кислота= Соль+Вода Несолеобразующие оксиды - это оксиды, которые не образуют солей. Виды оксидов Основные оксиды-оксиды, гидраты которых являются основаниями. FeOFe(OH)2 Кислотные оксиды-оксиды, гидраты которых являются кислотами. CO2H2CO3 Амфотерные оксиды-оксиды, которым соответствуют амфотерные основания. ZnOZn(OH)2 Химические свойства основных оксидов 1. ОСНОВНЫЙ ОКСИД + КИСЛОТА=СОЛЬ + H2O MgO + 2HCl = MgCl2 + H2O 2. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД=СОЛЬ CaO + CO2 = CaCO3 3. ОКСИД + H2O= ЩЁЛОЧЬ K2O + + H2O = 2KOH Химические свойства кислотных оксидов 1. КИСЛОТНЫЙ ОКСИД+ ОСНОВАНИЕ= СОЛЬ + H2O CO2 + H2O =H2CO3 2. КИСЛОТНЫЙ ОКСИД + H2O = КИСЛОТА N2O5 + H2O = 2HNO3 3. КИСЛОТНЫЙ ОКСИД +ОСНОВНЫЙ ОКСИД =СОЛЬ P2O5 + 3Na2O = 2Na3PO4 Химические свойства амфотерных оксидов 1. АМФОТЕРНЫЙ ОКСИД+КИСЛОТА=СОЛЬ + H2O ZnO+2HNO3=Zn(NO3)2+ +2H2O 2. АМФОТЕРНЫЙ ОКСИД+ЩЁЛОЧЬ=СОЛЬ + H2O ZnO+2KOH=K2ZnO2+H2O 3. АМФОТЕРНЫЙ ОКСИД+КИСЛОТНЫЙ ОКСИД=СОЛЬ ZnO+CO2=ZnCO3 4. АМФОТЕРНЫЙ ОКСИД+ОСНОВНОЙ ОКСИД=СОЛЬ ZnO+Na2O=Na2ZnO2 Получение оксидов 1. Металл или неметалл + O2 = оксид 2Mg + O2 = 2MgO C + O2 = CO2 2. Оксокислота = кислотный оксид + H2O H2SO3 = SO2 + H2O 3. Нерастворимое основание = основной оксид + H2O Cu(OH)2 = CuO + H2O 4. Соль = основной оксид + кислотный оксид CaCO3 = CaO + CO2 Применение оксидов Оксиды Медицина Живопись ZnO, CO, N2O ZnO, PbO Строительство CaO, Na2O, SiO2, Al2O3 Нахождение в природе Вода Атмосфера Выбросы промышленных предприятий Руды металлов Вулканы Красный корунд (Al2O3) Стекло Куприт (Cu2O) Алмаз