Копия Химическая связь
advertisement

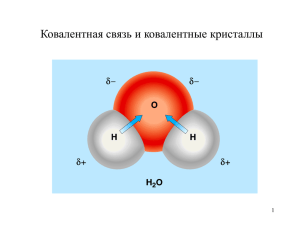
• В периодах с увеличением заряда ядра радиусы атомов • 1) уменьшаются 2) увеличиваются • В группах сверху вниз радиусы атомов • 1) уменьшаются 2) увеличиваются • В периодах с увеличением заряда ядра электроотрицательность элементов • 1) уменьшаются 2) увеличиваются • В группах сверху вниз электроотрицательность • 1) уменьшаются 2) увеличиваются Вспомним: • Что такое электроотрицательность? • Что такое химическая связь? • Какие виды химической связи вам известны? Природа химической связи Виды химических связей: Ковалентная Ионная Металлическая Водородная Характеристики связи: Прочность Энергия Длина Насыщаемость Направленность Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов. Химическая связь, представляющая собой совокупность сил, которые связывают и удерживают атомы или ионы вместе в виде устойчивых структур (молекул, ионных и атомных кристаллов и др.), имеет электростатическую природу. Различают 2 механизма образования ковалентной связи: 1-Обменный, когда каждый атом отдаёт неспаренный электрон для образования общей электронной пары. 2- Часто число образуемых элементом связей превосходит число неспаренных электронов в его атомах. Это объясняется существованием особого донорно-акцепторного механизма образования ковалентной связи. Он заключается в том, что ковалентная связь образуется в результате оттягивания уже существующей электронной пары донора (поставщика неподеленных электронных пар) на свободную орбиталь акцептора. Обычный механизм: А ↓ + В ↑ → А ↑↓ В Донорно-акцепторный механизм: А + В ↓↑ → А ↓↑ В (NH4, Н3О) Характеристики связи: Прочность Энергия Длина Насыщаемость Направленность 1.Прочность связи: 1. Чем полнее перекрываются электронные облака, тем прочнее образуемая связь. 2. Полнота перекрывания электронных облаков зависит от формы и направления орбиталей в пространстве. 3. Наиболее прочная связь образуется, когда область перекрывания электронных облаков лежит на линии, соединяющей ядра атомов, т.е. σ-связь. 4. Чем полярнее связь, тем менее прочной она является. 2. Энергия связи: это количество энергии, которое выделяется при образовании данной связи или поглощается при её разрушении. Например, образование связей в 1 моль водорода сопровождается выделением 432, 1 кДж теплоты. Значит энергия связи Н-Н составляет 432,1 кДж/моль. Энергия связи - это мера прочности связи: чем больше энергия связи, тем прочнее связь. Н –Н Е=432,1кДж/моль 3.Длина связи : расстояние между центрами ядер атома в молекуле или кристалле, или, межъядерное расстояние (L) Например: Длина С-С связи в молекуле этана равна 0,154 нм Длина С=С связи в молекуле этена равна 0,134 нм Длина С С связи в молекуле этина равна 0,120 нм Чем больше длина связи, тем меньше прочность связи. Связь атомов посредством общих электронных пар называется ковалентной связью. Как считают в настоящее время, образование общих электронных пар происходит между неспаренными электронами, причем они должны иметь разные спины. Атомы, имеющие неспаренные электроны с параллельными спинами отталкиваются, и химическая связь между ними не возникает. Различают неполярную и полярную ковалентную связь. При ковалентной неполярной связи электронное облако распределяется в пространстве на одинаковом расстоянии от ядер атомов. Такая связь возникает между молекулами, состоящими из одинаковых атомов ( например, молекулы водорода, кислорода). Н-Н О=О Cl-Cl При ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (разница <1,7). (Электроотрицательность - это свойство атомов оттягивать к себе электроны, связывающие их с другими атомами). H Cl Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония. + H H- N- H H В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорноакцепторному механизму. Связи H-N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. возникающие ковалентные связи равноценны. Это обусловлено тем, что орбитали 2s- и 2р-электронов атома азота изменяют свою форму, в результате чего возникают четыре совершенно одинаковые по форме орбитали. Форма этих новых орбиталей представляет из себя нечто среднее между s- и р-орбиталями, поэтому эти новые орбитали называются гибридными, а их возникновение - гибридизацией атомных орбиталей. Число гибридных орбиталей всегда равно числу исходных. 4.Направленность химических связей: определяется видами гибридизации атомных орбиталей. Гибридизация одной s-орбитали и двух р-орбиталей (sp2-гибридизация) образует три гибридные орбитали, расположенные в плоскости под углом 120°. Гибридизация одной s- и трех р-орбиталей (sр3гибридизация) приводит к образованию четырех гибридных орбиталей. Их расположение в пространстве имеет форму тетраэдра, валентный угол составляет 10928'. Химическая связь, образованная в результате перекрывания электронных облаков вдоль условной линии, соединяющей центры атомов, называется -связью. Связь, образованная при перекрывании электронных облаков, расположенных перпендикулярно условной линии, соединяющей центры атомов, называется связью. В молекуле может присутствовать одновременно как , так и -связь. Число ковалентных связей, которое способен образовывать некоторый атом в каждом конкретном случае ограничено числом тех валентных орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Это свойство атома называется насыщаемостью ковалентной связи. Взаимное расположение связывающих электронных облаков называется направленностью химической связи. Пространственная направленность ковалентной связи характеризуется некоторыми углами между связями, которые называются валентными углами. Ионной называется химическая связь между заряженными частицами ионами, в которые превращаются атомы в результате отдачи или присоединения электронов. Вещества, образованные из ионов, называются ионными. Например, хлорид натрия Na+Cl- Чем больше дипольный момент - тем выше степень ионности связи и реакционная способность молекул. Чем больше разность электроотрицательностей атомов – тем в большей мере электронное облако смещено к атому с большей электроотрицательностью и тем выше степень ионности связи. Ионная связь образуется только между атомами таких элементов, которые значительно отличаются по своей электроотрицательности (разность >1,7). Однако полного перехода электронов от одних атомов к другим не происходит. Следовательно, полностью ионных соединений не существует. В отличие от ковалентной связи ионная связь не обладает направленностью и насыщенностью. Водородную связь могут образовывать только такие вещества, в молекулах которых атом водорода связан с электроотрицательными атомами. Объясняется возникновение водородной связи действием электростатических сил. Рассмотрим водородную связь в молекуле воды. Электроны, образующие связи H-O, смещены к более электроотрицательному атому кислорода. Ядро атома водорода имеет только один электрон, который уже смещен к атому кислорода и атом водорода почти полностью лишается электронной оболочки. Между ним и атомом кислорода соседней молекулы воды возникает некоторое электростатическое притяжение. Это и есть механизм образования водородной связи. Чем больше электрон водорода оттянут к другому атома, тем сильнее протон притягивает электроны атома соседней молекулы. Н Н Н H O:- H+ O:- H+ O: Энергия водородной связи невелика и на порядок меньше энергии ковалентной связи, что не мешает ей оказывать значительное влияние на физические и химические свойства многих веществ. Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей. Например, у спиртов: R R R H O:- H+ O:- H+ O: Водородная связь может быть и внутримолекулярной, особенно часто она проявляется в органических веществах. В частности у белков вторичная структура поддерживается водородными связями. Металлическая химическая связь образуется в металлах и сплавах. Атомы металлов имеют небольшое число валентных электронов. Они слабо связаны с ядром и могут легко отрываться от него. В результате в узлах кристаллической решетки появляются положительно заряженные ионы, а между ними свободно перемещаются электроны – образуется так называемый “электронный газ”. Вид связи между положительными ионами, осуществляемой за счет притяжения электронов, свободно перемещающихся по кристаллу, называется металлической. Соотношение между различными типами химической связи