Фрагмент Кленова ДНК-полимеразы I E. coli
реклама

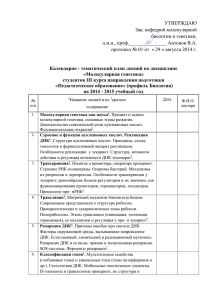
Физико-химические основы биокатализа в иллюстрациях 12. Вклад рентгеноструктурного анализа в изучение структуры и функции ферментов (изучение нуклеотидсвязывающих ферментов, оксидоредуктаз, ДНК-полимераз и других белков) Метод рентгеноструктурного анализа (РСА) – один из основных методов исследования структуры и функций ферментов и их активных центров Последние 20 лет метод РСА интенсивно развивался благодаря: 1. улучшению качества очистки белков, 2. оптимизации методов кристаллизации белков, 3. улучшению технического оснащения РСА и, в связи с глобальной компьютеризацией, внедрению машинной и компьютерной обработки данных. На заре использования РСА для кристаллизации требовалось порядка 100 мг белка, на сегодняшний день требуется не более 10 мг. Проблемы метода РСА Получение необходимого количества анализируемого белка: • получают рекомбинантную молекулу ДНК, • встраивают конструкцию, кодирующую целевой белок, в клетки E.сoli или бакуловируса, и инициируют направленную экспрессию требуемого белка, • очищают белок от примесей. Некоторые белки трудно экспрессировать с помощью рекомбинантных молекул, в частности, может возникнуть проблема сборки многосубъединичных белков. Можно столкнуться с другой трудностью, в процессе очистки целевой белок бывает трудно отделить от примесей без значительных потерь. Многие белки, качественно очищенные, бывает трудно закристаллизовать. Выявляемые с помощью РСА молекулярные структуры и соответствующее разрешение Разрешение, Ǻ Выявляемая структура 5,5 Общая конфигурация молекулы. Спирали в виде интенсивно рассеивающих лучи палочек 3,5 Полипептидный остов, не четко 3,0 Боковые цепи, не четко 2,5 Разрешение боковых цепей, плоскости пептидной группы. Расположение атомов определено с точностью +0,4 Ǻ 1,5 Расположение атомов определено с точностью +0,1 Ǻ Панкреатическая рибонуклеаза (РНКаза) Панкреатическая рибонуклеаза (РНКаза) является первым ферментом, для которого У. Стайн и С. Мур в 1960 г. установили полностью первичную структуру. Станфорд Мур 1913, Чикаго - 1982, Нью-Йорк, США биохимик Нобелевская премия по химии 1972 г. Уильям Говард Стайн 1911 – 1980, Нью-Йорк, США биохимик Нобелевская премия по химии 1972 г. Панкреатическая рибонуклеаза (РНКаза) Кристиан Бемер Анфинсен 1916, Монессен, США - 1995 американский биохимик Нобелевская премия по химии 1972 г. На основании результатов исследования ренатурации рибонуклеазы К. Анфинсен впервые в 1960 г. четко сформулировал представление о том, что пространственное строение белка определяется его первичной структурой. Рибонуклеаза гидролизует межнуклеотидные связи в РНК около пиримидиновых звеньев, которые при этом остаются этерифицированными по 3'-положению. Механизм реакции, катализируемой рибонуклеазой, расшифрован с помощью методов РСА, ЯМР и химической модификации. Карбоксипептидаза А Пространственная структура фермента и его комплекса с дипептидом Gly-Tyr как с моделью субстрата была установлена с разрешением 2 Ǻ в 1967 г. При сравнительном анализе структур фермента и его каталитического прокомплекса с дипептидом Gly-Туг была получена важная информация о строении фермент-субстратного комплекса. В частности, установлено, что при образовании комплекса гидроксильная группа Туг248 Уильям Липскомб перемещается на 1,2 нм по 1919, Кливленд – 2011, Кембридж, отношению к своему положению в США свободном ферменте (т. е. примерно на 1/3 диаметра молекулы). Химик Нобелевская премия по химии 1972 г. Предположительная роль остатка Tyr248 в реакции гидролиза дипептида, катализируемой карбоксипептидазой А Схема активного центра карбоксипептидазы А в присутствии субстрата Химотрипсин Трехмерная структура химотрипсина с разрешением 2 Ǻ была установлена методом РСА в 1976 г. Первичная структура фермента установлена Б. Хартли в 1964 г. Результаты кристаллографических исследований подтвердили предположение, сделанное с помощью необратимых ингибиторов, о том, что остатки Ser195 и His57 сближены. Следует отметить, что химические исследования не могли выявить участия Asp102 в функционировании активного центра, поскольку этот остаток погружен внутрь молекулы. В Дэвид Мэрвин Блоу настоящее время считается, что три 1931, Бирмингем – 2004, Эпплдор остатка Asp102, His57 и Ser195 Английский биофизик образуют систему переноса заряда, которая играет решающую роль в процессе катализа. Фрагмент Кленова ДНК-полимеразы I E. coli Томас Артур Стэйтц 1940, США биохимик и биофизик Нобелевская премия по химии 2009 г. за структуру большой 50S субчастицы рибосомы Первой ДНК-полимеразой, которая была закристаллизована, был фрагмент Кленова ДНКполимеразы I E. coli. Фрагмент Кленова лишен 5’-3’ экзонуклеазного домена ДНКполимеразы I, и обладает двумя активностями: ДНК-полимеризующей и 3’-5’ экзонуклеазной. РСА фрагмента Кленова впервые обнаружил специфическую архитектуру полимеразного домена, который по форме напоминает кисть правой руки и состоит из пространственных доменов «ладонь», «большой палец», прижимающий праймер-матричный двунитевой участок, и «пальцы», которые удерживают однонитевую матрицу. Фрагмент Кленова ДНК-полимеразы I E. coli Аналогичную трехмерную организацию «правой руки» имеют полимеразные домены других ДНК-полимераз и обратной транскриптазы (ревертазы) ВИЧ. РСА позволяет детализировать и модифицировать эту модель применительно к различным типам ДНК-полимераз эукариот. Наиболее консервативна топология домена «ладонь». В целом, для архитектуры полимеразного домена характерно существование внутренней полости для связывания ДНК и входящего dNTP, основанием которой является домен «ладонь». Схема связывания фрагментом Кленова ДНК в полимеразном активном центре (слева) и экзонуклеазном активном центре (справа). При переходе из полимеразного в экзонуклеазный активный центр фермент перемещается на 4 пары нуклеотидов двуцепочечной ДНК и 4 нуклеотида с 3’-конца одноцепочечной неспаренной части. «Cтруктурные мотивы» в глобулярных белках – характерные сочетания α-спиралей и β-структур α/β цилиндр в триозофосфатизомеразе Складка Россмана в NAD-связывающем домене малатдегидрогеназы Механизмы повреждений и репарации ДНК спонт анные реакции алкилирующие эндогенные окислит ели агент ы акт ивные формы кислорода O6-meG УФ-излучение мут агены окружающей среды рент геновское излучение ошибки репликации апуриновые/апиримидиновые (АР-) сайты окисленные дезаминированные и алкилированные основания однонитевые разрывы пиримидиновые димеры крупные аддукты двойные разрывы неправильное спаривание оснований вставки, делеции репарация оснований репарация нуклеотидов репарация двойных разрывов ДНК репарация неправильно спаренных оснований прямая репарация Рак Синдром Коккейна Дефекты систем репарации ДНК Старение Умственная и иммунная недостаточность Системы репарации являются мишенями для создания новых лекарств Дейст вие используемых в клинике ант ираковых препарат ов и экзогенных факт оров (ионизирующая радиация, цисплат ина, алкилирующие агент ы) основано на повреждении ДНК и нивелируется сист емами репарации. Поэт ому избират ельное ингибирование репарации улучшает т ерапевт ические эффект ы. Репарация оснований Активные формы кислорода метилирование, дезаминирование ДНК гликозилаза Х Рентгеновское излучение (одноцепочечный разрыв) Спонтанный гидролиз гликозидной связи (АР-сайт) Поли(ADP-рибозо) полимераза 1 (PARP1) XRCC1 PNK АР-эндонуклеаза 1 (APE1) XRCC1 Pol +dGTP PCNA Pol /ε +4dNTP FEN1 ДНКлигаза III +ATP ДНКлигаза I +ATP Репарация оснований ATP XRCC1 dGTP ДНК-лигаза III X Первичные дифракционные картины кристаллов Рol β, полученные на лабораторном дифрактометре (А) и на станции «Белковая кристаллография» (Б) А . Б Кристаллографические исследования выполнены ЛБХФ ИХБФМ СО РАН в рамках междисциплинарного интеграционного проекта СО РАН на белковой станции ИЯФ СО РАН (А) и на лабораторном дифрактометре НОЦ МДЭБТ НГУ (Б) Общий вид трехмерных структур комплексов ДНК-гликозилаз с модельными ДНК-субстратами • • • Lau coauth, Cell, 1998, 95, 249–258. Bruner coauth, Nature, 2000, 403, 859–866. Parker coauth,Nature, 2007, 449, 433–437. Трехмерная структура комплекса АРЕ1 человека с продуктом катализируемой этим ферментом реакции Показаны две проекции модели (Mol coauth, Nature, 2000, 403, 451–456). Справа – фрагмент схемы репарации ДНК с участием АРЕ1. Трехмерная структура комплекса ДНК-полимеразы β человека с субстратами Приведена структура комплекса с субстратами: дезоксицитидин5′-трифосфатом и двуцепочечной ДНК, содержащей в одной из цепей однонуклеотидную брешь (Sawaya coauth, Biochemistry, 1997, 36, 11205–11215 ). Справа – фрагмент схемы репарации ДНК с участием ДНК-полимеразы β (Pol β). Структура комплексов восстановленной (А) и окисленной (Б) форм фрагмента XRCC1 с ДНК-полимеразой β (Pol β) Показаны остатки цистеина, ответственные за структурные перестройки разных форм XRCC1, и электростатический потенциал на поверхности соответствующих форм белка (Cuneo and London, Proc. Natl. Acad. Sci. USA, 2010, 107, 6805–6810). Трехмерные структуры флэп-эндонуклеазы 1 (FEN1) и ДНК-лигазы I в комплексах с ДНК-субстратами А. Chapados coauth, Cell, 2004, 116, 39–50. Б. Pascal coauth, Nature, 2004, 432, 473–478. Трехмерная структура каталитического домена PARP1 Iwashita coauth, FEBS Lett., 2005, 579, 1389–1393. Схема репарации поврежденных нуклеотидов ДНК Gillet and Schärer, Chem Rev., 2006, 106, 253–276 Строение малой субчастицы рибосомы по данным РСА Полипептидные цепи рибосомных белков выделены разными цветами, полинуклеотидные цепи рРНК показаны серым цветом (Yusupov coauth, Science, 2001, 292, 883–896).