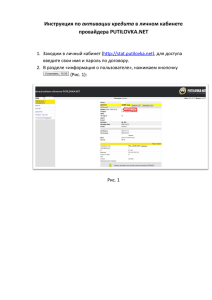
ОДНА ИЗ ЛИНИЙ РАЗВИТИЯ АКТИВАЦИИ ХИМИЧЕСКИХ РЕАКЦИЙ • 428015 Чебоксары-15, А.я. 16
advertisement

ОДНА ИЗ ЛИНИЙ РАЗВИТИЯ АКТИВАЦИИ
ХИМИЧЕСКИХ РЕАКЦИЙ
• В.А. Михайлов (Чувашский госуниверситет, ХФ),
• 428015 Чебоксары-15, А.я. 16
• <mikhailov30@mail.ru>
• Э.А. Соснин (ТНЦ, Томский госуниверситет)
• 634055 Томск, ул. 30 лет Победы, 8 – 38
• <badik@loi.hcei.tsc.ru>
• Чебоксары, Томск - 2007
Принцип МЕСТНОГО КАЧЕСТВА
• Еще в 60-е годы Г. Альтшуллер [1] выделил одно изобретение по
химической металлизации, в котором было разрешено
следующее противоречие: чтобы ускорить реакцию
восстановления до металла, раствор нагревают, но при этом
ускоряется также разложение во всем объеме раствора,
образуются хлопья мути, которые оседают на детали и портят
качество покрытия.
• {NiCl2 + Na2HPO2 + H2O}(раствор.,10°C) =(t detail ≥ 70°C)=>
Ni/detail + Na2HPO4 + HCl
• В изобретении применён принцип “местного качества” –
решение основано на прокачивании холодного раствора через
ванну, где нагревают саму деталь, обеспечивая тем самым и
большую скорость реакции в малом объёме раствора у детали,
и хорошее качество пленки металла на детали.
Принцип МЕСТНОГО КАЧЕСТВА
• В 90-е годы были найдены другие примеры использования этого
приема разрешения противоречия: в [2, 3] описаны способы
получения гексафторида платины (PtF6) и пентафторида
молибдена (MoF5), основанные на подаче холодного газа фтора
и его контакте с очень горячим металлом (платиной или
молибденом).
• Pt(700°C) + F2(–80°C) =(t = 200°C)=> PtF6(газ);
• Mo(500°C) + F2(20°C) =(t = 200°C)=> MoF5(газ).
• Т.е. и в этих патентах применен тот же принцип “местного
качества”, хотя неясен вопрос об улетучивании пара продуктов
и о полноте израсходования фтора при контакте его с
указанными металлами.
Принцип ПОСРЕДНИКА (реагента)
• Среди способов фторирования обнаружены также другие
подходы к разрешениям противоречий, обусловленных
высокой коррозионной активностью фтора к материалам стенок
аппаратов-реакторов. Так, прямая реакция галогенов с фтором
протекает в очень жестких условиях:
• Br2 + 5 F2 =(t = 300°C, P = 10 бар)=> BrF5.
• При таких условиях невозможно подобрать материал для стенок аппарата-реактора. В [4] предложен метод ступенчатого
проведения реакции с использованием CsF - реагента“посредника”:
• ClF3 + CsF =(t < 100°C)=> CsClF4;
• F2 + CsClF4 =(t = 100°C, P = 1 бар)=> CsF + ClF5.
• На основе “посредника” удалось ослабить “жесткость условий”
получения (можно использовать стенки реактора из
полифторполимера).
Принцип ПОСРЕДНИКА (реагента)
• Этот же приём применил изобретатель [14, 18] для увеличения
производительности способа получения AlBr3 (t>300°C):
• Al + Br2 =(t)=> AlBr3(пар) + Q (=412 кДж/мол)
• Если подача Br2 больше нормы, то количество AlBr3 растет, но
качество ухудшается (при перегреве t>>300 за счёт Q реакции
образуется AlBr, который при конденсации пара распадается
• 3 AlBr =(t<100°C)=> 2 Al + AlBr3 .
• Предложен реагент-посредник SnBr4(пар), Q уменьшается:
• Al + SnBr4 =(t)=> AlBr3(пар) + Sn(расплав) + Q1 (= 118 kJ/mol)
• и производительность возросла более чем в 3,5 раза.
Принцип ПОСРЕДНИКА (реагента)
• Этот же принцип применен изобретателями в техрешениях
• МОЛЕКУЛЯРНО-ТОЧНОГО ДОЗИРОВАНИЯ
реагентов, например [1, 13, 14]:
•
вместо реакции SiCl4 + CH4 =(t2)=> SiC + 4 HCl ;
• предложено: SiCl4 + CH4 =(t1<t2)=> CH3SiCl3 ; после очистки
• CH3SiCl3 =(t2)=> SiC + 3 HCl .
• Здесь «посредник» - CH3SiCl3 промежуточное соединение.
• Или вместо реакции RSN-NH2 + HNO3 + H2SO4 => RSN-NO2 ;
• Предложено: RSN-NH2 + HNO3 => RSN-NH2.HNO3 , соль
• очистить, растворить и добавить серную кислоту:
• RSN-NH2.HNO3 + H2SO4 => RSN-NO2
• Здесь реализован также метод ВОЗНИКАЮЩИХ реагентов.
Активация в ЭЛЕКТРИЧЕСКОМ или СВЕТОВОМ полях
• В изобретении [5] предложен “мягкий” способ синтеза
пентафторгалогенов по прямой реакции (при t= –70°С, P= 0.1
бар):
Br2 + F2 =(электро-поле)=> Br2(v)* + F2(v)* =(–70°C, 0.1 бар)=> BrF5.
• (Вместо “жёстких” условий прямой реакции t=300°C P=10бар).
• Синтез в условиях возбуждения полем тлеющего электрического разряда практически полностью исключает коррозию
стенок фтором, т.к. время жизни молекул в возбужденном
состоянии оказывается достаточно коротким, чтобы F2(v)* не
успевал долететь до стенок аппарата. В то же время при
• t= –70°С, видимо, повышается время жизни возбуждённых
молекул, чтобы они успели прореагировать между собой.
• Здесь применен эффект КВАНТОВОЙ АКТИВАЦИИ.
Активация в СВЕТОВЫХ (УФ) полях
•
•
•
•
Известно много патентов, основанных на облучении УФ-светом и
активации реакций: СхНу(вода) + О2 =(+УФ, t=20°C)=> CO2 + H2O .
Или действием озона: 3 O2 =(Эл-поле/ УФ)=> 2 O3 ;
• CxHy(вода) + O3 =(t=20°C)=> CO2 + H2O .
Активацию можно проводить излучением с контролируемым
спектральным составом – лазерным или узкополосным некогерентным
(источниками резонансного излучения на парах металлов, эксилампы
высокого давления и т.д.).
Использование узкополосного УФ излучения уже дало результаты в
микроэлектронике при получении защитных тонких слоев диоксида
кремния на поверхности кремния: поверхность при 300°С подвергается
действию излучения эксиламп (с максимумами излучения на 172 и 222
нм), а между лампой и подложкой вводятся смеси SiH4 и O2 или N2O)
[8]. При традиционном отжиге (выше 600°С) требуются большие
энергозатраты.
Использование КАТАЛИЗАТОРОВ
• Другой способ активации химреакций – КАТАЛИЗ. Обычные
катализаторы воздействуют на 1 пару электронов молекулы,
переводя её в возбуждённое состояние, в результате в много
электронных химических реакциях “жёсткость” условий их
протекания снижается незначительно.
• Известно, что биологические катализаторы – ФЕРМЕНТЫ,
работающие в весьма “мягких” условиях среды реакции,
воздействуют (возбуждают) одновременно несколько пар
электронов молекул-реагентов:
• CO2 + H2O + hv =(хлорофил)=> C6H12O6 ,
• как в реакциях фотосинтеза (в листьях растений).
Резонансная КВАНТОВАЯ АКТИВАЦИЯ молекул
• В [12] описан способ деструкции органических соединений, на
которые в зоне активации действуют акустическим и/или
электромагнитным полем. Частота поля подбирается такой,
чтобы обеспечить РЕЗОНАНС с колебаниями внешних электронов молекул органических соединений. Последующее воздействие при 140–380°С ведет к активной деструкции органических
соединений, особенно высокомолекулярных углеводородов
(температура меньше обычной каталитической деструкции без
активации). Это пример КВАНТОВОЙ АКТИВАЦИИ. Обычно
активированные комплексы малоустойчивы (но в данном патенте отмечено, что состояние повышенной реакционноспособности сохраняется до 30 дней). Предложен высокочастотный
озонатор [15], повышающий выход О3, если частота поля будет
в резонансе с частотой валентных электронов молекул О2 .
Некоторые РЕЗОНАНСНЫЕ реакции
• Предложено [16-18] облучать выхлопные газы лазерным лучом
с резонансной частотой для дожигания и нейтрализации
вредных компонентов газов. (Хотя, вероятно, в предложениях
есть ошибка – нужно резонансное возбуждение не самих
вредных газов, а кислорода с переводом его в озон.)
С другой стороны, многие природные биохимические процессы
(как синтез хлорофиллом из СО2 и Н2О глюкозы, связанного
азота с помощью нитрогеназы, окисления глюкозы в животных
организмах) протекают в весьма мягких условиях – при
невысоких температурах и давлении, не требуют очень чистых
препаратов. Несомненно, природные каталитические процессы
протекают на основе резонансного возбуждения валентных
электронов реагентов.
ВЫВОДЫ
• 1. По патентным данным рассмотрена следующая ЛИНИЯ
РАЗВИТИЯ способов активации химических реакций:
• нагрев общий, нагрев местный, реагенты посредники,
активация молекул в электрических и световых полях,
катализаторы и ферменты, резонансная активация молекул.
• 2. Активация может выступать как звено в цепи реакций,
ведущих к получению полезного продукта. Активированный
комплекс, как правило, быстро разрушается (с излучением
поглощенного кванта), но в подходящих условиях может
обеспечить повышение выхода продукта с минимизацией затрат
энергии на возбуждение молекул.
• 3. Пока описано мало технических решений, основанных на
резонансной активации молекул, можно полагать, что будущее
• за КВАНТОВОЙ (резонансной) активацией молекул реагентов.
Гипотеза
• Можно надеяться, что возможны обходные пути проведения
реакций синтеза с участием простых веществ, основанные на
“квантовой активации молекул”.
• Например, можно поискать условия синтеза фторидов
многовалентных Pt и/или Mo в более простых, “мягких” условиях
по нагреву или давлению, если процесс нагрева металловреагентов (Pt, Mo) объединить с квантовой активацией.
Например, действовать при нагреве металлов не просто
переменным током, а СВЧ-полем (сверхвысокой частоты),
подобранным так, чтобы одновременно переводить молекулы
газа в возбужденное, активированное состояние. Выбор таких
режимов требует проведения теоретического и
экспериментального исследований.
Заключение
• В настоящее время проводятся исследования разных способов
квантовой активации молекул [5, 9 -16]. Активацию газовой,
твёрдой и жидкой фаз проводят электрическими разрядами,
ультрафиолетовыми лучами, известна механохимическая активация твердых реагентов [6–11] и т.д. Природные синтезы нам
подсказывают, что слабо разработаны технические приёмы решения экологических и др. проблем, основанные на квантовой
активации. Вероятно, что работы в этой области опубликованы
не полно: так, в [16 -17] приведены данные о спектральных
свойствах углеводородов, включая ИК-спектры, которые не могут служить активации химических реакций. Обнаружены лишь
3-4 работы, в которых можно выявить использование активации
реакций в практических целях [5, 8, 12, 15, 16], но вероятно, что
способы активации весьма перспективны.
Литература
•
•
•
•
•
•
•
•
1. Альтшуллер Г.С. Сб. задач и упражнений по методике изобретательства.Баку, Гянджлик, 1970, с.22 [а.с. 186246]; Найти идею – Нвсбк, 1986, с.166-168.
2. Цветников А.Г. Получение гексафтор Pt,/БИ-1999,24, с.602 /пат.РФ 1419069
3. Гончарук В.К. Получение пентафтор Мо, /БИ-1999, 27, с.455 /пат. РФ 1760642.
4. КАЭ Франции Способ получения пентафтор хлора, /пат. СССР 290530
5. Институт новых химических проблем АН СССР. Способ получения пентафтор
брома.- /БИ-1973, 21, с.77, МКИ С01В 7/24, а.с. 380683.
6. Глинка Н.Л. Общая химия. Л.: Химия, 1982. 720 с.
7. Gellert B. and Kogelschatz U. UV Generation of Excimer Emission in Dielectric
Barrier Discharges // Appl. Phys. B. 1991. Vol. B52. P.14-21.
8. Boyd I.W., Zhang J.Y. New large area ultraviolet lamp sources and their
applications // Nucl. Instr. and Meth. in Phys. Research B. 1997/ V.121. P.349-356.
9. Соснин Э.А. Закономерности развития газоразрядных источников
спонтанного излучения: Руков-во разработчика. Томск: Изд.ТомГУ, 2004. 106 с.
10. Богатырев А.Е. и др. Активирование веществ и его технологические
применения: обзор. М.: ЦНИИ электроника, 1984, 50 с.
Доп. литература
•
•
•
•
•
•
•
•
11. Авакумов Е.Г. Механические методы активации химпроцессов. Новосибирск:
Наука. 1979; [Способ получения водорода, БИ-1970, 9, с.23 / а.с. СССР 264360.]
12. Крестовников М.П. и др. Способ деструкции органических соединений. /Пат.
2246525 (C1, опубл. 2005.02.20) РФ, МПК7 C10G15/08;
13. Mikhailov V.A. etc. Development of the Database on Use chemical Effects for
Decisions of creative ecologycal Problems: http://www.aitriz.org/Abstracts/2005
(abstr.N 13, 2 p., 90 chemical effects).
14. Михайлов В.А и др. База данных по использованию химэффектов в химии и
экологии: http://ecoportal.ru/db.php (1200 реф., 90 химэффектов, 2005).
15. Емельянов Ю.М., Емельянов М.Ф. Высокочастотный трубчатый озонатор./Пат. 947740 (Япония), 1977. (Емельянов Ю.М. и др. //А.с. 133560 (СССР), 1960)
16. Dimpfl; William L. Лазерное облучение и деструкция загрязнителей в газовом
потоке. /US 343988 1982.01.29 / (пат. США №4397823, МПК В01J 8/00; 1983).
17. Хныкин Н.В. Очиститель отработанных газов ДВС /Заявка РФ 2003131622 от
2005.05.10, МПК7 F01N 3/00/ Пат. РФ 2263795 2005.11.11.
18. Фомин В.К. Получение галогенидов /А.с. 316654, 387932; БИ-1970, 30;
1973,28.
One LINE of ACTIVATION of CHEMICAL REACTIONS on PATENT
DATA / Mikhailov V.A., Sosnin E.A.
•
During recent 10-15 years have place active training of experts abroad on a base of
TRIZ (the theory of the inventive problems solution - TIPS). It is possible to estimate,
that it is employed in the USA, Western Europe, South Korea approximately by
semimillion engineers, including workers of chemical concerns. Though TRIZ has
come up and has started to live in USSR (1946–1998, G. Altshuller), in Russia now it
is unfamiliar to the majority of experts, including chemists. We are introduced the
students guiding of TRIZ. But the examples chemistry and ecology patents in TRIZ
are strongly limited. Therefore more than 30 years together with students we collect
the patent information with the purpose to reveal especially the TRIZ in chemical
patents. In particular it is possible to pick out the following line of development of
chemical reactions activation ways:
•
From the general heating of the system to local heating (only in reaction
zones) to application of reagents-intermediaries and intermediate
compounds transfer to activation of molecules in electric fields or a
ultraviolet light use of the catalysts attacking one electronic pair and
further on set of many such pairs of a molecule, participating in reaction.
•
Probably the most effective pathway of system activation is resonant activation of a
molecule-reagent. But in present time, it must be noted, in existing patents there are
not enough examples of resonant initiation of molecules, f.e., oxygen molecules
activation for ozone yield increasing and activation of exhaust gases in cleaning
procedures.
See site: HTTP://WWW.ECOPORTAL.ru/DB.php
•
•
•
•
•
It is possible to note, that the last recommendation in two patents (USA, Russia) is
possibly wrong because the waste gas is multifold system. But this mistake might be
correct owing to for purification it is necessary to apply O2 molecules activation, as
well as in the patent about ozone (the technical realization of ozone adds to exhausts
is easy). The corroboration of this line of development of technical decisions we can
find in nature. So, all demanded reactions are carried out in soft conditions of
fermentation catalysis (owing to simultaneously resonant initiation of several
electronic pair’s molecules of a reagent).
We do not know, in what High Schools of the Russian Federation the trainings of
chemists on a base of TRIZ have placed. Many people believe, that TRIZ could be
using anywhere but don’t in chemistry. Except for High Schools, it is a little experts,
who began to use TRIZ in the inventive practice. We consider that it is necessary to
expand the TRIZ-learning of chemists develop the applications of chemical effects (as
typical receptions of decisions of creative tasks) by the analysis of patents and
scientific publications. The fragment of a chemical effects database is place at
http://www.ecoportal.ru/db.php.
V. Mikhailov, E. Sosnin //Proc.Conf. «3 Generations of TRIZ», St.-Peterburg, 2006, p.
239.
V. Mikhailov, E. Sosnin, //«Modern information technologies» Penza, 2006, 3, p. 56.
Спасибо
• Спасибо за внимание !
• Готовы к ответам на вопросы и
• обмену информацией о базе данных
• по использованию химических эффектов в 12000 патентов
• по химии и экологии (более 100 химэффектов):
• 428015 Чебоксары-15, А.я. 16 Михайлов В.А.
• <mikhailov30@mail.ru> (Чувашский ГУ, ХФ)
• <badik@loi.hcei.tsc.ru> Соснин Э.А. (Томский ГУ)