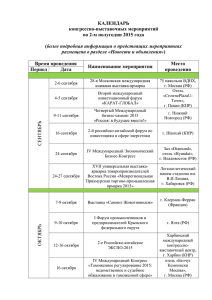
Мониторинг движения медицинских продуктов в регионах
реклама

Мониторинг движения медицинских продуктов в регионах Г. Л. Вышковский, д.э.н., проф., президент группы компаний РЛС http://www.rlsnet.ru http://www.lingvapharm.ru МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд: 1 Мониторинг движения лекарственных препаратов уже проводится на федеральном уровне и в регионах • С целью распознавания фальсифицированного и контрафактного медицинского продукта на региональном и муниципальном уровне с 1 июля 2015 года производители и импортёры лекарственных средств обязаны предоставлять в Росздравнадзор сведения о сериях, партиях лекарственных средств (все товарные позиции, закупаемые на бюджетные средства всех уровней и используемые для оказания льготной медицинской помощи населению), поступающих в гражданский оборот в Российской Федерации. ( В силу положений Федерального закона от 22.12.2014 №429-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» Письмо Росздравнадзора № О/И-752/15 от 12.05.2015). Для этого введена в действие новая версия подсистемы «Выборочный контроль» Автоматизированной информационной системы Росздравнадзора (Старая версия была введена информационным письмом Росздравнадзора №04И-1332/11 от 20.12.2011). • Разработаны регламенты взаимодействия региональных и муниципальных автоматизированных систем с аптечными организациями городов или регионов, имеющих право на отпуск лекарственных препаратов и изделий медицинского назначения бесплатно или с 50-и процентной скидкой, которые разъясняют порядок осуществления мониторинга лекарственных препаратов от заявки до отчетности об 2 их использовании (в части реализации ФЗ от 22.08.2004 №483). МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Регионы используют базу данных РЛС® В рамках ЕГИСЗ наши партнеры – автоматизаторы внедрили БД РЛС® в 40 субъектах РФ (более 160 тысяч рабочих мест) : Белгородская область, Владимирская область, Волгоградская область, Казань, Калининградская область, Камчатский край, Кировская область, Ленинградская область, Магаданская область, Новосибирская область, Омская область, Пензенская область, Пермский край, Приморский край, Псковская область, Республика Башкортостан, Республика Бурятия, Республика Калмыкия, Самарская область, Саратовская область, Тульская область, Республика Мордовия, Республика Карелия, Республика Бурятия, Республика Мордовия, Республика Саха (Якутия), Республика Хакасия, Рязанская область, Санкт-Петербург, Саратовская область, Ульяновская область, Хабаровский край, Ханты-Мансийский автономный округ, Челябинская область, Ямало-Ненецкий автономный округ. а также в ЕМИАС во всех ЛПУ Москвы (22 тысячи рабочих мест) Региональные системы лекарственного обеспечения привязываются к кодам РЛС®. Это обеспечивает возможность связки закупаемой номенклатуры ЛС с учетной системой каждого региона. МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Новый мониторинг движения медицинских продуктов в регионе Цель: Создание высокотехнологичной автоматизированной системы учета медицинских продуктов (лекарственных средств и медицинских изделий), закупаемых на бюджетные средства. Способ достижения цели: Обеспечение прослеживаемости каждой серии упаковки лекарственных средств (ЛС) и медицинских изделий (МИ), поступающих на региональный аптечный склад (РАС), на всех этапах ее жизненного цикла от уполномоченной фармацевтической организации до пациента. МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 4 В перечень наиболее острых проблем при оказании медицинской помощи населению входят: • Контроль за расходованием бюджетных средств на лекарственное и медицинское обслуживание населения [1]. • Контроль за оборотом лекарственных средств и изделий медицинского назначения [1]. • Cнижение затрат на лекарственное обеспечение за счет внедрения лучших практик и повышения точности планирования потребности в дорогостоящих и скоропортящихся лекарственных средствах [1]. • Снижение находящейся в обращении на территории Российской Федерации фальсифицированной, контрафактной и недоброкачественной фармацевтической продукции [2], а также противодействие ошибкам распределения персоналом МП на сестринском посту. • Увеличение степени достоверности данных отчетов и скорости их построения. [1]. Приложение к Приказу Министерства здравоохранения и социального развития Российской Федерации от 28 апреля 2011 г. N 364 [2] .Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года. 5 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Похожие до степени смешения образы лекарственных препаратов, которые могут привести к появлению ошибок распределения МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Постановка задачи создания ФГИС МДЛП Источник: http://www.kremlin.ru/assignments/47725 7 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Основные документы нормативного обеспечения задачи • Минздрав РФ подготовил проект дополнений в Федеральный закон от 12 апреля 2010 года № 61-ФЗ , а именно Федеральный закон “О внесении изменений в отдельные законодательные акты Российской Федерации” “Внести в Федеральный закон от 12 апреля 2010 года № 61-ФЗ «Об обращении лекарственных средств» (Собрание законодательства Российской Федерации, 2010, № 16, ст. 1815; № 49, ст. 6409; 2013, № 48, ст. 6165; 2014, № 43, ст. 5797; № 52, ст. 7540)”. • Приказ Министерства здравоохранения РФ от 11 сентября 2015 г. №638 "О Межведомственной рабочей группе по вопросу создания системы мониторинга движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя.» • Межведомственной рабочей группой была подготовлена концепция «Федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки.» 8 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Основные положения проекта Минздрава РФ 1. Система должна быть государственной. 2. К полномочиям федеральных органов исполнительной власти относятся: - разработка и поэтапное внедрение Системы; - контроль за внедрением и применением субъектами обращения лекарственных препаратов (ЛП) Системы; - предоставление информации из Системы. 3. Правительство РФ устанавливает уполномоченный федеральный орган (УФО) исполнительной власти и порядок его функционирования. В соответствии с этим порядком УФО: - формирует государственный информационный ресурс (ГИР); - обеспечивает автоматизированное ведение Системы; - обеспечивает контроль за внедрением и применением субъектами обращения ЛП Системы; - обеспечивает предоставление информации из информационного ресурса в порядке и объеме, установленном Правительством РФ. 4. Субъекты обращения ЛП (юридические лица и индивидуальные предприниматели, осуществляющие производство, изготовление, хранение, перевозку, ввоз в РФ, вывоз из РФ, отпуск, реализацию, передачу, применение и уничтожение ЛП) обеспечивают в порядке, установленном Правительством РФ, внесение данных в Систему о находящихся в обращении ЛП посредством считывания и (или) записи данных, хранящихся в маркировке указанных ЛП. 5. Первичная упаковка (если для этого существует техническая возможность) и вторичная (потребительская) упаковка ЛП маркируется в порядке и объеме, установленном Правительством РФ. 9 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Задачи, которые призвана решать Система 1. Мониторинг движения ЛП с целью приостановления обращения ЛП, не соответствующих требованиям качества, эффективности и безопасности (сейчас эта работа делается Росздравнадзором практически вручную, путем рассылки соответствующих писем). 2. Изъятию из обращения ЛП с истекшим сроком годности. 3. Предотвращению обращения контрафактных и фальсифицированных ЛП. 4. Контроль за уничтожением ЛП. (Концепция ФГИС МДЛП) 5. Создание эффективной системы информационной поддержки органов управления национальной системы здравоохранения на федеральном и региональном уровнях, в целях обеспечения принятия управленческих решений в сфере лекарственного обеспечения населения, исходя из задач обеспечения национальной безопасности Российской Федерации. (Вместе с тем, среди заявленных участников Системы нет регионов!?) 1 0 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Концепция ФГИС МДЛП (общие замечания) • Как соотносится Концепция ФГИС МДЛП с утвержденной Концепцией создания единой государственной информационной системы в сфере здравоохранения и стратегией лекарственного обеспечения населения Российской Федерации на период до 2025 года? [1], [2]. • Как решается задача построения НСИ Системы? Для построения учетной системы нужна нормализация информационных потоков различных участвующих в обращении информационных и учетных систем участников. Единая информационная и управленческая среда Системы строится путем интеграции информационных и учетных систем участников путем интеграции приложений и данных. Интеграция данных подразумевает их консолидацию, нормализацию, гармонизацию и синхронизацию. Решение этой задачи связано с модернизацией нормативной базы, отнимает много материальных и временных ресурсов. Удельный вес этих работ существенный и заслуживает описания в концепции. • Не определены источники финансирования Системы. • Не обобщен мировой опыт. • Не указаны стандарты уникальной идентификации МП. [1]. Приказ Минздравсоцразвития России №364 от 28 апреля 2011 г. 11 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Производитель передает в ФГИС МДЛП следующие данные: 1. 2. 3. 4. 5. 6. Наименование ЛП в соответствии с ГРЛС. Международное непатентованное наименование ЛП. Номер партии ЛП, для которой запрашивается ИК и ГК. Общее количество первичных упаковок ЛП. Количество первичных упаковок ЛП входящих в состав вторичной упаковки ЛП. Количество вторичных упаковок ЛП входящих в состав групповой упаковки ЛП. 7. А где GTIN? 8. Нет связи между препаратом и его номенклатурной позицией в сопровождающих документах. Для этого нужна гармонизация федеральной номенклатуры с локальной. А про это ни слова! 9. Федеральный центр будет вести региональные надбавки? 12 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Проблема уникальности GITIN: Разные упаковки МП могут содержать одинаковые GTIN • Римпин капсулы 300 мг, 10 шт. - упаковки ячейковые контурные (2) - пачки картонные 8901114129101 • Римпин капсулы 450 мг, 10 шт. - упаковки ячейковые контурные (2) - пачки картонные 8901114129101 • Римпин капсулы 150 мг, 10 шт. - упаковки ячейковые контурные (10) - пачки картонные 8901114129101 • Римпин капсулы 300 мг, 10 шт. - упаковки ячейковые контурные (10) - пачки картонные 8901114129101 • Римпин капсулы 450 мг, 10 шт. - упаковки ячейковые контурные (10) - пачки картонные 8901114129101 • Хайлефлокс таблетки покрытые пленочной оболочкой 500 мг, 5 шт. - блистеры из ПВХ/алюминия (1) – пачка картонная 8904102200080 • Хайлефлокс таблетки покрытые пленочной оболочкой 500 мг, 7 шт. - блистеры (1) – пачка картонная 8904102200080 • Хайлефлокс таблетки покрытые пленочной оболочкой 500 мг, 10 шт. - блистеры из ПВХ/алюминия (1) – пачка картонная 8904102200080 • Хайлефлокс таблетки покрытые пленочной оболочкой 500 мг, 5 шт. - блистеры из ПВХ/алюминия (10) – пачка картонная 8904102200080 • Хайлефлокс таблетки покрытые пленочной оболочкой 500 мг, 10 шт. - блистеры из ПВХ/алюминия (10) – пачка картонная 8904102200080 • Делецит раствор для приема внутрь 600 мг/7 мл, 7 мл - флаконы (10) - пачки картонные • Флексен суппозитории ректальные 100 мг, 6 шт. - упаковки ячейковые контурные (2) - пачки картонные 8024790041014 • Лифоран порошок для приготовления раствора для внутривенного и внутримышечного введения 1 г - флаконы 10 мл - пачки картонные • 8901114305307 8024790041014 13 Лифоран порошок для приготовления раствора для инъекций, 250 мг - флаконы (1) - пачки картонные 8901114305307 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Действующая модель Системы есть уже сегодня на базе РЛС. На ней можно апробировать работу Системы в пилотном регионе. Есть также препараты, промаркированные DMC кодами. Нужна только воля регулятора. МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 15 Структура данных номенклатурных записей в РЛС 16 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Перечень важных и необходимых работ • Принять на этапе опытной эксплуатации Системы в качестве основы федерального справочника номенклатурных позиций МП коды базы данных РЛС (prepID, nomenID, seriaID) – обеспечение гармонизации в прошлом. • Регулятору установить контроль за обеспечением производителями присвоения каждой вводимой в обращение упаковки МП уникального кода GTIN в системе GS1 – обеспечение гармонизации в будущем. • Регулятору обеспечить на уровне баз данных первоисточников единство записей номенклатурных позиций МП и создать сервис по нормализации региональных номенклатурных справочников (ГРЛС, ГРМИ, БД «Таможенной статистики» и др). 17 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд АРМ уполномоченного лица: сличение и передача транзакции Учетная система локального участника Системы Центр учёта событий АРМ уполномоченного лица Пакет документов Центр регистрации и авторизации субъекта – участника системы и уполномоченных лиц Идентификаторы: Субъекта – участника системы, уполномоченного лица Цепочки поставок лекарственных препаратов МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 18 Набор полей сообщения о событии идентификатор рабочего места arm_id operator_id идентификатор уполномоченного лица event_datetime дата и время события event_type идентификатор типа события из справочника типа событий dmc код-datamatrix лекарственного средства params необязательный набор пар имен и значений, позволяющий передавать в Систему мониторинга дополнительную информацию. Описание API веб-сервиса для автоматизаторов можно скачать по адресу: https://docs.google.com/document/d/10yqw0X19JS16vHSunRfLHECaRkIwoQGh4SH6sKEf2YE МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 19 Обязательные условия разработки и построения Системы • Система должна функционировать в автоматическом режиме как на этапе сбора данных мониторинга медицинских продуктов (МП), так и на этапе построения отчетов. • На этапе опытной эксплуатации Система должна функционировать в параллельно с существующими сегодня в каждом регионе системами учета МП, закупаемыми на бюджетные средства. МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 20 Для демонстрации прототип региональной системы РЛС реализован на облачной платформе МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Главные динамические процессы в Системе Гармонизация номенклатур лекарственных препаратов и других МП через информационные центры гармонизации Учёт событий посредством их регистрации уполномоченным лицом в точках передачи (распределения) товаров в центрах регистрации (ЦР) Автоматическое построение отчётов по шаблонам в центрах отчетов (ЦО) Получение данных из официальных источников Регистрация и авторизация субъектов-участников Системы и уполномоченных лиц в Центре регистрации и авторизации ЦРЛ МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 22 Матрица состояний в Центре учёта (ЦУ) событий (10 000 транзакций в секунду) Транзакции от АРМов уполномоченных лиц в точках перемещения (распределения) МП. Автоматические e1 e2 ei eI запросы в Центр отчётов S1 1 1 … 0 … 1 S2 0 1 … 1 … 0 12/15 Sj 0 1 … 1 … 0 SJ 1 1 … 1 … 1 02/15 01/15 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Периоды времени Слайд 23 Диаграмма состояний множества серий одной упаковки ЛП МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 2 4 Движение серий упаковки ЛП МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 25 Карта жизненного цикла одной серии упаковки ЛП Данные таможенной статистики Данные владельцев серии лекарственного препарата Текущая дата МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 26 Перечень работ, которые необходимо выполнить в региональном (муниципальном) сегменте • Установить для поставщиков МП форматы данных сопровождающих документов в виде, достаточном для идентификации кодов номенклатурных позиций на уровнях, эквивалентных наименованию номенклатурной позиции (prepID), упаковке (nomenID), серии упаковки (seriaID). • Провести на базе федерального сервиса (в случае отсутствия на базе сервиса Лингвафарм) нормализацию названий номенклатурных позиций региональных справочников всех участников Системы. • Провести гармонизацию номенклатурных позиций региональных справочников всех участников Системы на уровнях prepID, nomenID и seriaID. • Доработать региональные и локальные системы учета МП (ИЦ, ЦУ, ЦО). • Установить в пунктах передачи распространения МП АРМы уполномоченных лиц. • Обеспечить регистрацию данных мониторинга движения МП через АРМы уполномоченных лиц. • Обеспечить накопление, хранение данных мониторинга в региональной (муниципальной, локальной) системе учета событий и построение отчетов на их основе. • Использовать собственные данные для собственных нужд. 27 МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд Пилотное тестирование функционирования региональной Системы Пилотное тестирование функционирования Системы уже сейчас можно провести на лекарственных препаратах, имеющих Data Matrix Code. Список препаратов приведён ниже: - Трентал, - Немозол (таблетки), - Ирифрин, - Хайлефлокс На упаковке каждого препарата содержится код Data Matrix, нанесённый типографским способом (фотографии упаковок и кодов DMC приведены ниже): МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 28 Трентал Ирифрин МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 29 Немозол Хайлефлокс МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 30 Условия для учета событий фармрынка Идентифицированы объекты учета. (Гармонизация от РЛС и национальный идентификатор). Объекты учета помечены графическими идентификаторами. (GS1-128 в виде кода datamatrix, http://www.gs1.org/docs/barcodes/GS1_General_Specifications.pdf) Рабочие места уполномоченных лиц оборудованы сканером datamatrix кодов, программное обеспечение доработано. Рабочее место имеет доступ к серверу мониторинга. Субъект зарегистрирован в системе, зарегистрированы его рабочие места и уполномоченные лица. МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 31 Итоги круглого стола “Мониторинг медицинских продуктов в регионах”, 22 марта Перечень вопросов, рассмотренных на круглом столе Медсофт 2016 : 1. Проблема обеспечения уникальности GTIN кодов медицинских продуктов и сервис по проверке их уникальности. 2. Сервис обеспечения уникальности кодов GTIN совместными усилиями РЛС и GS1 3. Перечень задач, которые необходимо решать при обеспечении мониторинга МП в регионах и способы их решения сегодня. 4. Готовность региональной МИС к внедрению в систему мониторинга движения медицинских продуктов. Достижения. 5. Автоматизированное рабочее место уполномоченного лица и регламент его функционирования. 6. Новые информационные сервисы РЛС и их внедрение: - ЖНВЛП, разбраковка, забраковка, взаимодействие лекарственных средств. 7.Форматы данных по медицинским изделиям. Три уровня: Регистрационное удостоверение – GTIN - Серия лекарственного препарата. 8. Региональная система учёта лекарственных препаратов. Проблемы. 9. Использование «Базы данных VIP РЛС ®» в составе информационно-аналитической системы учета лекарственных препаратов на региональном уровне» 10. Cистема мониторинга движения лекарственных средств МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 32 Спасибо за внимание! Вопросы? Геннадий Вышковский Президент ГК РЛС Россия, Москва, 123007, ул. 5-я Магистральная, д. 12 Тел.: (495) 258-97-03, Факс: (495) 258-97-07 Моб.: 8 (985)761-16-15 E-mail: [email protected] http://www.rlsnet.ru http://www.lingvapharm.ru МОНИТОРИНГ ДВИЖЕНИЯ МЕДИЦИНСКИХ ПРОДУКТОВ. 22-23 марта 2016, Москва, Краснопресненская наб., 14, ЦВК «Экспоцентр», Слайд 33