obobshenie po kursu organisheskoy chimii
реклама

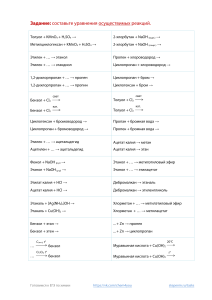
«Химия – Первое сентября», апрель, 2013 «ШИРОКО РАСПРОСТИРАЕТ ХИМИЯ РУКИ СВОИ В ДЕЛА ЧЕЛОВЕЧЕСКИЕ» М.В.ЛОМОНОСОВ ДЕВИЗ: «ТЫ НИКОГДА НЕ БУДЕШЬ ЗНАТЬ ДОСТАТОЧНО, ЕСЛИ НЕ БУДЕШЬ ЗНАТЬ БОЛЬШЕ, ЧЕМ ДОСТАТОЧНО!» К а р т о ч к а № 1. Найдите молекулярную формулу углеводорода, содержание углерода в котором составляет 80 %, а относительная плотность по водороду равна 15. К а р т о ч к а № 2. Углеводород с массовой долей углерода 0,75; водорода 0,25; с относительной плотностью по кислороду, равной 0,5, – это … К а р т о ч к а № 3. Какова молекулярная формула углеводорода, содержащего 82,75 %, углерода и 17,25 % водорода? Плотность по водороду этого вещества равна 29. К а р т о ч к а № 4. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 83,3 %. Относительная плотность паров этого вещества по водороду равна 36. 1. 2. 3. 4. С2Н6 СН4 С4Н10 С5Н12 этан метан бутан пентан Запишите номера утверждений, верных по отношению к вашему веществу. 1. этен 2. этанол 3. муравьиная кислота 4. анилин 1. 2. 3. 4. 5. 6. 7. Вступает в реакцию «серебряного зеркала». Полимеризуется. Используется в производстве красителей. Его получают спиртовым брожением глюкозы. Его получают по реакции Н.Н.Зинина. Горит. Жидкость с резким запахом, ядовита, при попадании на кожу вызывает ожоги; выделяется крапивой, некоторыми видами медуз. 8. Обладает дезинфицирующими свойствами. 9. Относится к веществам с общей формулой СnН2n. 10. С бромом вступает в реакцию галогенирования. 11. Является наркотическим веществом, вызывающим привыкание. 12. Реагирует с металлическим натрием. 13. Имеет в своем составе карбоксильную группу. 14. Является органическим основанием. 15. Бесцветный газ, без запаха, нерастворим в воде; обладает способностью ускорять созревание плодов и овощей. 16. Для его высших гомологов характерно правило Марковникова. 17. Вступает в реакцию этерификации. 18. В его состав входит аминогруппа. 1. 2. 3. 4. Этен «Да» ― 2, 6, 9, 10, 15, 16 Этанол «Да» ― 4, 6, 8, 11, 12, 17 Муравьинная кислота «Да» ― 1, 7, 8, 12, 13, 17 Анилин «Да» ― 3, 5, 6, 10, 14, 18 Напишите уравнения соответствующих реакций. № 1. № 2. № 3. № 4. КАРБОНАТ КАЛЬЦИЯ → ОКСИД КАЛЬЦИЯ → КАРБИД КАЛЬЦИЯ → АЦЕТИЛЕН → БЕНЗОЛ → НИТРОБЕНЗОЛ ЭТАНОЛ → ЭТЕН → ЭТАН → АЦЕТАЛЬДЕГИД → ХЛОРЭТАН → ЭТЕН → ЭТАН → БРОМЭТАН → ЭТАНОЛ → УКСУСНЫЙ АЛЬДЕГИД → УКСУСНАЯ КИСЛОТА → МЕТИЛАЦЕТАТ ЭТИН → УКСУСНЫЙ АЛЬДЕГИД → УКСУСНАЯ КИСЛОТА → ХЛОРУКСУСНАЯ КИСЛОТА → АМИНОУКСУСНАЯ КИСЛОТА → ПОЛИПЕПТИД → → З а д а н и е 1. В древнем Китае размоченную кору тутового дерева расщепляли на тонкие ленты и варили в растворе извести два часа. Затем полученную массу разбивали молотками, добавляли клей, заливали водой и все это откидывали на мелкое сито. Массу, осевшую в сите, опрокидывали на доску и прессовали. Как мы назовем полученное изделие? Ответ. Бумага. З а д а н и е 2. Несколько лет назад во Франции был создан «яд», в состав которого вошли, наряду со спиртом, перец, корица, кориандр, апельсиновый мед. Что это за «яд»? Ответ. Духи «Poison». З а д а н и е 3. В этом дереве человек использует все — от листьев до корней, не говоря уже об огромных плодах и масле, причем без особых затрат труда. Христианские миссионеры на Филиппинах называли его «деревом лентяев». Что это за дерево? Ответ. Кокосовая пальма. З а д а н и е 4. Баденская анилино-содовая фабрика является крупнейшей химической монополией в Германии. Какая ее продукция пользовалась у нас наибольшей популярностью? Ответ. Аудио-, видеокассеты. ДЕВИЗ: «НЕ ВСЯКОМУ ПОМОГАЕТ СЛУЧАЙ, СУДЬБА ОДАРЯЕТ ТОЛЬКО ПОДГОТОВЛЕННЫЕ УМЫ» Л. ПАСТЕР З а д а н и е 1. Ч.Гудьир для улучшения качества каучука перепробовал массу вариантов его смесей с различными веществами: песком, солью, перцем, сахаром и даже супом, пока случайно по рассеянности не положил смесь каучука с серой на горячую плиту, открыв таким образом …………… . Ответ. Cпособ вулканизации каучука в резину. З а д а н и е 2. А.Флеминг, хозяин химической лаборатории, не отличался аккуратностью. Он обнаружил, что бактерии (стафилоккоки) в забытой и заплесневевшей лабораторной чашке, которую нужно было давно выбросить в помойное ведро, погибли. Так произошло открытие ………… . Ответ. Пенициллина. З а д а н и е 3. Немецкий химик К.Фальберг после работы в лаборатории допустил неряшливость – будучи голодным, сел за стол с невымытыми руками. За обедом у него все блюда имели сладкий привкус. Заинтересовавшись этим, химик открыл вещество в 500 раз слаще сахара. Что он открыл? Ответ. Cахарин. З а д а н и е 4. Химик Э.Бенедиктус случайно выронил стеклянную колбу, загрязненную раствором коллодия, и обнаружил, что колба не разбилась. Это послужило началом к изобретению ……………. Ответ. Небьющегося стекла. ДЕВИЗ: «О, СКОЛЬКО НАМ ОТКРЫТИЙ ЧУДНЫХ ГОТОВЯТ ПРОСВЕЩЕНЬЯ ДУХ, И ОПЫТ, СЫН ОШИБОК ТРУДНЫХ, И ГЕНИЙ, ПАРАДОКСОВ ДРУГ…» А.С. ПУШКИН Сахароза С12Н22О11 в обычных условиях не горит. Если поднести к куску сахара зажженную спичку, он будет плавиться, частично обугливаться, но не гореть. Если же на кусок сахара насыпать совсем немного пепла от сигареты и снова поднести огонь, сахар загорится синевато-желтым пламенем с небольшим потрескиванием. Попробуйте проделать этот опыт и объясните, в чем причина такого поведения сахара? Ответ. Суть изменений в поведении сахара состоит в том, что зола табака, содержащая карбонаты щелочных металлов, служит катализатором горения этого вещества. Считается, что главную роль здесь играет карбонат лития Li2CO3. Сахар сгорает, превращаясь в углекислый газ и воду. Возьмите полстакана холодной кипяченой воды, всыпьте в него четверть чайной ложки пищевой соды и одну чайную ложку сахарного песка, размешайте, добавьте немного (на кончике ножа) твердой лимонной кислоты. Что наблюдаете? Какую роль выполняют компоненты исходной смеси? Какие явления (физические или химические) при этом происходят? Ответ. Пищевая сода вступает в химическую реакцию с раствором лимонной кислоты, при этом происходит выделение углекислого газа, сопровождающееся шипением. Это – процесс химический. Сахар выполняет роль подсластителя, процесс его растворения – физический. Для этого опыта возьмите ломтик картофеля и настойку йода из аптечки. Капните настойкой йода на картошку и увидите, что бурый цвет йода превратился в сине-фиолетовый. Здесь происходит химическая реакция между йодом и крахмалом, который содержится в картофеле, и получается новое вещество синефиолетового цвета. Химики используют эту реакцию для того, чтобы установить, содержится ли в том или ином пищевом продукте крахмал, а если содержится – то в каком количестве. Проведите опыт: проверьте, какие из овощей, фруктов и других пищевых продуктов содержат это полезное вещество крахмал, а какие – нет. Нанесите капельку йодной настойки на кусочек хлебного мякиша, ломтики моркови и яблока, на муку (предварительно смешанную с водой). Сделайте вывод о том, какие продукты содержат крахмал, а какие – не содержат. В пробирку помещают измельченную оболочку одной подушечки жвачки и приливают 2–3 мл дистиллированной воды. Закрывают пробирку пробкой и встряхивают в течение 1 мин. Получают мутный раствор, в который добавляют 1 мл 2 М раствора едкого натра и 2–3 капли 10%-го раствора сульфата меди(II). Встряхивают содержимое пробирки и наблюдают появление сине-фиолетового окрашивания. Ответьте, в чем причина изменения цвета? Ответ. Изменение цвета объясняется образованием комплексных соединений катионов меди(II) с многоатомными спиртами, входящими в состав оболочки жевательной резинки. В этом задании командам нужно будет установить соответствие фамилии ученого-химика и реакции, к которой он имеет какое-либо отношение. (Пояснить, что это за реакция.) Задание этого конкурса заключается в том, что каждая команда должна была выбрать какое-либо органическое вещество и подготовить его рекламу. Наибольшее количество баллов (5) получит та команда, которая укажет практическое применение данного органического вещества в быту. Для придания глянца подкрахмаленным вещам, при энергичном помешивании добавляют в горячее крахмальное молоко немного расплавленного стеарина. Жирное пятно с некрашеного пола можно удалить с помощью бензина (продукта переработки нефти). Если стекла загрязнены не сильно, их моют раствором крахмала в холодной воде. При консервировании и усилении вкусовых свойств хозяйки применяют 3–9%-й водный раствор уксусной кислоты ― уксус. Каждая команда получает карточку с текстом, в котором допущены химические ошибки (неточности). Членам команд необходимо их выявить. К а р т о ч к а № 1. Фенол получают из природного газа. Это белое кристаллическое вещество, не имеющее запаха, не ядовит. Для фенола характерна цветная реакция с хлоридом бария. Правильный ответ. Фенол получают из каменноугольной смолы. Это бесцветное кристаллическое вещество с характерным запахом, ядовит. Для фенола характерна цветная реакция с хлоридом железа(III) (фиолетовое окрашивание). К а р т о ч к а № 2. В лаборатории альдегиды получают окислением вторичных спиртов. Метаналь ― жидкость, не имеющая запаха. Реакции присоединения к альдегидам обусловлены наличием в карбоксильной группе G-связи, которая легко разрывается. Правильный ответ. В лаборатории альдегиды получают окислением первичных спиртов. Метаналь ― бесцветный газ с резким запахом. Реакции присоединения к альдегидам обусловлены наличием в карбонильной группе π-связи, которая легко разрывается. К а р т о ч к а № 3. Ученым Н.Д.Зелинским доказано, что бензол образуется из циклопентана, выделяемого из некоторых сортов нефти. Бензол ― бесцветный газ, хорошо растворимый в воде, без запаха. Бензол не стоек к окислению. Продуктом взаимодействия бензола и азотной кислоты является аминобензол. Правильный ответ. Ученым Н.Д.Зелинским доказано, что бензол образуется из циклогексана, выделяемого из некоторых сортов нефти. Бензол ― бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Бензол очень стоек к окислению. Продуктом взаимодействия бензола и азотной кислоты является нитробензол. К а р т о ч к а № 4. Общая формула ацетиленовых углеводородов СnН2n. В молекуле ацетилена одна двойная связь. Ацетилен ― газ, тяжелее воздуха. Хорошо растворим в воде. Ацетилен не обесцвечивает раствор перманганата калия. Ацетилен широко применяют в органическом синтезе. Правильный ответ. Общая формула ацетиленовых углеводородов СnН2n–2. В молекуле ацетилена одна тройная связь. Ацетилен ― газ, легче воздуха, мало растворим в воде. Ацетилен обесцвечивает раствор перманганата калия. Ацетилен широко применяют в органическом синтезе. СПАСИБО ЗА РАБОТУ НА УРОКЕ !