Урок по теме "Углерод"
реклама

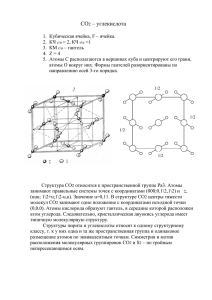
Углерод и его соединения Углерод (лат. Carboneum, от cаrbo — уголь) Аллотропные модификации Алмаз Графит Карбин Фуллерен Алмаз «Горняк». Добытый в Якутии. Проявляет восстановительные свойства: Горит в кислороде: C + O2 = CO2 + Q Неполное сгорание: 2С + О2 = 2СО + Q Взаимодействует с оксидом углерода (IV): С + СО2 = 2СО Восстанавливает металлы из них оксидов: С + 2CuO = CO2 + 2Cu Получение Неполное сжигание метана: CH4 + O2 = C + 2H2O Оксид углерода СО2 СО2 – газ без запаха, цвета и вкуса, тяжелее воздуха примерно в полтора раза. При обычных условиях в 1 объеме воды растворяется 1 объем углекислого газа. Плотность 1,25 г/л, tкип -191,5 °С. Образуется при неполном сгорании углерода или его соединений (в печах, двигателях внутреннего сгорания). На воздухе горит синим пламенем. В промышленности получают газификацией топлив, при конверсии газов. Сырье основного органического синтеза, высококалорийное топливо. Углерода оксид ядовит. СО2 при растворении взаимодействует с водой: СО2 + H2O H2CO3 Реагирует с основаниями (известковая вода при его пропускании мутнеет): СО2+ Са ( ОН )2= СаСО3 + Н2О Реагирует с основными оксидами: СО2 + СаО = СаСО3 Образуется в реакциях: горения углерода в кислороде С + О2= СО2 окисления оксида углерода (II) 2СО + О2 = 2СО2 сгорания метана СН4+ 2О2 = СО2+ 2Н2О взаимодействия кислот с карбонатами СаСО3+2НСl = CaCl2 + CO2 + H2O термического разложения карбонатов и гидрокарбонатов СаСО3 = СаО + СО2 NaHCO3 = Na2CO3 + CO2 + H2O окислительных биохимических процессов дыхания, гниения Угольная кислота Н2СО3 Н2СО3 – Непрочная молекула. Слабая двухосновная кислота. Образуется при растворении диоксида углерода в воде. Дает соли — карбонаты и гидрокарбонаты. Равновесия в водном растворе: CO2+ H2O H2CO3 H ++ HCO3 - 2H + + CO32- Взаимодействия Взаимодействует с растворами щелочей как раствор углекислого газа в воде с образованием кислых (гидрокарбонатов) и средних (карбонатов) солей: СО2+ NaOH = NaHCO3 CO2 + 2NaOH = Na2CO3 + H2O Вытесняются из солей более сильными кислотами: СаСО3 + 2НCl = CaCl 2 + CO2 + H2O Соли угольной кислоты подвергаются гидролизу: 2Na + + CO32- + H2O 2Na ++ HCO3 - + OH CO32- + H2O HCO3 - + OH - Оглавление Углерод и его соединения Углерод Аллотропные модификации Слайд 4 Получение Оксид углерода СО2 Слайд 7 Слайд 8 Образуется в реакциях: Слайд 10 Угольная кислота Н2СО3 Слайд 12 Взаимодействия Слайд 14 Слайд 15 Оглавление