Гликогенолиз. Ферменты гликолиза. Хусаинов Искандер Казань, КГУ, 2010
реклама

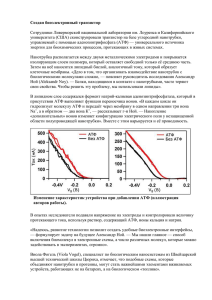
Гликогенолиз. Ферменты гликолиза. Хусаинов Искандер Казань, КГУ, 2010 CH 2OH CH 2OH O H H OH H H OH H O OH CH 2OH H H H H O OH H H OH H H OH CH2OH O H OH O H OH O H OH H H H H O OH 4 Гликоген H 1 O 6 CH2 5 H OH 3 H CH2OH O H 2 OH O H H H 4 OH 1 CH 2OH O H H O O H H OH H OH H H OH H OH Гликоген – полимер из остатков глюкозы, соединенных a(14) гликозидной связью в линейных областях a(16) гликозидной связью в областях ветвления Глюкоза запасается в виде гликогена преимущественно в клетках печени и мышц. www.wikipedia.ru Гликогенолиз – Процесс расщепления гликогена до глюкозы, направленный на поддержание постоянной концентрации глюкозы в крови Гликоген фосфорилиза • Расщепление α(14) • Гликоген фосфорилаза гликозидных связей • Расщепление последних трех α(14) • Глюкозидаза и одной α(16) гликозидной связи • Превращение глокозо1-фосфата в глюкозо-6- • Фосфоглюкомутаза фосфат ΔG0’ = +0.73 ккал/моль Ленинджер, Основы биохимии, «МИР» 1985 Гликоген фосфорилаза (EC 2.4.1.1) – гомодимерный фермент, переход между активной и неактивной формами которого регулируется аллостерическим путем. • • • • ПРФ Коферменты: Пиродоксаль фосфат GlcNAc Активаторы: Адреналин Ингибиторы: Хлороиндол-карбоксамид (аллостерический) N-ацетилглюкозамином (конкурентный) GlcNAc Хлороиндол карбоксамид ПРФ Joyce J. Diwan 1999-2007 Фн встраивается между фосфатной группой пиридоксаль фосфата и кислородом, формирующим гликозидную связь терминального остатка глюкозы. Enz лизин ( CH2 )4 H H 3N - + C CH2 CH2 CH2 CH2 + NH3 N+ COO O- -O P O HC H2 C H O - O + N H CH3 Связи, удерживающие ПРФ в молекуле фермента Joyce J. Diwan 1999-2007 ПРФ удерживается в активном центре связями, образованными реакцией между альдегидом ПРФ и e-амино группой лизина Гликоген(n) Гликоген(n-1) (~Ф) Фн Глюкоза ПРФ Г-1-Ф Н+ Н+ Неорганический фосфор отдает протон в процессе расщепления терминальной α(14) гликозидной связи. Зетем получает протон от фосфатной группировки ПРФ. ПРФ возвращает себе протон после присоединения фосфатной группы к С1 атому глюкозы. Enzyme-Ser-OPO32 - CH2OH H O H OH H OH H H Глюкозо-1-фосфат Joyce J. Diwan 1999-2007 H - OPO32 OH Enzyme-Ser-OPO32 Enzyme-Ser-OH CH2OPO32 O H H OH - OH H H H - OPO32 OH CH2OPO32 O H H OH - H OH OH H Глюкозо-1,6-дифосфат - OH Глюкозо-6-фосфат ΔG0’ = –1.74 ккал/моль Фосфоглюкомутаза (ФГМ) катализирует обратимую реакцию превращения глюкозо-1-фосфата в глюкозо-6фосфат. ОН-группа серина в активном центре фермента отдает и принимает фосфатную группу Кофермент: Глюкозо-1,6-дифосфат ФГМ способен к взаимопревращению активной и неактивной форм Мышечный гликоген – регулируется с помощью АМФ, АТФ и глюкозо-6-фосфата. АМФ активирует фосфорилазу, способствуя формированию активной конформации АТФ и глюкоза-6-фосфат, ингибируют фосфорилазу, способствуя формированию неактивной конформации Гормоны глюкагон и эпинефрин активируют G-белокассоциированные рецепторы и запускают цАМФ каскад Оба гормона секретируются в ответ на низкое содержание глюкозы в крови Глюкагон, который синтезируется a-клетками поджелудочной железы, активирует образование цАМФ в печени Эпинефрин активирует образование цАМФ в мышцах Сигнальный каскад реакций активации гликоген фосфорилазы Гормон (эпинефрин или глюкагон) G-белок (Gα-ГТФ) Аденилат циклаза (неактивный) Аденилат циклаза (активная) катализ АТФ цАМФ + ФФн Активация Фосфодиэстераза АМФ Протеин киназа А (неактивная) Протеин киназа A (активная) АТФ АДФ Киназа фосфорилазы (b-неактивная) Phosphatase Киназа фосфорилазы (Ф) (а-активная) АТФ Фн АДФ Фосфорилаза (b-аллостерич.) Фосфорилаза ( P) (a-активная) Фосфатаза Фн Joyce J. Diwan 1999-2007 Гликоген (C6H10O6)n (C6H10O6)n-1 (16)Глюкозидаза (14)Гликоген фосфорилаза H3PO4 Глюкозо-1-фосфат Фосфотаза фосфорилазы ГФ a (актив.) АТФ Киназа фосфорилазы АМФ ГФ b (неактив.) адреналин Кофермент: пиридоксаль фосфат Фосфоглюкомутаза Активная Неактивная Кофермент: глюкозо-1,6-дифосфат Глюкозо-6-фосфат Гликолиз Глюкозо-6-фосфатаза Гексокиназа Глюкоза Кровь Печен ь Глюкоза АТФ Гексокиназа АДФ Глюкозо-6-фосфат Гликолиз Фосфоглюкоизомераза Фруктозо-6-фосфат АТФ Фосфофруктокиназа АДФ Фруктозо-1,6-дифосфат Альдолаза Глицеральдегид-3-фосфат + Дигидроксиацетон-3-фосфат Триозофосфат изомераза Joyce J. Diwan 1999-2007 Глицеральдегид-3-фосфат + NAD + Фн Глицеральдегид-3-фосфат + дегидрогеназа NADH + H 1,3-дифосфоглицерат АДФ Фосфоглицерат киназа АТФ 3-фосфоглицерат Фосфоглицерат мутаза 2-фосфоглицерат Енолаза H2 O фосфоенолпируват АДФ Пируват киназа АТФ Пируват Joyce J. Diwan 1999-2007 Функция: обеспечение захвата глюкозы (даже при низких концентрациях ее в крови) поддержание градиента концентрации глюкозы между кровью и внутриклеточной средой Субстраты: Гексозы (но высокая специфичность специфична к глюкозе) 6 C H2OH 5 H 4 Ингибитор: Глюкозо-6-фосфат OH H OH 3 H 6 C H OPO 2- АТФАДФ O H H 1 2 OH OH 5 H 4 Mg 2+ OH Гексокиназа Глюкоза Донор фосфата: ATP в виде комплекса Mg-ATP www.pdb.org 2 3 O H OH 3 H H 2 H 1 OH OH Глюкоза-6-фосфат Индуцированное соответствие Присоединие глюкозы к гексокиназе стабилизирует конформацию, в которой: глюкоза С6 гидроксил глюкозы расположен близко к концевой фосфатной группе АТФ, что способствует катализу. Гексокиназа Вода вытеснена из активного центра, что предотвращает гидролиз АТФ www.pdb.org • Механизм действия фермента основан на кислотно-основном катализе в котором последовательно происходит открытия кольца, изомеризации через интермедиат, и закрытия кольца. 6 CH OPO 22 3 5 O H 4 OH H OH 3 H H 2 OH H 1 OH 6 CH OPO 22 3 1CH2OH O 5 H H 4 OH HO 2 3 OH H Phosphoglucose Isomerase glucose-6-phosphate fructose-6-phosphate www.pdb.org Это тетрамерный фермент, существующий поочерёдно в двух конформационных состояниях (R – relax, активная и T – tense, неактивная) Субстраты: АТФ (связывается в T-конформации). Для связывания с АТФ фермент имеет по 2 центра связывания в каждой субъединице: субстратный сайт и сайт ингибирования Фруктозо-6-фосфат (связывается в R-конформации) Phosphofructokinase 6 CH OPO 22 3 O 5 H H 4 OH 6 CH OPO 22 3 1CH2OH O ATP ADP HO 2 3 OH H fructose-6-phosphate 5 Mg2+ 1CH2OPO32- H H 4 OH HO 2 3 OH H fructose-1,6-bisphosphate www.pdb.org Функции: играет главную роль в регуляции скорости гликолиза Отрицательный модулятор: АТФ Положительные модуляторы: АМФ, Глюкозо-2,6-дифосфат ФФК-2/Ф-2,6-дФ (фосфофруктокиназа-2 или фруктозо-2,6-дифосфатаза): www.pdb.org Регулирует активность ФФК Помимо гликолиза, регулирует процессы гликонеогенеза и глюкогенолиза Остаток лизина в активном центре фермента взаимодействует с кетогруппой фруктозо-1,6 дифосфата. Через стадию образования интермедиата происходит разрыв связи между С3 и С4 атомами Ф-1,6-дФ 1CH2OPO3 lysine H H3N+ C CH2 COO- 2C O HO 3C H 4C H H 5 C H Aldolase OH 6CH2OPO3 fructose-1,6bisphosphate CH2 CH2 NH3 www.pdb.org CH2OPO323 2C OH CH2 + 2- O + 1CH2OH 2- dihydroxyacetone phosphate O 1C H 2C OH 23 CH2OPO3 glyceraldehyde-3phosphate Triosephosphate Isomerase Функция: Изомеризация триозофосфатных соединений Особенности структуры: αβ полость, 8 параллельных β-структур внутри и 8 α-спиралей снаружи. Сустраты: Фосфорилированные триозы Ингибитор: 2-фосфогликолат 1CH2OPO3 2C HO 3C H 4C H 5 C 2- O H H Aldolase OH fructose-1,6bisphosphate CH2OPO3 2C OH 6CH2OPO3 3 O 2- + 1CH2OH 2- dihydroxyacetone phosphate O 1C H 2C OH 23 CH2OPO3 glyceraldehyde-3phosphate Triosephosphate Isomerase www.pdb.org Glyceraldehyde-3-phosphate Dehydrogenase H • Фермент состоит из четырех идентичных полипептидов, образующих тетрамер. Каждый полипептид содержит по четыре SH-группы, принадлежащие остаткам цистеина O NAD 1C H 2 C OH 3 CH2OPO3 + Pi OPO32+ H+ O NADH 1C H 2- glyceraldehyde3-phosphate Цистеин тиол в активном центре фермента реагирует с альдегидной группой глицеральдегид-3-фосфата с образованием интермедиата хемиацеталя www.pdb.org + C 2 OH 3 CH2OPO3 2- 1,3-bisphosphoglycerate H H3N+ C COO- CH2 SH cysteine Enz-Cys O SH OH HC Enz-Cys S CH OH OH CH CH CH2OPO3 glyceraldehyde-3phosphate CH2OPO32- thiohemiacetal intermediate NAD + NADH Enz-Cys S O OH C CH CH2OPO32- acyl-thioester intermediate Pi Enz-Cys 2- SH 2- O3PO O OH C CH CH2OPO32- 1,3-bisphosphoglycerate Joyce J. Diwan 1999-2007 Окисление до карбоновой кислоты вызывает восстановление NAD+ до NADH Фосфоглицераткиназа EC 2.7.2.3 Phosphoglycerate Kinase O- OPO32- ADP ATP O O 1C H 2C OH 23 CH2OPO3 C 1 Mg2+ 1,3-bisphosphoglycerate H 2C OH 23 CH2OPO3 3-phosphoglycerate • Работает по механизму индуцированного соответствия, подобно гексокиназе www.pdb.org histidine H H3N+ COO- C Гистидиновые остатки в активном центре фермента участвуют в транспорте неорганического фосфата путем отдачи и присоединения фосфата. Интермедиатом данного процесса является 2,3-дифосфат. CH2 C HN CH HC NH + Phosphoglycerate Mutase O- O C 1 O- O C 1 H 2C OH 23 CH2OPO3 H 2C OPO323 CH2OH 3-phosphoglycerate 2-phosphoglycerate O- O C 1 H 2C OPO3223 CH2OPO3 2,3-bisphosphoglycerate www.pdb.org • Енолаза ингибируется ионами фторида • Нуждается в ионах Mg2+ или Mn2+. Ионы магния способствуют стабилизации енолат-аниона интермедиата реакции Enolase O- O C 1 H 2 C OPO323 CH2OH H+ - O- O C C OH- O- O 1 OPO32- CH2OH C 2C OPO32- 3 CH2 2-phosphoglycerate enolate intermediate phosphoenolpyruvate www.pdb.org Pyruvate Kinase • Печёночная пируваткиназа – Регуляция: O O - C 1 C 2 ADP ATP O- O C 1 OPO32- 3 CH2 • 1. изменение экспрессии генов phosphoenolpyruvate • 2. фосфорилирование / дефосфорилирование • 3. аллостерические регуляторы: C 2 O 3 CH3 pyruvate Ингибиторы: АТФ, Ацетил-КоА Активатор: фруктозо-1,6-дифосфат • М-тип пируваткиназы • Мышечная пируваткиназа www.pdb.org Глюкоза АТФ Гексокиназа АДФ Глюкозо-6-фосфат Гликолиз Фосфоглюкоизомераза Фруктозо-6-фосфат АТФ Фосфофруктокиназа АДФ Фруктозо-1,6-дифосфат Альдолаза Глицеральдегид-3-фосфат + Дигидроксиацетон-3-фосфат Триозофосфат изомераза Joyce J. Diwan 1999-2007 Глицеральдегид-3-фосфат + NAD + Фн Глицеральдегид-3-фосфат + дегидрогеназа NADH + H 1,3-дифосфоглицерат АДФ Фосфоглицерат киназа АТФ 3-фосфоглицерат Фосфоглицерат мутаза 2-фосфоглицерат Енолаза H2 O фосфоенолпируват АДФ Пируват киназа АТФ Пируват Joyce J. Diwan 1999-2007