Твёрдые вещества
advertisement

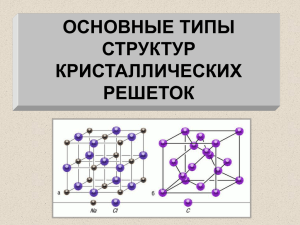
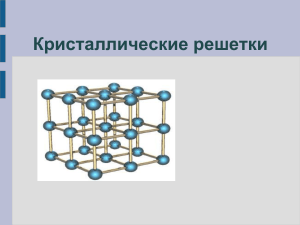
Твёрдые вещества Учитель химии высшей категории МОУ «СОШ п.Учебный Ершовского района Саратовской области» Пятахина Антонина Константиновна Рассказать о воде, о жидких кристаллах. Решите задачу Вычислите объём 108 кг водяных паров (при н.у.). Решение: n(H2O)= m/M = 108кг: 18 кг/кмоль = = 6 кмоль; V(H2O) = n x Vm = = 6кмоль x 22,4 м3 /кмоль= = 136.4 м3; Ответ: V(H2O) = 136.4 м3; Тема урока: Твёрдые вещества. Цель урока: Познакомиться с кристаллическими и аморфными веществами. Точки, в которых расположены частицы вещества, называют узлами кристаллической решетки Некоторые металлические конструкции не случайно напоминают кристаллические решетки В зависимости от того, какие частицы расположены в узлах, различают несколько типов кристаллических решеток: ионные, металлические, атомные, молекулярные. Твёрдые вещества по строению и свойствам подразделяют на Кристаллические и Аморфные Атомы, молекулы или ионы твёрдых веществ занимают строго определённое место в пространстве. Если соединить точки, в которых находятся частицы твёрдого вещества, вооброжаемыми линиями, то получается правильная пространственная решётка, называемая кристаллической. Песок под ногами – это кристаллики оксида кремния Природа достигла необыкновенного мастерства в выращивании кристаллов самой разнообразной формы и размеров. Они могут походить на пластинки или кубики, иголки или звездочки, могут быть громадными глыбами или неразличимыми даже под микроскопом. Кварц 4 типа кристаллических решёток: Ионные Атомные Молекулярные Металлические Вещества с ионным типом связи состоят из катионов и анионов Кристаллическая решётка хлорида натрия NaCl Силы взаимного притяжения ионов достаточно велики, поэтому все вещества с ионным типом кристаллической решетки при обычных условиях имеют твердое агрегатное состояние, высокую температуру плавления, нелетучи, лишены запаха. Некоторые вещества с ионным типом связи хорошо растворимы в воде (гидроксиды щелочных и щелочноземельных металлов, соли). Вещества с металлическим типом связи – это металлы и сплавы. В узлах кристаллической решетки таких веществ расположены атомы и положительно заряженные ионы металлов, поэтому соответствующий тип кристаллической решетки так и называется – металлическая. В пространстве между этими частицами по взаимно перекрывающимся свободным орбиталям перемещаются электроны, потерявшие связь со своими атомами. Они то и скрепляют кристаллическую решетку, не позволяя ей распадаться на отдельные частицы Кристаллическая решётка меди Для твердых веществ с ковалентными химическими связями характерны два типа кристаллических решеток. Если в узлах кристаллической решетки вещества расположены отдельные атомы, тип решетки так и называется – атомная. Атомная кристаллическая решетка характерна для некоторых простых веществ, например, модификаций бора, кремния, углерода. Кристаллическая решётка алмаза атомная Графит (атомная) аллотропия В узлах кристаллических решеток веществ молекулярного строения находятся, соответственно, молекулы вещества. Кристаллическая решетка такого типа называется молекулярной.Молекулярную кристаллическую решетку имеют вода, большинство органических веществ, кристаллический иод Молекулярная кристаллическая решётка йода I2 Все кристаллы обладают одним общим свойством. Если такое вещество нагревать, колебания частиц в узлах кристаллической решетки становятся все более и более сильными, и, наконец, при определенной температуре кристалл разрушается – твердое вещество расплавляется и превращается в жидкость. Следовательно, любое кристаллическое вещество, которое может быть переведено в жидкое состояние, имеет собственную температуру (или точку) плавления. Вторая разновидность твердых веществ – аморфные вещества – таким свойством не обладают. В аморфном веществе расположение составляющих его частиц, как и в жидкостях, неупорядочено. Даже обозначающий их термин выбран очень удачно: по-гречески «аморфус» означает бесформенный. И все-таки твердые аморфные вещества настолько вязки, что почти полностью теряют текучесть и сохраняют свою форму, как твердые тела. К таким веществам относятся янтарь , стекло, парафин, многие пластмассы, некоторые минералы. Кусочек природного янтаря Если аморфное вещество нагревать, то оно постепенно размягчается, становится все более текучим, пока не превратится в типичную жидкость. Отсутствие четкой температуры плавления у таких веществ как бы свидетельствует о том, что резкой границы между ними и жидкостями нет. Несмотря на то, что мы условно разделили твердые вещества на аморфные и кристаллические, эти два состояния могут сосуществовать одновременно в одном и том же веществе. Многие полимеры, представляя в целом аморфные вещества, вместе с тем, обладают участками кристаллической структуры. Этим определяется, например, высокая прочность полипропиленового или капронового волокон. В русской речи слово «аморфный» имеет некоторый негативный оттенок. Однако применительно к химическим веществам и материалам это не так. Именно аморфные вещества дарят нам теплый свет янтаря, скромное обаяние полудрагоценных опала и халцедона, буйство красок витражей и мозаики, изумительную игру хрустального блеска. Мы узнали: Твёрдые вещества бывают кристаллическими и аморфными. Кристаллические вещества характеризуются кристаллическими решетками четырех типов: ионными, металлическими, атомными и молекулярными. Физические свойства вещества определяются типом кристаллической решетки. Один химический элемент может образовать несколько простых веществ – аллотропных модификаций. Какие виды химической связи в: NaOH Na2SO4 NH4NO3 Na2O2 Li2 (при испарении металла) Задание на дом: Повторить виды химической связи Выучить типы кристаллических решёток Подготовить сообщение о янтаре или кварце, решить задачу №7 на стр.190