ФИЗИКА Модуль 2 Молекулярная физика и термодинамика Федеральное агентство по образованию
advertisement

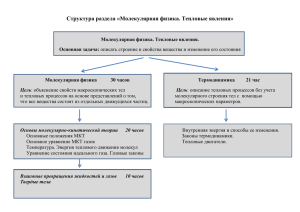
Федеральное агентство по образованию УГТУ-УПИ ФИЗИКА Модуль 2 Молекулярная физика и термодинамика Понятие энтропии Лекция Лекционная презентация Ф.А. Сидоренко Научный редактор – профессор, доктор физико-математических наук А.А.Повзнер Екатеринбург 2007 Цель • Рассмотреть закономерности самопроизвольных направленных процессов. Для описания этих закономерностей ввести понятия термодинамической вероятности и энтропии • Выяснить свойства этих величин и научиться рассчитывать изменение энтропии в различных процессах 2 Физика. Модуль 2– Молекулярная физика и термодинамика План (на две лекции) • Направленность самопроизвольных процессов. Необходимость физического описания этого явления • Термодинамическая вероятность и её свойства • Энтропия и её свойства • Связь изменения энтропии с количеством подведенной теплоты. Расчет изменения энтропии в простейших процессах • Второе начало термодинамики • Энтропия и информация • КПД идеальной тепловой машины 3 Физика. Модуль 2– Молекулярная физика и термодинамика Примеры некоторых самопроизвольных процессов. Направленность этих процессов Расширение газа в пустоту Самопроизвольно! Газ самопроизвольно расширяется в пустоту. Второе состояние «предпочтительней» первого Исходный рисунок по http://fizmir.org/bestsoft/3_12.htm 4 Физика. Модуль 2– Молекулярная физика и термодинамика Примеры некоторых самопроизвольных процессов. Направленность этих процессов Расширение газа в пустоту Газ самопроизвольно расширяется в пустоту. Второе состояние «предпочтительней» первого Вращение воды в стакане В любых системах осуществляется самопроизвольный переход упорядоченного движения в хаотическое движение молекул Направленность самопроизвольных процессов от упорядочения частиц по координатам и импульсам к хаотическому распределению – физический закон. Это свойство макроскопических систем можно выразить с помощью физических величин 5 Физика. Модуль 2– Молекулярная физика и термодинамика Термодинамическая вероятность Рассмотрим модель системы, состоящей из двух ячеек Каждая ячейка соответствует каким-то местам в координатном пространстве или в пространстве импульсов Поместим в эту систему четыре частицы и рассмотрим все возможные расположения частиц. Результаты сведём в таблицу 6 Физика. Модуль 2– Молекулярная физика и термодинамика Термодинамическая вероятность и её свойства № Макросостояние Термод. вероятн. Возможные микросостояния W 12 34 1 1 2 3 12 4 1 5 34 1 2 31 24 2 3 32 14 3 4 14 32 4 12 34 4 .... 6 4 1 7 Физика. Модуль 2– Молекулярная физика и термодинамика Термодинамическая вероятность и её свойства • Макросостояние (макрораспределение) – распределение частиц по ячейкам фазового пространства без учета номеров частиц • Микросостояние (микрораспределение) – распределение частиц по ячейкам с учетом их номеров • Термодинамическая вероятность W макросостояния – число микросостояний, соответствующих этому макросостоянию Число микросостояний для распределений N частиц по двум ячейкам N! W ( N n)! n! Число частиц в одной из двух ячеек Физика. Модуль 2– Молекулярная физика и термодинамика 8 Свойства термодинамической вероятности • Термодинамическая вероятность некоторого макросостояния – свойство системы в этом состоянии. То есть задано состояние – задана и термодинамическая вероятность • При самопроизвольных процессах система переходит от макросостояний с меньшей термодинамической вероятностью к состояниям с большей вероятностью. (Это одна из формулировок II начала) • Термодинамическая вероятность – величина мультипликативная W W1 W2 ... WZ – следует из теоремы об умножении вероятностей Физика предпочитает работать с аддитивными, а не мультипликативными величинами 9 Физика. Модуль 2– Молекулярная физика и термодинамика Энтропия Определим: S k ln W Свойства энтропии: • Энтропия некоторого макросостояния – свойство системы в этом состоянии. Изменение энтропии S не зависит от формы пути перехода из одного состояния в другое • При самопроизвольных процессах система переходит от макросостояний с меньшей энтропией к состояниям с большей энтропией. (Это ещё одна формулировка II начала) • Энтропия – величина аддитивная S = S1+S2+S3+… 10 Физика. Модуль 2– Молекулярная физика и термодинамика Связь изменения энтропии с количеством подведенной теплоты. V Дано V1 V2 T = const Q Определить S – ? S S 2 S1 k (ln W2 ln W1 ) k ln V1 Для N частиц: W1 c V V S k ln 2 V1 N V kN ln 2 V1 N V2 W2 c V W2 W1 N V2 R ln . V1 Для равновесного изотермического процесса Q S . T 11 Физика. Модуль 2– Молекулярная физика и термодинамика Интеграл приведенных теплот Обобщим полученное соотношение на произвольный равновесный процесс Для малого изменения: dS Q T , ( 2) Для конечного изменения: S (1) dS T2 Q T. T1 Интеграл приведенных теплот 12 Физика. Модуль 2– Молекулярная физика и термодинамика Случай неравновесного процесса При неравновесном процессе работа и подводимое количество теплоты меньше, чем при таком же изменении в равновесных условиях dS Q T T2 S Q T T1 Изменение энтропии при переходе из одного состояния в другое не зависит от степени равновесности процесса, а подводимая теплота и совершаемая работа существенно зависят от характера процесса. Вспомним пример: Здесь AQ0 S 0 13 Физика. Модуль 2– Молекулярная физика и термодинамика Расчет изменения энтропии в равновесных изопроцессах Q S . T Т = const V = const S CV ln T2 T1 T2 S C ln Для случая p = const p T1 CV= const Q0 Для газа V2 S R ln V1 Для газа p2 S CV ln p1 V2 Для газа S C p ln V1 S 0 Для случая Cp= const 14 Физика. Модуль 2– Молекулярная физика и термодинамика Энтропия и информация Исходное состояние системы: 0/1 0/1 0/1 0/1 S инф log 2 pi i Информационная энтропия рассматриваемой системы 0/1 0/1 0/1 0/1 Sинф(1) 8 Вероятность обнаружить ноль в ячейке i 15 Физика. Модуль 2– Молекулярная физика и термодинамика Энтропия и информация Состояние системы после получения информации: 1 0/1 0/1 1 0 0/1 0/1 S инф log 2 pi Sинф(1) 8 Количество информации: Sинф( 2) 5 i J Sинф(1) Sинф(2) 0/1 - Получено 3 бита информации binary digit = бит 16 Итоги • В отсутствие внешних воздействий система стремиться к максимально возможному беспорядку в распределении частиц по координатам и импульсам • Удобной величиной для описания беспорядочности в системе является энтропия • «Количество информации» определяется через понятие информационной энтропии 17 Физика. Модуль 2– Молекулярная физика и термодинамика