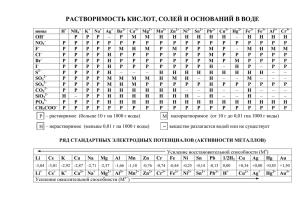
Дополнительные материалы для детализации разделов 1
реклама

Дополнительные материалы для
детализации разделов
1
Стандартизация р-ров Hg(NO3)2:
аликвота р-ра + NaOH (неб. изб) Hg2+ + 2 OH– = HgOs + H2O
отмыв. осадок HgO до нейтр. р-ии, затем доб. изб. KI:
HgO + 4 I– + H2O = HgI42– + 2 OH–
OH– оттитр. сильной кислотой с индик.
Кислород- и серосодержащие лиганды
1) H2O2 : Ti4+, Zr4+, Hf4+, Th4+, Nb, Ta
обычно в сильно кислых средах, чтобы предотвратить гидролиз.
Например, (Ti + Mg): Ti = 4.5, Mg = 1.7
TiO2 + K2S2O7 = TiO(SO4) + K2SO4 (вместо K2S2O7 можно KHSO4)
TiO(SO4) + SO42- + H2O2 = TiO(SO4)2 (H2O2)2- (желтый)
2
2) OH–, CO32–
OH– — редко из-за гидроксидов
Осложнения при расчетах из-за полимеризации:
2CrOH2+ = Cr2(OH)24+ - оляция, мостиковый OH-, для Cr3+ особенности
CO32–: UO22+ + i CO32– = UO2(CO3)i2–2i, lg 1 = 15
3) S2O32–
при окислении: 2 S2O32– - 2 e = S4O62–
Mz+
Ag+
Cu+
Hg2+
Zn2+
Cd2+
Co2+
lg 1
8.9
10.4
30 (2)
2.3
3.9
2.0
3
1)фотография:
AgX + осв. + red = Ag*, X = Cl, Br, I
AgXs + i S2O32– = Ag(S2O3)i1–2i + X– - на регенерацию Ag
2) заменитель цианида
4) S2–: HS–
Например, в природе Au(HS)2–, массоперенос металлов. Лигандов мало,
факторов много.
SCN– — чаще в экстракции, например, при очистке РЗЭ3+ в виде Н[M(SCN)4]
Sc3+ + 4 SCN- + H+ + n S = {(H nS)+[Sc(SCN)4]-}org
S – эфиры, кетоны
4
SO32-, восстановитель, лиганд
источники - Na2SO3, K2SO3, SO2 газ или водн., очень дешев
Практически небалластный, восст. благ. мет.
2 H+ + SO32– = HSO3– + H+ = H2SO3 (или SO2 + H2O), lg KH1 = 6, lg KH2 = 2
H2SO3 – есть спектр в ближнем УФ
SO32– + 2OH– - 2 e = SO42– + H2O, Eo = -0.96 В.
SO32– + H2O - 2 e = SO42– + 2 H+, Eo = -0.12 В.
а) основа реактива Фишера: SO2 + I2 + осн. (напр., пиридин)
SO2 + I2 + 2 H2O = 2 I– + SO42– + 4 H+, титруют до желто-кор. окраш.
Есть электрохимические варианты. Чувствительность до 0.005 М по воде.
Не работает в прис. окислителей
б) лиганд для класса Б:
например, Ag+ + i SO32– = Ag(SO3)21-2i, lg 1 = 7.0
5
в) восстановитель для благородных металлов (кислая среда)
AuCl4- + 3/2 SO32- + 3/2 H2O = Au0 + 3/2 SO42- + 3H+ + 4 ClАзот- и фосфорсодержащие лиганды
1) CN– (через N или C)
устойчивые к-сы почти со всеми Ме, кроме щелочных и щелочноземельных.
Например, при определении Ca2+, Mg2+
H+ + CN– = HCN, lg KH = 9.3
Mz+
Fe3+
Fe2+
Ni2+
Ag+
Cd2+
Cu+
Hg2+
Zn2+
lg n
43
37
31
20
17
24
33
11
N
6
6
4
2
4
2
2
2
(lg n) / n
7
6
8
10
9
12
17
6
6
координация через N или С (Au, Ag)
металлические покрытия:
Ni(CN)42- + 2 e = Ni0 + 4 CNAu(CN)2- + e = Au0 + 2 CNAg(CN)2- + e = Ag0 + 2 CNэлектрохимия …
в гидрометаллургии:
выщелачивание
Ag0 + 2 CN– + ¼ O2 + ½ H2O = Ag(CN)2– + OH–, затем
2 Ag(CN)2– + Zn0 = Zn(CN)42– + 2 Ag0 или другим способом.
Обеззараживание:
Окисление
2 CN– - 2 e = (CN)2 и далее…
KMnO4, H2O2 и др.
7
2) NH3, N2H4, NH2OH
NH3 + H+ = NH4+, lg KH = 9.25
NH2 –CH2-COO– + H+ = NH3+-CH2-COO–, lg KH = 9.77
Ag+ + NH3 = AgNH3+, lg K1 = 3.0
соли, например, N2H4 2 HCl, N2H4 H2SO4
устойчивость комплексов низкая (lg K1 = 1—2)
небалластные восстановители:
N2H4 – 4 e = N2 + 4 H+
NH2OH – e = ½ N2 + H2O + H+
8
3) PO43–
высокозаряженные ионы (в осн. класс А)
Осадки, в комплексах чаще HPO42–:
Fe3+ - lg 1 = 21 – маскирование железа(III) в кислой среде
Cu2+ - lg 1 = 15
про фосфорную кислоту …- много форм
P2O74– - пирофосфат, осаждает Mg2+, Cu2+
лиганд для Fe3+, Mn3+
Полифосфаты
трифосфат (ТМФ):
Na5P3O10 6 H2O – растворимые комплексы с Ca2+, Mg2+
циклические, цепочечные
(NaPO3)n m H2O
ГМФ(Н), калгон
(NaPO3)6
рано или поздно гидролизуются до PO43–
Анализ на фосфаты аналогичен анализу на кремний – через образование
окрашенного гетерополикомплекса с MoO42-
9
Органические лиганды
Азот- и серосодержащие
1) амины (алифатические, полиамины (en, dien))
NH2R, NHR2, NR3, H2N-R-NH2, NH2-R-NH-R-NH2
амидоформы M(en)(en-H)
2) аминокислоты NH2-R-COOH или NH3+-R-COOа) буферы
б) комплексообразователи, хелат-эффект
в) биологическая роль
10
11
3) комплексоны
а) ЭДТА
Na2H2EDTA 5.5 H2O
Mz+
Ag+
Hg2+
Zn2+
La3+
lg 1
7.8
21
16.5
16.0
Mz+ + EDTA4– = MEDTAz-4,
* = L M
M = [Mz+] / CM = 1 / ФM
L = [L] / CL = 1 / ФL
EDTA4– + i H+ = HiEDTAi-4, iH, растворимость, индукция
i
1
2
3
4
lg iH
10.3
16.4
19.1
21
12
1) EDTA4– - этилендиаминтетраацетат (ЭДТА)
2) NTA3– - нитрилотриацетат (НТА)
3) IDA2– - иминодиацетат (ИДА)
4) DCHTA4– - 1,2 диамин циклогексан
тетраацетат (ДЦГТА или ДЦТА)
5) TEA – триэтаноламин
(2,2’,2’’нитрилотриэтанол, ТЭА)
4) константы выше на 1—3 лог. ед. по ср. с ЭДТА (Zn2+: lg 1 = 18.7 против 16.5)
5) полностью () растворим в воде. Дает устойчивые комплексы со всеми ионами,
кроме щелочных и щелочноземельных, хотя чаще всего для M3+. Часто используется
13
для маскировки при определении Ca2+, Mg2+.
Тиомочевина (thiourea, tu)
класс Б: Ag+, Hg2+, Cu+…
pH < 7
Ag+ + i tu = Ag tui+, lg 1 = 6.5,
Но!
2 Ag+ + 3 tu = Ag2tu32+, lg 23 = 15
14
Окисление
2 tu – 2e – 2H+ = fds
Пиридин, 2,2’-дипиридил, 1,10-фенантролин
py, bipy , phen
lg KH
H+ + py = pyH+
5.4
H+ + bipy = bipyH+
4.6
H+ + phen = phenH+
5.2
H+ + NH3 = NH4+
9.25
15
Cu2+ + NH3 = CuNH32+, lg 1 = 4.3
Cu2+ + py = Cupy2+,
lg 1 = 2.5
Fe2+ + 3 bipy = Fe(bipy)32+- красный, исп. для определения железа
Fe3+ Fe2+, напр. гидроксиламином
О – содержащие
1) оксикислоты
винная (соли тартраты, Т2–)
лимонная (соли цитраты, Cit3–)
T2–
lg 1
Cit3–
Fe3+
Zn2+
lg KH1
4.4
6.4
T2–
7.5
3.3
lg KH2
3.0
4.7
Cit3–
11.4
5
lg KH3
-
3.1
HCit2–
6.3
3
16
Триоксиглутаровая
Салициловая (Sal) и сульфосалициловая (SSal)
р-римость:
HSal — 1.8 г / л (ок. 0.01 М)
HSSal — 20 г / л
Sal– + H+ = HSal, lg KH = 3
Mz+
Al3+
Fe3+
Cu2+
Ni2+
lg 1 (Sal–)
12.9
16.5
10.6
7.0
lg 1 (SSal–)
12.3
15.0
9.5
6.4
17
Многоатомные спирты
этиленгликоль (n = 0), глицерин (n = 1), маннит (n = 4)
Большого значения не имеют, хотя перспективны.
Много основных нерастворимых солей при рН 4—9. Нужна более
щелочная среда.
Но!
Fe3+ + глицерин = Fe(глицерин)3+, lg 1 = 12
Остатки карбоновых кислот
а) одноосновные — малоприменимы:
La3+ + Ac- = LaAc2+, lg 1 = 1.2
к тому же осложнения с протонированием остатка и образованием
гидроксокомплексов
18
б) двухосновные
Оксалат C2O42–
Mz+
Al3+
Fe3+
Cu2+
Pb2+
Zn2+
lg 1
6.0
7.5
4.8
3.3
3.5
C2O42– + 2 H+ = HC2O4– + H+ = H2C2O4
lg K1H = 4.5, lg K2H = 1.5
малобалластный восстановитель, например, для золота.
Получение высокочистых оксидов и гравиметрия:
2 Ln3+ + 3 C2O42– =
Ln2(C2O4)3 s (прокалив. на воздухе) = Ln2O3 + CO2
19
S- и O-содержащие
унитол
(2, 3 – димеркаптопропансульфонат Na)
Mz+
Zn2+
Hg2+
Pb2+
Fe2+
lg 1
14
40
16
16
к-сы б / цв
Тиогликолевая к-та
HS-CH2-COOH – хелаты
Mz+
Zn2+
Hg2+
Pb2+
Fe2+
lg 2
8
44
8
11
Обычно рН нейтр. или кислый
20
Осаждение
Растворимость:
As = Asolv, S = [A] = Ks
ABs = Asolv + Bsolv, Ks = [A][B], S = ?
а) если [A] = [B], то S = Ks1/2
б) если избыток В, то S = [A] = Ks / [B]
в) если избыток А, то S = [B] = Ks / [A]
d) если есть D, такой что B + D = BD, KBD, то S = [A] = CB =
[B] + [BD] = [B] (1 + KBD[D]) =
= [Ks(1 + KBD[D])]1/2
и т. д.
21
Термодинамика
RT ln Ks = – G = – H + T S
As = Asolv, представим как сумму
As = Agas, G1
Agas = Asolv, G2
G = G 1 + G 2
G1 — разрушение решетки, G2 — сольватация
G — разность двух больших величин.
1 эВ = 100 кдж / моль
1 лог. ед. = 5 кдж / моль
22
Эмпирически:
соль
LiF
NaF
KF
S, M
0.1
0.5
6
соль
LiCl
NaCl
KCl
S, M
7
5.5
3.6
соль
LiClO4
NaClO4
KClO4
S, M
3.6
8.6
0.1
Rcat, S
Rcat, S
Rcat, S
23
Простые осадители:
а) на большие катионы (в т.ч., комплексные, но преимущественно с 1+:
ClO4–, Ph4B–, BF4–, PF6–
прим. CsClO4
б) на большие анионы (в т.ч., комплексные, преимущественно с 1-:
NR4+, Cs+, из органических NH3+-Ph-Ph-NH3+ (бензидиний кат.)
NH2-Ph-Ph-NH2 + 2 H+ = NH3+-Ph-Ph-NH3+
осаждает из слабокислых растворов SO42–, MoO42–, PO43–
Сложные осадители:
1) орг. сульфиды (легко окисляются)
Тиоанилид, осаждает тяжелые
металлы
в кисл. среде
Висмутолы: R = H — висмутол I, R = Ph — висмутол II
осаждают тяжелые металлы в кисл. среде
24
2) внутрикомплексные соединения
а) оксихинолин
Cu2+ + 2 HOx = CuOx2 s + 2 H+
б) купферон
Осаждает (Fe3+, Bi3+, Ga3+), Cu2+
Не осаждает Mn2+, Co2+, Ni2+, Zn2+
25
в) пирогаллол
подобен купферону,
защита от окислителей
г) салицилальдоксим
Ос. Cu2+ и др. Ме2+
26
д) арсоновые кислоты
Бидентатный лиганд. R = Ph (чаще всего). Обычно рН ок. 0,
ос. M4+ (Sn, Ti, Th, U …)
е) диоксимы
Осн. Ni2+, Pd2+
Ni2+ + 2 H2D = Ni(HD)2 s+ 2H+, pH 8—10
если вместо СН3- стоят фурилы
то фурилдиоксим — лучше растворим сам.
27
ж) нитрозонафтолы
Осн. на Co2+, получ. CoL30, который устойчив в кислой среде. С другими Ме – осадки
только в нейтр.среде. Если с сульфогруппами, то нитрозо-R-соль (хорошо растворима
28
Экстракция
тоже компромисс: Asolv1 = Asolv2
Asolv1 Agas Asolv2
но и процессы сложные
Уравнивать заряд по каждой фазе!
Переходят либо незаряженные молекулы, либо электронейтральные комбинации.
Равновесия (механизмы)
ионные пары – большой катион + большой анион, заряды + или -1
1) гидратно-сольватный — кислоты (в т.ч. комплексные).
Экстрагенты — нейтральные кислородсодержащие (спирты, кетоны, эфиры)
основной фрагмент – ассоциат или комплекс из иона H+ и м-л воды и S
C2H5-O-C2H5 — ДЭЭ
CH3-CO-(C4H9) — метилизобутилкетон (МИК, МИБК)
C4H9-O-C2H4-O-C2H4-O-C4H9 — дибутилкарбитол (DBC)
ТБФ, TBP
29
Fe3+ + i Cl– = FeCli3–i
FeCl4–aq + H+aq + n Sorg = {(H+ nS) FeCl4–}org, nS = 3 (часто, но не всегда)
CuCl3–aq + H+aq + n Sorg = {(H+ nS) CuCl3–}org
D = CM org / CM aq
Влияние H+. Также участвует H2O (n h)
Влияние разбавления экстрагента CCl4, CHCl3, C6H6 и др.
Если CS >> CM, то d lgD / d lgCS = nS
другие формы…
большие концентрации
Экстракция обычных кислот (HNO3, HClO4, …)
Нормально хлориды, бромиды, роданиды. Плохо F–, OH–
Часто используется для очистки, например,
Sc3+ + 4 SCN– = Sc(SCN)4– и т. д.
30
Нитраты –
Ce3+aq + 3NO3-aq + 3 Sorg = Ce(NO3)3S3 org – скорее координационная
жидкие сольваты, постоянство стехиометрии, нет свободного S.
S чаще всего ТБФ,
ср. с {(H+ nsS nhH2O) FeCl4–}org или {(H+ nsS nhH2O) AuCl4–}org
2) анионообменный
FeCl4–aq + NR4Xorg = NR4+FeCl4–org + X–aq
31
3) экстракция хелатов (нейтральных)
практически только в анализе
комплексы с диоксимами, купфероном, нитрозонафтолом, оксихинолином
(все в CHCl3, бензоле, петр. эфире и т.п.), дитиокарбаматом (Cu2+, Ni2+)
дитизоном (кл. Б, Hg2+ можно из 3 М H2SO4)
В водном растворе H2Dz = HDz– + H+, K = 3 10–5.
Экстракция: Mn+aq + n H2Dz org = [M(HDz)n] org + n H+aq, Kex.
32
-дикетонаты
R'-CO-CH-CO-R''
Mn+в + n (R'-CO-CH2-CO-R'')о = [M(R'-CO-CH-CO-R'')n]о + n H+в,
Kex
Al3+aq + 3 (R'-CO-CH2-CO-R'')оrg = [Al(R'-CO-CH-CO-R'')n]о + 3 H+в
Влияние кислоты
Ацетилацетон (HAA) R'= R'' = CH3
Бензоилацетон (HBA) R'= Ph, R''= CH3
Дибензоилметан (HBМ) R'= R''= Ph
Теноилтрифторацетон (HТТА),
33
Индикаторы (indicator)
Требования:
1) возможность учета влияния индикаторной подсистемы на основной процесс
2) обратимость превращения в индикаторной п / с.
Метод индикаторных п / с
A + B = AB, K – основной процесс
X + B = BX, KX – индикаторная п / с, изучена отдельно и KX известна
Пусть используем спектрофотометрию,
A = B = AB = 0,
X и BX 0 и известны
Матбаланс:
CA = [A] + [AB]
CB = [B] + [AB] + [BX]
CX = [X] + [BX]
34
A + B = AB, K – осн. процесс
X + B = BX, KX – индик. п / с, изучена
Оптич. плотность
CA = [A] + [AB]
CB = [B] + [AB] + [BX]
CX = [X] + [BX]
A = X[X] + BX[BX] = X[X] + BX (CX – [X]) =
= BX CX + (X – BX) [X]
[X] = (A – BX CX) / (X – BX)
[BX] = CX – [X]
[B] = [BX] / [X] KX
[AB] = CB – [BX] – [B]
[A] = CA – [AB] = CA – CB + [BX] + [B]
K = [AB] / [A][B]
Необходимо наличие двух видов функциональных групп:
для взаимодействия (связывания) и для свойства.
35
1. Азоиндикаторы
азогруппа —N=N— 15,
Хромогены
а) кислотно-основные
п-диметиламиноазобензол,
диметиловый желтый, метиловый желтый, масляный желтый
(к щ кр. желт., рНинд 3.5), R = H
36
Метиловый оранжевый (р-рим в воде, но нерастворим в спирте)
Метиловый красный (Na соль растворима, сам – плохо)
37
Тропеолин 0 (11.1 12.7)
Тропеолин 00 (анилиновый желтый) (1.3 3.2)
Тропеолин 000 (7.4 8.9)
38
Конго красный
б) металлохромные азоиндикаторы
Эриохромовый черный Т
pH 9-10,
Ca2+, Mg2+, жесткость воды
39
арсеназо I
арсеназо III
40
ПАН, 1-(2-пиридилазо)-2-нафтол
ПАР, 4-(2-пиридилазо)-резорцин
ТАР, 4-(2-тиазолилазо)резорцин
41
II. ТФМ красители
исх. (Ph)3C—OH (Ph)3C+ в укс. + HClO4
Наиболее изучен кристаллический фиолетовый
(к щ фиол.-зел. желт., рНинд 1.7)
Если вместо 3-х групп N(CH3)2 стоят 2 группы N(CH3)2, то малахитовый зеленый;
если 2 группы N(C2H5)2, то бриллиантовый зеленый.
Часто исп. в экстракции: SbCl6-aq + R+aq = {R+SbCl6-}org, неселективно
42
III. Фталеиновые и сульфофталеиновые
фенолфталеин (кисл. – б/цв., щел. – красн.)
рН 8.2 – 9.8, устойчив, нечувствителен к повыш. Т, белкам, коллоидам.
феноловый красный
43
крезоловый красный и бромкрезоловый синий
Металлохромные
Ксиленоловый оранжевый
pH < 7: Fe3+, Cu2+, Al3+, Zn2+, Cr3+…
если вместо –SO3– стоит -COO–, то фталеин комплексон
44
IV. Нитроиндикаторы
pH 5 – 7,
б / цв желт.
V. Окислительно-восстановительные
хинон – гидрохинон
E0 = +0.7 В
45
ферроин
Fe(phen)32+ = Fe(phen)33+ + e
произв. бензидина
о-толидин
дифениламин
46
Буферные растворы для рН-метрии.
Требования: легкость приготовления, воспроизводимость состава, устойчивость
Особенности: I = 0.05 М
1. Тетраоксалат калия KHC2O4 H2C2O4 2 H2O
pH 1.68
комплексообразование, окисление
2. Насыщ. при 250 р-р гидротартрата калия (виннокислый кислый) KC4H5O3
HOOC-CH(OH)-CH(OH)-COOK
pK1a = 3.04, pK2a = 4.4
pH 3.56
к-сообразование. Крив. титр.
47
.
3. Гидрофталат калия, 1,2-HOOC-Ph-COO–.
pK1a = 3.0, pK2a = 5.4
pH 4.01,
плохой буфер, с / ф погл.
4. KH2PO4 Na2HPO4
pK1a = 2.1, pK2a = 7.20, pK3a = 12.3
pH 6.86
к-сообразование
5. Na2B4O7 10 H2O
B4O72– + 5 H2O = 2 H2BO3– + 2 H3BO3
pK1a = 9.15, pH 9.18
На практике: NH3 + NH4+ (pH 8.5—10.5)
HAc + Ac– (pH 4— 6)
48
Вещественный анализ лабильных систем
Методы.
Гл. условие – система должна быть предварительно изучена
1) экспериментальные
а) потенциометрия
электроды 1 рода
Ag / Ag+, Hg / Hg22+, Cu / Cu2+, Hg(M) / Mz+ (M = Zn, Cd, Tl, Bi, Pb …и
даже K, Na)
E = EM0 + (RT / zF) ln [M] = EMXi0 + (RT / zF) ln [MXi] / [X]i
EM0 – EMXi0 = (RT / zF) ln i
2.303 (RT / F) = 59.16 (мВ при 25оС)
необходимо установление равновесия!!!
49
2 рода
Ag / AgX / X–, Hg / Hg2X2 / X–, X = Cl, Br, I, SCN, N3, IO3, OH (для Hg), SO4 и др.
E = EX0 – (RT / zF) ln [X–]
Основа для ИСЭ: LaF3 / F– - основной метод определения F–
Ag2S / S2– на S2– , HS–, H2S
(Ag2S (X–) / X–) – нередко вместо обычных электродов второго рода.
Окс / ред (на Pt, C, Au)
соотношение форм железа(II) и железа(III), кислород (плохо), иод и нек. другие
пример:
I2 + 2 e = 2 I –
E = Eo + 29.58 lg [I2] / [I–]2 (мВ) 25о С
Fe3+ + e = Fe2+
E = Eo + 59.16 lg [Fe3+] / [Fe2+]
калибровка электрода – определение E o.
50
рН-метрия
водородный электрод (Pt); Pd(H2) электрод; хингидронный электрод;
стеклянный электрод:
а) пределы работы (0—12)
б) солевая ошибка (NaClO4)
в) щелочная ошибка
г) цепь
Ag, AgCl, Cl– | KCl (нас.?)| сол. мост| S , [H+] | ст. электрод
51
2 вида задач:
а) стандартизация
E = E0* + RT / F ln aH+ + d = E0* – 59.16 pH (инстр)
б) исследование процессов
E = E0* + RT / F ln aH+ + d = E0* + RT / F ln [H+] + RT / F ln yH + d
далее обеспечить условия RT / F ln yH + d = const или калибровка, но
в этом случае калибровать не по стандартным буферным растворам,
а по сильной кислоте или щелочи.
52
Спектрофотометрия
{Ai = i [MXi]} при нескольких длинах волн [MXi]
Индикаторные п / с
Hg2+ + i I– = HgIi2–i
I 2 / I– , E I – ,
[HgIi2–i] = CHg i ([I–])
53
Расчетные методы (прямая задача)
Нужны данные элементного анализа + константы равновесий
Гомогенные системы (растворы)
формы базисные и сложные. Формальный элемент (SCN–)
i Ai = Bj
Hg2+ + Cl– = HgCl+
Hg2+ + 2 Cl– = HgCl2
Hg2+ + 3 Cl– = HgCl3–
…
Cd2+ + Cl– = CdCl+
базисные: Hg2+, Cl–, Cd2+
сложные: HgCli2–i, CdCli2–i (i = 1, 2 …)
54
Пусть A, B.
i A + j B = AiBj, Kij
В общем случае, [AiBj] = f (CA, CB,Kij) - единственное решение.
A + B = AB, K11
A + 2 B = AB2, K12
алгоритм:
стехиометрическая матрица
A
B
A
1
0
1
B
0
1
1
AB
1
1
K11
AB2
1
2
K12
55
CA = 1 [A] + 0 [B] + 1 [AB] + 1 [AB2]
CB = 0 [A] + 1 [B] + 1 [AB] + 2 [AB2]
CA = [A] + K11[A][B] + K12[A][B]2
CB = [B] + K11[A][B] + 2 K12[A][B]2
x = [A], y = [B]
CA = x + K11 x y + K12 x y2
CB = y + K11 x y + 2 K12 x y2
алгоритм поиска:
выбираем произвольно x0, y0 – начальное приближение – и ставим в систему
x0 + K11 x0 y0 + K12 x0 y02 = CA0
x0 + K11 x0 y0 + 2 K12 x0 y02 = CB0
56
x0 + K11 x0 y0 + K12 x0 y02 = CA0
x0 + K11 x0 y0 + 2 K12 x0 y02 = CB0
Вычитаем (CA = CA0 – CA, CB = CB0 – CB), используем простейшее
соотношение для дифференциалов (x i y j) i x i - 1y j x + j x i y j - 1 y
и переходим к новой системе
CA = x + K11 y0 x + K11 x0 y + K12 y02 x + 2 K12 x0 y0 y
CB = y + K11 y0 x + K11 x0 y + 2 K12 y02 x + 4 K12 x0 y0 y
или
CA = x (1 + K11 y0 + K12 y02) + y (K11 x0 + + 2 K12 x0 y0)
CB = x (K11 y0 + 2 K12 y02) + y (1 + K11 x0 + 4 K12 x0 y0)
Решаем линейную систему и находим x и y. Затем определяем
x1 = x0 – x и y1 = y0 – y. Это первое приближение.
Опять ставим в систему, рассчитываем CA1 и CB1, затем находим x и y,
определяем x2, y2 и т. д. до сходимости, пока рассчитанные CAi и CBi не станут
равными CA и CB с требуемой точностью.
К этому алгоритму обычно сводят все остальные
57
Некоторые дополнения:
1) системы с осадками
два вида задач:
CA и CB ко всей системе; или только к раствору?
Если только к раствору, то см. выше.
Если ко всей системе, то
A + B = ABs, Ks
A + B = AB, K11
A + 2 B = AB2, K12
CA = [A] + K11[A][B] + K12[A][B]2 + Cs
CB = [B] + K11[A][B] + 2 K12[A][B]2 + Cs
здесь Cs = ns / V – неизвестно.
58
Формально дополняем систему:
CA = [A] + K11[A][B] + K12[A][B]2 + Cs
CB = [B] + K11[A][B] + 2 K12[A][B]2 + Cs
Ks = [A][B]
и дальше решаем так же, как в гомогенном случае
2) реакции обмена
AX + BY = AY + BX, K
На первый взгляд, здесь на 4 формы 5 уравнений –
- 4 уравнения баланса (CA, CB, CX, CY) и 1 ЗДМ.
Т.е. количество уравнений больше, чем неизвестных.
Реально же уравнения баланса не являются независимыми, поскольку
CA + CB = CX + CY
т.е. нужно использовать только 3 из них.
Аналогично с электронейтральностью.
59
3) окс-ред процессы
Ce4+ + Fe2+ = Ce3+ + Fe3+, K
4 формы и 3 уравнения – 2 баланса (CCe, CFe) и 1 ЗДМ.
Система недоопределена.
Пусть в исходном растворе: Ce4+ + Fe3+, Ce3+ + Fe2+, Ce4+ + Fe2+, Ce3+ + Fe3+,
и во всех случаях {CFe, CCe} одинаковы. Однако равновесный состав будет
разный.
Принцип: необходимо знать общую концентрацию восстановителя или
окислителя,
например, Cox = C0Ce4++ C0Fe3+ или CRed = C0Ce3++ C0Fe2+ , тогда
СOx = [Fe3+] + [Ce4+].
Иногда это формализуется до концентрации электронов: Ce = CRed.
Только данных элементного анализа и констант недостаточно!
60