G*(x 1 * )
advertisement

Лекция 12
Правило фаз Гиббса и его применение к различным
диаграммам состояния бинарных систем (простая
эвтектика, диаграмма с конгруентно и
инконгруентно плавящимся соединением).
Диаграммы состояния двухкомпонентных систем.
Расслаивание.
Лекция 11
Осмос. Уравнение Вант-Гоффа. Осмотический
коэффициент.
Уравнения Гиббса-Дюгема-Маргулеса. Обобщенное
уравнение Гиббса-Дюгема. Мольные
(интегральные) и парциальные мольные величины.
Их определение для бинарных растворов.
Зависимость парциальных мольных объемов от
состава в системе Н2О - С2Н5ОН
Равновесие жидкость - пар в двухкомпонентных
системах. Различные виды диаграмм состояния в
координатах: P(xi, yi)-T(xi, yi)-xi(yi). Азеотропные
смеси. Законы Гиббса Коновалова.
P
T=const
p1
p2
x1(ж)
x1(п)
X1(п,ж)
Разделение
р
T=const
p1
p2
x1(ж)
x1(п)
Х1(ж) =1
X1(п,ж)
T=const
P
p1
p2
x1(ж)
x1(ж) = x1(п)
x1(ж)
X1(п,ж)
T=const
p
Min !
p= f(x1(ж))
p1
p2
X1(п,ж)
x1(ж) = x1(п)
P
T=const
p1
p2
x1(ж)
x1(п)
X1(п,ж)
р=const=1 бар
Т
Т2
Т1
X1
(п,ж)
x1(п)
x1(ж)
P
T=const
Max !
p1
p2
x1(ж) = x1(п)
X1(п,ж)
р=const
Т
Min !
T= g(x1(п))
Т1
Т2
X1(п,ж)
x1(ж) = x1(п)
T
p=const
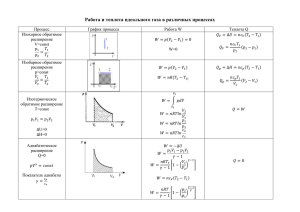
С=2+1-1=2
Tпл(1)
р=р {1,2}
Tпл(2)
Кр.(1)+р=р {1,2}
Кр.(2)+р=р {1,2}
С=0
Кр. (2) + Кр. (1)
С=2+1-2=1
x1
T
p=const
Tпл(A2B)
Tпл(B)
Tпл(A)
Кр. (A2B) + р=р
A2B
xA
T
p=const
Tпл(A)
Tпл(B)
Tин.пл(A2B)
Инконгруэнтное плавление!
A2B
xA
p,T1=const
*
G
G2*
G1*
x1*
x1#
x1**
X1
*
G
p,T1=const
tg abc 1 ( x ) 2 ( x )
**
1
**
1
a
c
b
x1*
x1**
G*(x1*)
X1
T
p=const
Раствор
G*
Смесь
x1*и x1*
T1
x1*
x1#
x1**
X1
Система никотин - вода
t0 C
Выпуклая оболочка
G*
dG T , p,n
0
i
X1
р
пар
μ
p1=const
ж
p2
тв
тв
пар
p1
Т1
Т
dG T , p 0
Т1
Т2
Т3
Т
G*
G1* (Жд.)
Жд.
p1; T0=const
T
T0
p1=const
G1* (Жд.)
G*
G1* (Тв.)
Жд.
X*1
p1; T1=const
T1
T
p1=const
X*1
G1* (Жд.)
G*
G1* (Тв.)
X**1
X*1
p1; T2=const
T
T2
p1=const
X**1
X*1
G*
G2* (Тв.)
G1* (Тв.)
p1; T3 =const
X*1
T
T3
p1=const
X*1
G*
p1; T1=const
b
Жд.
a
X*1
c
Газ
X**1
p
T1=const
Жд.
p1
Газ
X*1
X**1
G*
p1; T1=const
Пар
Жд.
Xпар1 = Xжд1
p
p1
T1=const
Жд.
Пар
Xпар1 = Xжд1
G
Химическое равновесие
G
G пр пр р р
T , p
0
пр
пр р р 0
ξ
K Q
Фаза
Газ:
Ид.
p A2 B p pB
K (T ) 2
p A pB p A2 B
2
A
Реал.
0
f A2 B p pB
2
f A f B p A2 B
2
A
Реал.
Жд.,тв.:
Ид. 0
(x=1)
K (T , p)
K (T , p )
0
0
x A2 B
2
A B
x x
a A2 B
2
A B
a a
d ln K H
2
dT RT
0
d ln K 0 H 0
2
dT RT
d ln K 0
V 0
RT
dp T
K Q
Фаза
Раз.
р=р:
0
0,
K (T , p)
K (T , p)
xA2 B
2
A B
x x
Раст-ль!
Раз.
р=р:
K (T , p )
x A2 B
2
A B
d ln K 0 H 0
2
dT
RT
d ln K 0
V 0
RT
dp T
d ln K H
2
dT RT
x x
d ln K
V
RT
dp T
Растворитель!