ВОДА – ОСНОВА ЖИЗНИ НА ЗЕМЛЕ.
реклама

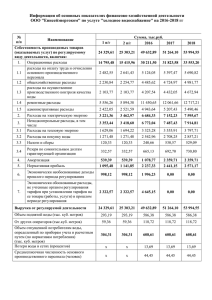
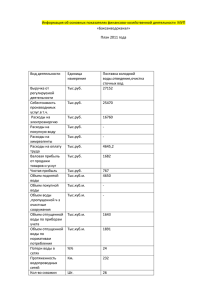
Уникальное вещество природы Автор: учитель химии МОУ СОШ р.п. Ровное Саратовской области Маслова Ольга Николаевна ВОДА В ПРИРОДЕ. «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества- минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество… ею проникнуто и охвачено». В.И.Вернадский « Вода, у тебя нет ни цвета, ни вкуса , ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни. Ты- сама жизнь. Ты наполняешь нас радостью, которую не объяснишь нашими чуствами. С тобою возвращаются к нам силы, с которыми мы уже простились.» Антуана де Сент-Экзюпери Где вода, там жизнь. Земля умирает, если ушла вода. План описания вещества: • Состав. Строение. • Нахождение в природе. • Значение. • Получение. • Свойства. • Применение. Опорный конспект. Физические свойства воды ЖИДКОЕ ТВЕРДОЕ Т кип.= 100 С р= =1/мл; 100кг/м С (удельная теплоемкость) = 4200 кДж/кг х С Т пл = 0С Р = 0,92 г/мл; 920 кг/м С = 2100кДж/кг х С Плотность. • Общеизвестно, что все вещества при нагревании увеличивают свой объём и уменьшают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4ºС, когда с возрастанием температуры объём воды не увеличивается, а, наоборот, сокращается. Максимальная плотность отмечается при 4ºС. • Таким образом, для воды зависимость между объёмом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Например, при 3 и 5ºС масса воды занимает один и тот же объём, так же как и при 0,2 и 5ºС и т.д. • Несмотря на указанную аномалию, вода служит эталоном плотности при 4ºС, когда 1 см³ её имеет массу 1 грамм. При замерзании объём воды возрастает внезапно на 11 % и так же внезапно, скачком, уменьшается в обратном направлении, при таянии льда при 0ºС. Увеличение объёма воды при замерзании имеет громадное значение, как в природе, так и в технике. При замерзании воды в замкнутом пространстве и превращении её в лёд происходит расширение объёма, что приводит к возникновению избыточного давления, достигающего 2500 кг/см². Именно этим объясняются как разрушительная сила замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающая подчас многотонные глыбы и дробящая их в дальнейшем на мелкие осколки, так и страшные взрывы наледей, а также разрывы Гипотетические модели молекулы воды. • А) Электроны не сосредоточены в одной точке, а «размазываются» по орбите, которая соответствует не линии, а оболочке в форме электронного облака (орбиты электронов двух атомов водорода шарообразны; орбиты двух внутренних электронов атома кислорода шарообразны, а наружных представлены в форме объёмных восьмёрок, направленных по трём координатным осям). • Б) Орбиты двух атомов водорода сильно вытянуты. Ассоциация молекул воды. • Пунктирными линиями на рисунке обозначены водородные связи между молекулами воды. Изотопные разновидности воды. • Атомы водорода и кислорода, образующие воду или оксид водорода, могут иметь различные массовые числа и отличаться друг от друга своими физико – химическими свойствами, но при этом они имеют одинаковый электрический заряд атомных ядер и поэтому занимают в периодической системе элементов одно и то же место. Такие разновидности атомов одного и того же химического элемента называются изотопами. Содержание, % от всей воды. Соответствие содержанию в морской воде 99,73 - О 0,20 Магния О 0,04 Кальция Молекула воды 1 Н 1 2 16 Н D 2 2 О 18 17 1 НD16О 0,02 Калия 1 НD18О 0,00006 Азота 1 НD17О 0,00001 Алюминия D 2 16 О 0,000003 Фосфора D 2 18 О 0,000000009 Ртути D 17 О 0,000000001 Золота 2 Типы химических реакций Реакции разложения Реакции соединения Реакции замещения Реакции обмена Реакции разложения электрический ток 2H2 O 2 H2 O2 • фотолиз • фотосинтез Реакции соединения CaO H 2 O Ca (OH) 2 N2O H 2 O 2 HNO 3 5 •Гидроксиды – кислородсодержащие кислоты и основания •Вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если образуется растворимый гидроксид (щелочь или кислородсодержащая кислота) Реакции замещения 2 Na 2 H 2 O 2 Na OH 2 H 2 Содержание воды в организме человека в % слюна кости и жировая ткань общее содержание кровь мозг человека мышцы и внутренние органы 110 100 90 80 70 60 50 40 30 20 10 0 За сутки: • Через сердце проходит 5 тонн крови • Через почки - 100 кг жидкости • Через сосуды берёзы – 60 литров воды • Хмель прогоняет 300 литров воды Применение воды На производство: • 1 т ситца расходуется – 250 куб метров воды. • 1 т бумаги расходуется - 900 куб метров воды; • 1 т никеля расходуется – 4000 куб метров воды; • 1 т синтетического волокна – 5000 куб метров воды; Цивилизация это диалог между человеком и водой (Индира Ганди) • • • • • • Что мы узнали сегодня нового? Что было непонятно? Что мы научились выполнять? Какие были затруднения? Что показалось самым интересным? Что удивило вас?