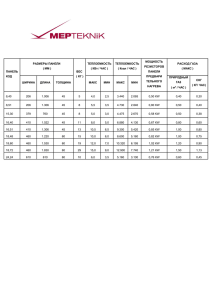
Определение давления в моделируемой системе
реклама

УРАЛЬСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ - УПИ ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Компьютерное моделирование процессов массопереноса в реакторных материалах ЛЕКЦИЯ 12 «Определение макроскопических величин в методе молекулярной динамики» Лектор: Купряжкин Анатолий Яковлевич Авторы курса: А.Я. Купряжкин, К.А. Некрасов Цель лекции: Получение выражений термодинамических характеристик моделируемой системы по данным ММД 3 ПЛАН ЛЕКЦИИ: Определение температуры моделируемой системы. Изохорная и изобарная теплоемкости. Определение давления в моделируемой системе. Изменение энтропии. Определение полной и поверхностной энергии системы. 4 ПЛАН ЛЕКЦИИ: Расчет коэффициента диффузии частиц методом молекулярной динамики. Погрешность определения термодинамических характеристик моделируемой системы. Идентификация фазовых состояний в ММД. 5 Определение макроскопических величин в методе молекулярной динамики Равновесное макросостояние газа можно характеризовать такими основными параметрами как абсолютная температура T, среднее давление p, а также объемом V и полной энергией E. . 6 Определение температуры моделируемой системы Определение температуры следует из теоремы о равномерном распределении энергии по степеням свободы. В d -мерном пространстве средняя энергия на одну степень свободы составляет kT , выражение 2 для общей энергии имеет вид 1 d 2 NkT mi . 2 2 7 Определение температуры моделируемой системы Сумма в последнем соотношении берется по всем N частицам системы и d -компонентам скорости, а означает усреднение по времени. Данное выражение представляет собой пример связи макроскопической величины (температуры) с временным средним по траекториям частиц, оно справедливо только в том случае, если движение центра масс системы равно нулю. Температуру в ММД, как правило, измеряют в единицах E . k 8 Изохорная теплоемкость Важной тепловой характеристикой является теплоемкость при постоянном объеме (изохорная теплоемкость) E cV . T V Для исключения зависимости теплоемкости от размеров системы удобно определить удельную c теплоемкость на частицу V . N 9 Изохорная теплоемкость Проще получить удельную теплоемкость cV путем нахождения средней потенциальной энергии при соседних температурах T и T t . Теплоемкость cV складывается из температурной зависимости потенциальной энергии и удельной теплоемкости связанной с кинетической энергией (то есть kT d ). 2 10 Изобарная теплоемкость Подбирая объем модели, можно провести серию молекулярно динамических опытов при постоянном давлении. Это позволяет при наличии зависимости E T вычислить теплоемкость при постоянном давлении (изобарную теплоемкость) NA E cp , N T где N A – постоянная Авогадро, а теплоемкость записана в расчете на один моль. 11 Определение давления в моделируемой системе Давление в методе молекулярной динамики можно определить двумя способами. 1. Столкновение частиц со стенками резервуара приводят к тому, что на каждый элемент стенки резервуара действует результирующая сила. Средняя сила, действующая на единичную площадку, и есть давление газа. Рассмотрим элемент поверхности dA. Среднюю силу, возникающую за счет пересечения молекулами выделенной поверхности, слева направо обозначим S , справа налево – S . Результирующая сила в таком случае равна F S S . 12 Определение давления в моделируемой системе dFn Откуда для давления имеем p , где Fn – dA компонента силы, нормальная к элементу поверхности. 2. Второй способ определения давления основан на использовании теоремы вириала. С ее помощью получено следующее соотношение для среднего давления 1 p 3V 1 2 Ek 2 U ij rij r , i j j 1 ij N N где V – объем системы, U ij – потенциальная энергия взаимодействия частиц i и j, rij – расстояние между этими частицами. 13 Изменение энтропии Используя выражение для второго закона термодинамики, а также определение теплоемкости, нетрудно определить изменение энтропии в зависимости от температуры S T2 S T1 T2 T1 c dT , T где S – энтропия системы, c – теплоемкость системы в каком-либо процессе, T – абсолютная температура. 14 Определение полной и поверхностной энергии системы Когда на каждом шаге интегрирования определяется потенциальная энергия системы, то можно рассчитать ее среднее значение. Тогда полная внутренняя энергия E Ek 1 2 N N U ij , i j j 1 где U ij – потенциальная энергия взаимодействия частиц i и j. Для того чтобы выделить поверхностную энергию системы, необходимо из полной энергии вычесть энергию объемных атомов, выделив по15 своим представлениям объемную часть. Расчет коэффициента диффузии методом молекулярной динамики Уравнение, описывающее постоянную анизотропную диффузию в d-мерном пространстве, имеет вид n d 2n Di 2 , t i 1 xi где n xi ,t – плотность числа частиц. Здесь и далее принято x x1 , y x2 , z x3 . 16 Расчет коэффициента диффузии методом молекулярной динамики Подстановкой можно показать, что решением этого уравнения, отвечающим начальному условию xi 0 при t 0 для всех N частиц, является функция d xi2 n xi ,t AN exp , i 1 4Dit d где A 4 Dit 1 2 . i 1 17 Расчет коэффициента диффузии методом молекулярной динамики Через время t частица будет находиться в точке xi и ее смещение xi относительно начального положения равно xi . Откуда среднеквадратичное смещение составляет xi 2 N 1 n xi ,t xi2 dxi 2Dit . Следовательно, для одномерной диффузии коэффициент диффузии определяется соотношением 1 Di 2 xi t 2 . 18 Расчет коэффициента диффузии методом молекулярной динамики Если диффузия изотропна, то есть D1 D2 D3 D , то ее также можно определить из квадрата длины вектора смещения d r xi , 2 2 i 1 среднее которого равно r 2 d xi 2 2dDt . i 1 Откуда следует 1 r D 2d t 2 . 19 Расчет коэффициента диффузии методом молекулярной динамики В случае ансамбля частиц измеряются смещения каждой частицы от ее начального положения xi, j xin, j xi0, j , где xi,n j – i-ая компонента координаты j-й частицы в момент времени t nt . Среднеквадратичное смещение при этом принимает вид xi 2 N 1 N j 1 xi, j 2 . Для проведения таких вычислений в программе можно один раз запомнить xi0, j и далее просчитывать 2 выражения для r , xi , j , xi 2 . Также можно найти смещение, накапливая на каждом шаге по времени скорость для каждой частицы отдельно. 20 Погрешность определения термодинамических характеристик моделируемой системы Статические погрешности определения термодинамических свойств обуславливаются в основном тем, что усреднение по бесконечному промежутку времени или полному числу состояний в машинных экспериментах аппроксимируется усреднением по конечному интервалу времени или числу состояний. 21 Погрешность определения термодинамических характеристик моделируемой системы Для оценки погрешностей полный интервал из L шагов интегрирования уравнений движения частиц разбивается на несколько подинтервалов (макрошагов). Реализация каждого макрошага считается независимым опытом. Тогда полные средние значения функций по L шагам вычисляются из средних по макрошагам, а стандартные отклонения как средних по макрошагу, так и полных средних, определяются из серии независимых измерений в соответствии с обычными приемами теории ошибок. 22 Идентификация фазовых состояний в методе молекулярной динамики Радиальная функция распределения О фазовом состоянии молекулярно динамической модели можно судить по виду радиальной функции распределения. Математическая запись выражения для радиальной функции распределения g r имеет вид V N r g r , 2 N 4 r r N r – число частиц в шаровом слое толщиной r , прилежащем к сфере радиуса r (см. рисунок). 23 Шаровой слой вблизи некоторой сферы r r 24 Радиальная функция распределения для кристалла Если микрокластер кристаллический, то функция g r будет иметь хорошо выделенные пики, соответствующие координатным оболочкам. С ростом r эти пики будут понижаться. g r r 25 Радиальная функция распределения для газа В случае газа, молекулы которого очень слабо взаимодействуют друг с другом и имеют средний размер rM , локальная плотность частиц на любом расстоянии от молекулы, большем 2rM , равна среднечисловой. g r 1 26 2r r Радиальная функция распределения для жидкости Для жидкости характерно наличие ближнего порядка, поэтому радиальная функция распределения испытывает затухающие осцилляции. Максимумы ее соответствуют наиболее вероятным межмолекулярным расстояниям, а минимумы – расстояниям, на которых молекулы находятся сравнительно редко. g r 1 2rM 4rM r 27 Коэффициент диффузии Из среднеквадратичного смещения атомов можно определить коэффициент диффузии D, воспользовавшись соотношением r t r 0 2 6 Dt C , где r t – положение атома в момент времени t. Усреднение проводится по атомам системы и по набору зависимостей среднеквадратичных смещений от времени. 28 Коэффициент диффузии Для сложной твердой фазы за характерное время машинных экспериментов 10 11 c заметной диффузии не обнаруживается. В жидкой фазе этого времени достаточно для определения величины коэффициента диффузии D (например, для аргона 9 м 2 D 10 ). с 29 Автокорреляционная функция скорости О фазовом состоянии молекулярно динамической модели можно судить также по виду автокорреляционной функции скорости. Расчётная формула для приведённой функции, усредненной по числу частиц, имеет вид 0 t 1 n i 0 i t . N i 1 2 0 2 0 Усреднение по времени проводится по ансамблю таких функций, каждая из которых имеет свое начало отсчета. Интеграл от автокорреляционной функции равен 1 коэффициенту самодиффузии D 0 t dt при 30 условии, что 0 t 0 при t . 30 Структурный фактор Для сопоставления с экспериментами по рассеянию рентгеновских лучей или нейтронов рассчитывается структурный фактор – Фурье образ корреляционной функции Gr g r 1 sin kr N 2 I K 1 4 g r 1 r dr , kr V 0 где K – волновой вектор. 31 Структурный фактор Для идентификации фазовых переходов используют данные о зависимости полной энергии E от температуры T. Для каждой фазы (либо двухфазного состояния) характерен определенный наклон графика функции E T , то есть, характерна определенная теплоемкость. При фазовых переходах функция E T имеет особенность. С помощью проекции частиц системы на плоскость можно отличить упорядоченную структуру кристаллов от полного разупорядочения жидкости. Об изменениях характера движения молекул при переходе от одной фазы к другой, перестройках структуры можно судить по зависимостям мгновенной 32 потенциальной энергии частиц от времени. Выводы по лекции Метод молекулярной динамики позволяет получать полную информацию о поведении моделируемой системы как на микроскопическом так и на макроскопическом уровне с получением всех термодинамических характеристик. 33 Список литературы к лекции 12 • • • • Ryabov V.A. Phys. Rev. E 64 (2001). 026112. Ryabov V.A. Physics Letters A 359 (2006) 61 – 65. Гулд Х. Компьютерное моделирование в физике / Х. Гулд, Я. Тобочник. ч. 1, М.: Мир, 1990. 349 с. Гулд Х. Компьютерное моделирование в физике / Х. Гулд, Я. Тобочник. ч. 2, М.: Мир, 1990. 399 с. 34 Спасибо за внимание! 35 Вопросы? 36