Полоса Амид III
реклама
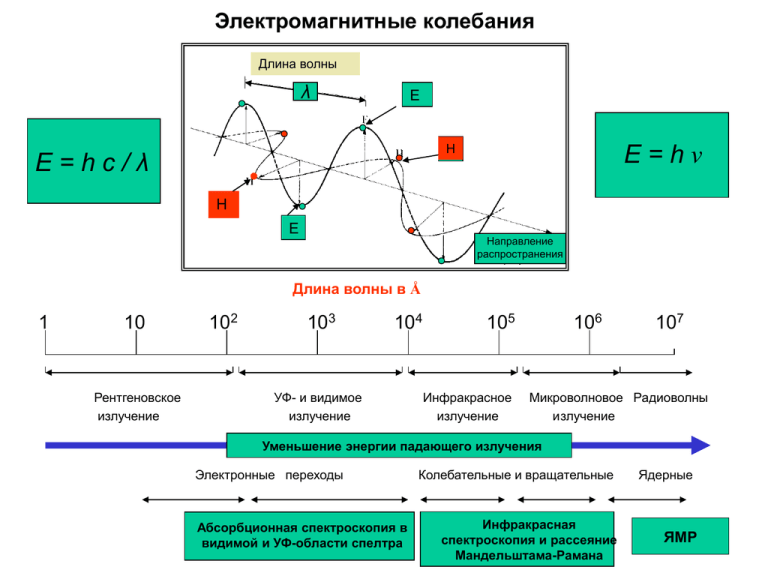
Электромагнитные колебания Длина волны λ E E=hν H E=hc/λ H E Направление распространения Длина волны в Å 1 10 Рентгеновское излучение 102 103 104 УФ- и видимое излучение 105 Инфракрасное излучение 106 107 Микроволновое Радиоволны излучение Уменьшение энергии падающего излучения Электронные переходы Абсорбционная спектроскопия в видимой и УФ-области спелтра Колебательные и вращательные Инфракрасная спектроскопия и рассеяние Мандельштама-Рамана Ядерные ЯМР 1800 Астроном Вильям Гершель открыл инфракрасное излучение. 1835 Первый спектрометр, работающий в инфракрасном диапазоне был создан через 35 лет после открытия ИК-излучения и на протяжении 90 лет ИК-спектроскопия широко применялась в астрономии, органической химии и химии атмосферы. 1892 A. A. Майкельсон сконструировал интерферометр, позже названный его именем, и в том же году Лорд Релей установил, что получаемая на выходе интерферограмма связана со спектром математической операцией, известной как фурье-преообразование. 1949 Е. К. Блаут и Р. К. Меллорс показали, что инфракрасные спектры позволяют получить информацию о строении молекулярной структуры человеческой ткани. Однако исследования в этом направлении продолжались недостаточно интенсивно из-за ограничений, накладываемых как инструментом, так и сложностью исследуемых систем и интерпретацией полученных спектров. 1969 Появились первые коммерческие инструменты низкого разрешения в средней инфракрасной области (4000–400 см-1) полностью управляемые компьютером и содержащие программы преобразования интерферограмм в спектр с помощью Фурьепреобразования. В настоящее время доступны приборы с разрешением около 0.1 см-1. Фурье-преобразование занимает доли секунды. В ол ь ф ра м ова я л ам па К ач а ю щ а яс я во гн у та я д иф р ак ци он на я ре ш етк а Накаленное тело Д ей те ри ева я л ам па К ач а ю щ е ес я в о гн у то е с ф е ри ч ес к ое з ер ка л о Ра с щ еп ите ль п у ч ка Д ете кт ор с р ав нен ия О бр аз ец Детектор ИФ-излучения Д ете кт ор Около 30 лет назад конструкция приборов для инфракрасной спектроскопии претерпела большие изменения. В основе современных инструментов для средней и дальней ИК-областей лежит усовершенствованный интерферометр Майкельсона, a преобразование интерферограммы в спектр осуществляется с помощью преобразования Фурье. Сам метод получил название ИКспектроскопии с фурье-преобразованием (ИК-ФП). Неподвижное зеркало Интерферометр Майкельсона + Фурье преобразование Подвижное зеркало Разделитель луча Лазер Образец δ=0 Δ=λ/2 Δ=λ Δ=3λ/2 Интерферограмма Детектор Спектр B(ν) I(δ) ν0=1/λ Фурье 0 λ/2 λ 3λ/2 δ Если источник света имеет более одной частоты, например две, то интерферограмма будет содержать две косинусоиды, и так далее. Реальная интерферограмма источника Математически интерферограмма есть сумма всех косинусоид, содержащихся в источнике. n I ( ) B( i ) cos( 2) 1 δ=0 Источником света в инфракрасной спектроскопии является тело, нагретое до такой температуры (1000-1200оC), чтобы иметь максимум в интервале 4000-400 см-1. Помещение образца в в интерферометр Майкельсона приводит к к появлению новых частот в спектре Второй интерферометр (а) Схема ИК-ФП спектрометра. Непрерывное излучение широкополосного ИКисточника модулируется интерферометром Майкельсона. Исходный луч расщепляется, попадая на два зеркала. Свет, отраженный от подвижного и неподвижного зеркал, снова собирается и, пройдя через образец, падает на ИК-детектор. Разность длины оптических путей очень точно измеряется с помощью гелий-неонового лазера (не показан). (б) Компьютер преобразует оцифрованную интерферограмму в ИК-спектр с помощью преобразований Фурье. Колебания молекул При выяснении пространственной структуры молекул необходимо знать длины химических связей и углы между ними. Для большего числа молекул численные значения этих величин известны из рентгеновских дифракционных исследований и данных ядерного магнитного резонанса. Так, длина связей О–H в молекулах воды равна 0,9572 Å, а угол между ними составляет 104,523°. Эти значения соответствуют гипотетическим равновесным состояниям, в которых отсутствуют колебательные и вращательные движения. Относительные положения атомов в молекулах постоянно меняются вследствие различных типов колебаний и вращений вокруг своих связей. При физиологических температурах колебания в них сопровождаются изменениями длин связей приблизительно на ±0,05 Å, а угла между связями – на ±5°. Все колебания делятся на две основные категории: валентные и деформационные Симметричные Асимметричные (a) Эластичные растяжения Валентные колебания заключаются в постоянном изменении межатомных расстояний вдоль оси связи двух атомов. Качания В одном направлении В разных направлениях Изгибы В одном направлении В разных направлениях (б) Колебания в плоскости Деформационные колебания характеризуются изменением угла между двумя связями и бывают четырех типов, как показано на рисунке. Активные и неактивные моды колебаний в ИК-спектрах В качестве примера рассмотрим молекулу двуокиси углерода (О=С=О), имеющую четыре нормальные колебательные моды (см. ниже). Исходя из соображений симметрии, две из них должны быть валентными модами и две – деформационными С им м етрич ны е кол ебани я О C O Неактивные моды О C O Ас им м етрич ны е кол ебани я О C O О C O Активные моды О C O Симметричные и асимметричные колебания в молекуле О=С=О. Симметричные колебания атомов не приводят к изменению дипольного момента молекулы CO2, поэтому они не проявляются в ИК-спектрах. Напротив, асимметричные колебания атомов вызывают изменения дипольного момента молекулы и поэтому проявляются в ИК-спектрах Колебательные моды полиатомных молекул. Нормальные моды колебаний CH3 C O H N CH3 N - м ети ла цет ам и д N-метилацетамид имеет 30 нормальных колебательных мод Если не принимать во внимание шесть атомов водорода метильных групп, то останется 12 нормальных мод, связанных с шестью скелетными атомами (CCONHC). Молекула, состоящая из N атомов имеет 3N степеней свободы: три трансляционные (вдоль осей x, y, z), две вращательные (вокруг осей y, z) , и одна колебательная (растяжение вдоль оси, соединяющей молекулы). Число колебательных степеней свободы для молекулы, состоящей из N атомов равно 3N - 5, если молекула линейна, и 3N - 6, если молекула не линейна. Этот набор колебаний называется молекулярной модой вибрации. Если в молекуле все атомы движутся в фазе, то есть все атомы достигают одновременно положений максимумов и минимумов и одновременно достигают положений равновесия, то такая мода называется нормальной модой колебаний. Строго показано, что только нормальные моды колебаний вносят вклад в инфракрасные спектры. CH3 H C N O CH3 N - м ети ла цет ам и д Изолированная плоская CONH-группа может иметь пять мод колебаний в плоскости (растяжение связи С=О, растяжение связи С-N, изгибание связи OCN, изгибание связи CNH) и одну неплоскую моду колебания (кручение связи C-N). Диапазоны частот различных амидных полос в модельных структурах приведены на рисунке (внизу). Ам и д I Ам и д A CH3 H C N O ~3300 см-1 -1 CH3 H H C N O 34 00 - 35 00 с м CH3 CH3 CH3 H C Ам и д III Ам и д II C N O O 16 00 - 17 00 с м -1 CH3 1597-1672 см-1 N 15 10 1 570 см -1 CH3 1480-1575 см-1 13 50 - 15 70 с м -1 1229-1301 см-1 CH3 Инфракрасные спектры полипептидов и белков N-methylacetamide In-plane modes Out-of-plane modes cm-1 Amide A ~ 3300 Amide B ~ 3100 cm-1 Amide V Amide I 1597-1672 cm-1 Amide VI Amide II 1480-1575 cm-1 Amide III 1229-1301 cm-1 Amide IV 625-767 cm-1 640-800 cm-1 537-606 cm-1 Полосы Амид A and амид B Полоса амид II В разбавленных растворах в отсутствии водородных связей наблюдаются резкая полоса при 3400-3460 cm-1, которая интерпретируется растяжение между N–H связью. При образовании водородных связей полоса смещается к 3120-3320 cm-1 и появляется новая слабая полоса в районе 3100 cm-1. Полоса в районе 1510 and 1570 cm-1 также ассоциируется со вторичной структурой, однако количественно эту полосу очень трудно интерпретировать.. Наиболее часто Полоса Амид III используемые полосы Все вторичные структуры амидов и Полоса амид III занимает спектральную пептидов показывают сильную полосу полосу (1350-1200) и обусловлена изгибами в в районе 1600-1700 cm-1, которая N–H связи и растяжениями в C–N связи. интерпретируется как растягивающие Очень чувствительна к деталям вторичной колебания между C=O связью. структуры. Полоса Амид I Амидные полосы А, B Поглощение воды Измерения амидной полосы I в пленках, тонких кюветах, в D20 Поглощение воды накладывает ограничения на практическое использование амидных полос I II III 1640-1650 cm-1 Полоса Амид III (1350-1200 см-1) в 5-10 раз менее чувствительна, чем полоса Амид I. Однако, отсутствие поглощения воды в этой области, чувствительность к вторичной структуре делают эту полосу незаменимой для измерения ее деталей Соотнесение полос : 1330–1295 cm-1, (α-спираль); 1295–1270 cm-1 (βповорот); 1270–1250 cm-1 (клубок) и 1250–1220 cm-1 (β-структура). Protein α-Helix β-Sheet β-Turn Random coil Method α-Chymotrypsin 15 8 9 8-15 47 50 47 10-53 20 27 30 2-12 18 15 14 38-70 Amid III X-ray Amid I CD 18 3 8 3-25 49 60 58 41-49 25 22 26 15-27 8 15 8 9-36 Amid III X-ray Amid I CD Cytochrome c 43 48 42 27-46 15 10 21 0-9 26 17 25 15-28 15 25 12 28-41 Amid III X-ray Amid I CD Hemoglobin 65 87 78 68-75 4 0 12 1-4 11 7 10 15-20 20 6 9-16 Amid III X-ray Amid I CD IgG 10 3 3 60 67 64 17 18 28 13 12 5 Amid III X-ray Amid I Lysozyme 43 45 40 16 19 19 18 23 27 23 13 14 Amid III X-ray Amid I Myoglobin 61 85 85 67-86 11 0 0 0-13 7 8 8 0-6 21 7 7 11-30 Amid III X-ray Amid I CD Ribоnuclease A 21 23 15 13-30 41 46 40 21-44 25 21 36 11-22 12 10 9 19-50 Amid III X-ray Amid I CD 14 9 9 49 56 44 23 24 38 13 11 9 Amid III X-ray Amid I Concanavalin A Trypsin