Ток в жидкостях
реклама

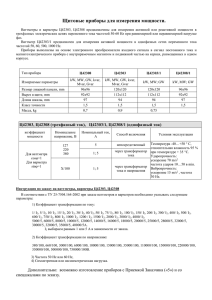
Ток в жидкостях 1.Электролиты 2.Электролитическая диссоциация 3. Электролиз 4. Применение электролиза Ток в жидкостях • Жидкости по степени электропроводности делятся на: • диэлектрики (дистиллированная вода), • проводники (электролиты), • полупроводники (расплавленный селен). Ток в жидкостях • Электрический ток могут проводить растворы солей и кислот, а также обычная вода ( кроме дистиллированной). • Электролиты -вещества, растворы которых проводят электрический ток • Примеры: растворы солей, кислот, щелочей Ток в жидкостях • В растворе молекулы растворяемого вещества под действием растворителя превращаются в положительные и отрицательные ионы. Ток в жидкостях • Электролитическая диссоциация – распад молекул вещества на ионы под действием растворителя. Ток в жидкостях • Рекомбинация ионов Наряду с диссоциацией в электролите одновременно может происходить процесс восстановления ионов в нейтральные молекулы. • Между процессами электролитической диссоциации и рекомбинации при неизменных условиях устанавливается динамическое равновесие. Ток в жидкостях Ионы под действием приложенного к раствору электрического поля могут перемещаться: отрицательные ионы - к положительному электроду, положительные ионы – к отрицательному электроду. В электролите возникает электрический ток. Ток в жидкостях Ток в жидкостях • При прохождении тока через электролит на электродах выделяются чистые вещества, содержавшиеся в растворе. • Это явление называется электролизом. • Электролиз – выделение вещества на электродах при прохождении через электролит тока. • В результате действия электрического тока в электролите происходят необратимые химические изменения, и для дальнейшего поддержания электрического тока его необходимо заменить на новый. Законы электролиза • Закон электролиза: масса вещества, выделившегося на электродах прямо пропорциональна силе тока, идущего через электролит и времени прохождения тока (прямо пропорциональна заряду q, прошедшему через электролит за время t) Законы электролиза • 1833г. - Фарадей • k - электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл. Законы электролиза • Зная массу выделившегося вещества, можно определить заряд электрона. Применение электролиза • Гальваностегия • Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. • Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. • Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними. Применение электролиза • Гальваностегияпокрытие предметов слоем металла при помощи электролиза. Применение электролиза • Археологические раскопки, относящиеся к временам Парфянского царства, позволяют допустить, что уже две тысячи лет тому назад производилось гальваническое золочение и серебрение изделий! • Об этом говорят и находки, сделанные в гробницах египетских фараонов. Каирский музей Каирский музей Гальваностегия Применение электролиза • Гальванопластика- электролитическое осаждение металла на поверхности какоголибо предмета для воспроизведения его формы. • Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. • Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. Гальванопластика • При включении тока металл из электролита оседает на поверхности предмета. • Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок. Применение электролиза • Гальванопластика- применяется для получения металлических копий предметов методами электролиза. • Также могут называться металлические предметы полученные с помощью гальванических покрытий. • Толщина металлических осадков, наносимых при гальванопластике, составляет 0.25-2 мм. Гальванопластика • Наибольшее распространение гальванопластика получила для изготовления точных художественных копий небольших скульптур и ювелирных изделий; • в технике - производство грампластинок, печатных валков, металлических изделий с микронными параметрами. • Основное применение в гальванопластике имеет медь (а также железо, никель, серебро, золото, олово, хром и др.) • Копию от оригинала отделяют либо по специально наносимому барьерному слою, либо удалением ( расплавлением, химическим растворением) оригинала. Гальванопластика • Поверхность копируемого изделия должна быть электропроводной. • В противном случае - наносят различными способами проводящее покрытие. Чаще всего это втирание графита в восковой подслой или химическое восстановление металлов на поверхности оригинала. • Не смотря на появление новых технологий, гальванопластика остается наиболее востребованным методом получения точных металлических копий небольших художественных предметов. Применение электролиза • Металлизировать можно предметы из дерева, листья растений, кружева, мертвых насекомых. • Сначала надо сделать эти предметы жесткими, а для этого подержать их некоторое время в расплавленном воске. • Затем равномерно покрыть слоем графита ( например, потерев карандашным грифелем), чтобы сделать их проводящими и опустить в качестве электрода в гальваническую ванну с электролитом, пропуская через него некоторое время эл. ток. • Через какое-то время на этом электроде выделится металл, содержащийся в растворе, и равномерно покроет предмет. Применение электролиза • Рафинирование - очистка от примесей с помощью электролиза; Рафинирование • Электрохимический метод применяется для рафинирования и очистки многих металлов (около 80 % выпускаемого никеля и значительная часть кобальта). • При этом получается металл чистотой 99,99 % (никель) и 99,6 % (кобальт). При повторном рафинировании чистота металла повышается до 99,9999 %. • Электролитическое рафинирование применяется также для получения чистого серебра (99,99 %) и золота (99,95 %). Рафинирование (очистка) меди • Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. • Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди. • При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. • Аналогичным способом получают и другие чистые металлы – никель, свинец, золото. Электрометаллургия • Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. • Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). • В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. • При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны. Гальванополировка • Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. • Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется. Электрофорез • (от греч. «форезис» – перенесение), это лечебная процедура. • Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. • При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. • Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электрофорез ОПЫТЫ С ЭЛЕКТРОЛИТАМИ 1. Если взять раствор медного купороса, собрать электрическую цепь и опустить электроды ( графитовые стержни от карандаша) в раствор, то лампочка загорится. Есть ток! 2.Повторите опыт, заменив электрод, соединенный с минусом батарейки на алюминиевую пуговицу. Через какое-то время она станет «золотой», т.е. покроется слоем меди. Это явление гальваностегии. ОПЫТЫ С ЭЛЕКТРОЛИТАМИ 3. Нам понадобятся: стакан с крепким раствором поваренной соли, батарейка от карманного фонарика, два кусочка медной проволоки длиной примерно 10 см. Зачистите концы проволоки мелкой наждачной шкуркой. Подсоедините к каждому полюсу батарейки по одному концу проволочек. Свободные концы проволочек опустите в стакан с раствором. Вблизи опущенных концов проволоки поднимаются пузырьки ! СДЕЛАЙ САМ ! Изготовьте измерительный прибор - тестер для определения, является ли вещество проводником электрического тока. Для этого нужны батарейка, лампа от карманного фонарика и соединительные провода. Замкните собранную электрическую цепь на исследуемый проводник и по наличию или отсутствию свечения лампы определите, является ли вещество проводником. СДЕЛАЙ САМ ! Металлический чайник и алюминиевый стакан от калориметра соедините проводниками с гальванометром. В чайник налейте воду, в которой растворите немного соли. Начните тонкой струйкой переливать соленую воду из чайника в стакан, гальванометр покажет наличие электрического тока. Изменяя длину и толщину струи, проследите за изменением силы тока. Почему??? При устройстве заземления хорошо провод зарыть на глубину до 2,5 м. Однако в полевых условиях сделать это не всегда представляется возможным. Поэтому заземление часто делают в виде штыря, забитого в землю. Почему в этом случае полезно место заземления полить соленой водой? Это важно знать!!! • При возникновении пожара в электроустановках нужно немедленно отключить рубильник. • Огонь, вызванный током, НЕЛЬЗЯ гасить водой или обычным огнетушителем, т.к. струя воды является проводником и может снова замкнуть цепь и восстановить причину пожара. • В этом случае необходимо применять сухой песок или пескоструйный огнетушитель. ЧЕЛОВЕЧЕСКОЕ ТЕЛО - ПРОВОДНИК ЭЛЕКТРИЧЕСТВА • Если случайно человек окажется под напряжением, то возможна травма или даже смерть. • При работе с электроцепями : - нельзя одновременное двумя руками прикасаться к оголенным проводам. - нельзя прикасаться к оголенному проводу, стоя на земле или на сыром ( даже цементном или деревянном) полу. - нельзя пользоваться неисправными электрическими приборами. - нельзя ремонтировать электрический прибор, не отключив его от источника тока. • Спасибо за внимание!