Презентация Узнай металл
реклама

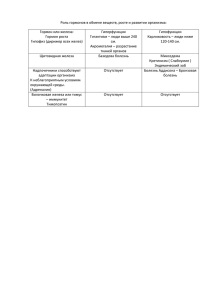
Урок-игра “Узнай металл”. 1 этап “Тестирование” Дать ответ “да” и “нет” в данных утверждениях. 1. При взаимодействии натрия с водой образуется щелочь. 2. Гидроксид кальция называют гашенной известью. 3. Железо входит в состав гемоглобина. 4. Алюминий – редкий элемент. 5.При взаимодействии железа с соляной кислотой образуется хлорид железа III. 6.От лития к цезию плотность щелочных металлов уменьшается. 7.Натрий можно получить электролизом расплава хлорида натрия. 8.Гидроксид алюминия проявляет амфотерные свойства. 9.Железо в природе часто встречается в самородном виде. 10. Желтая кровяная соль – качественный реактив на соли железа 3+. 11. Соли калия окрашивают пламя в желтый цвет. 12. Гидроксид магния проявляет амфотерные свойства. 2 этап “Найди родственников” Составить генетическую цепочку для одного элемента-металла, по схеме: Ме → оксид металла→ соль металла→ гидроксид металла 3 этап “Угадай-ка” Загадки. ''Она идет'', ''она прошла'', никто ни скажет, что пришла. (химическая реакция) Только в воду окунется, невидимкой обернется. (любое растворимое в воде Природной соли маленький кусок отвечать урок помог. (мел) Вопрос–ответ. 1.При взаимодействии железа с газообразным хлором получается хлорид железа … (III) 2. Красная кровяная соль – качественный реактив на соли железа … (II) 3.Металлы могут образовывать смесь друг с другом и с неметаллами, которые называются … (сплавы) Переведите с химического языка на общепринятый следующие фразы. 1. Недонатрий хлористый на столе, перенатрий хлористый на голове. Недосол на столе, пересол на голове. 2. Аллотропная модификация углерода чистой аш-два-о. Алмаз чистой воды. 3. Много оксида водорода утекло с тех пор. Много воды утекло с тех пор. 4. Уходит как аш-два-о в оксид кремния. Уходит как вода в песок. Даже в том что эти строки Вы получите сейчас, Непременно их прочтете И поймете в тот же час. Если с химией ты дружишь, Адрес ты тот час найдешь, Свой металл ты обнаружишь, И его нам назовешь . Задачи. 1. Какая масса 20% раствора гидроксида натрия потребуется для полного взаимодействия с хлоридом железа (III), если было получено 4,3г осадка, что составило 92% от теоретически возможного. 2. Какой объем углекислого газа будет получен при взаимодействии 25г мела, содержащего 15% примесей с соляной кислотой, если выход газа составил 87% от теоретически возможного. 3. Какой объем воздуха (содержание кислорода 21%) потребуется для окисления алюминия, если было получено 3г его оксида, что составило 98% от теоретического выхода. Осуществить цепочки превращения. 1. Na →Na2O2 → NaCl ↓ Na2O 2. Al2O3 → Al → Al(OH)3 → NaAlO2 3. Fe2O3 → Fe → FeCl2 → FeCl3