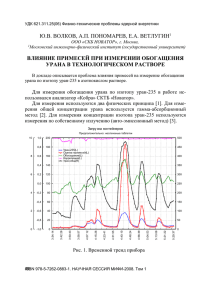
Министерство образования и науки РФ Государственное образовательное учреждение высшего профессионального образования
реклама

Министерство образования и науки РФ Государственное образовательное учреждение высшего профессионального образования Национальный исследовательский Томский политехнический университет Курс профессиональной переподготовки Технологии урановых добывающих и перерабатывающих предприятий Получение оксидов урана. к.т.н., доцент кафедры ХТРЭ Николай Степанович Тураев ВОССТАНОВЛЕНИЕ ВЫСШИХ ОКСИДОВ УРАНА ДО ДИОКСИДА УРАНА Диоксид урана обычно получают восстановлением высших оксидов газообразным реагентом: водородом, оксидом углерода, аммиаком. Изменение свободной энергии Гиббса при реакции оксидов урана с этими восстановителями приведено в таблице Изменение свободной энергии при восстановлении оксидов урана При 700оС константы равновесия 1, 2, 3, 4, 5 и 6 реакций составляют соответственно 6,66106; 6,19106; 4,11109; 1,38103; 1,635104 и 3,68105. Можно считать все реакции необратимыми. Из таблицы видно, что с термодинамической точки зрения выгоднее восстанавливать триоксид урана. Несмотря на благоприятные термодинамические показатели аммиак является менее эффективным восстановителем, чем водород. Вероятно это связано с необходимостью предварительного разложения аммиака. При низких температурах оксид углерода – термодинамически более сильный восстановитель, но с повышением температуры различие между водородом и оксидом углерода сглаживается, а для восстановления триоксида урана выше 700оС более сильным восстановителем является водород. Учитывая более низкую стоимость водорода, становится понятным, почему в промышленной практике в качестве восстановителя используется почти исключительно водород. КИНЕТИКА ВОССТАНОВЛЕНИЯ ВЫСШИХ ОКСИДОВ УРАНА ВОДОРОДОМ Кинетические характеристики процессов восстановления высших оксидов урана зависят от многих факторов: температуры, парциального давления водорода, состава исходного оксида урана, от физических свойств исходного оксида. Скорость восстановления определяется более всего температурой. В таблице приведены кинетические данные восстановления закисиокиси урана, полученной ступенчатым прокаливанием пероксида урана при 250–300о С до UO30,5H2O, а затем при 800оС – до U3O8, парциальное давление водорода 400 мм.рт.ст. Зависимость скорости восстановления закиси-окиси урана водородом от температуры Вначале скорость восстановления резко возрастает с повышением температуры, но начиная с 650оС, скорость реакции мало зависит от температуры. Поэтому на практике процесс восстановления ведут при 650–700о С. На рисунках на следующем слайде приведена зависимость скорости восстановления закиси-окиси урана от температуры и степени восстановления при парциальных давлениях водорода 50 и 200 мм.рт.ст. Зависимость скорости реакции восстановления закиси-окиси урана от температуры и степени восстановления (парциальное давление водорода рт. ст.). Зависимость скорости реакции восстанов-ления закиси-окиси урана водородом от температуры и степени восстановления (парциальное давление водорода рт. ст.). Как видно из рисунков, при давлении водорода 200 мм.рт.ст. и температуре 600оС и ниже начальный этап восстановления протекает с некоторой постоянной скоростью. При 600 и 500оС постоянство скорости сохраняется до образования продукта состава UO2,55, а при 450оС – до UO2,62. После этого скорость процесса падает. Падение скорости продолжается до образования , затем процесс идет с некоторой новой постоянной скоростью до образования продукта состава – UO2,3–UO2,28. На последнем этапе восстановления скорость постепенно падает практически до нуля. При 650оС процесс начинается с максимальной скоростью, которая постепенно уменьшается до достижения состава UO2,45. Последующие этапы аналогичны уже рассмотренным. При давлении водорода 50 мм.рт.ст. и температуре 650оС и ниже в начале восстановления скорость возрастает по мере развития процесса, затем восстановление протекает с некоторой постоянной скоростью, в дальнейшем процесс идет также, как при давлении водорода 200 мм.рт.ст. При 700оС процесс протекает с постоянной скоростью до достижения степени восстановления 70%, а затем резко замедляется. Кажущаяся энергия активации при давлении водорода 200 мм.рт.ст. при степени восстановления 40% и 10% составляет соответственно 86,3 и 89,7 кДж/моль. При давлении водорода 50 мм.рт.ст. и степенях восстановления 40% и 15% кажущаяся энергия активации составляет 63,7 и 72,9 кДж/моль. На рис. 9.4 показано значительное влияние на скорость процесса восстановления закиси-окиси урана парциального давления водорода. Зависимость скорости реакции восстановления закисиокиси урана водородом от парциального давления водорода и от степени восстановления при различных значениях парциального давления (мм рт. ст.); температура 600 0С. Давление водорода выше 300–400 мм.рт.ст. сравнительно мало сказывается на начальной скорости процесса. «Фазовые» превращения в процессе восстановления при 500оС и выше отвечают схеме, где xмакс= 0,14-0,16. U3O8 UO 2,6 x U 4O9 UO 2 x UO 2 Переход U3O8 в фазу UO2,6x совершается в кинетическом режиме, лимитирующей стадией является поверхностная реакция между адсорбированным водородом и кислородом оксида. Скорость этой реакции пропорциональна концентрации водорода и кислорода на поверхности оксида. Концентрация адсорбированного водорода зависит от адсорбционной способности поверхности оксида, которая чрезвычайно чувствительна к структурным нарушениям в кристалле. В процессе отщепления кислорода от оксида нарушается упорядоченная структура кристалла и непрерывно образуются новые активные центры, что способствует увеличению концентрации водорода на поверхности оксида и увеличению скорости поверхностной реакции. В то же время уменьшается концентрация кислорода в поверхностном слое оксида, что вызывает уменьшение скорости поверхностной реакции. Следовательно, одновременно действуют два фактора в двух противоположных направлениях. В самом начале восстановления решающее значение имеет увеличение числа активных центров, образование которых происходит по цепному механизму. Поэтому скорость поверхностной реакции, а следовательно и суммарная скорость процесса восстановления возрастают по мере увеличения степени восстановления. Это хорошо заметно при давлении водорода 50 мм.рт.ст., при 200 мм.рт.ст. этот этап протекает чрезвычайно быстро и на графике практически не заметен. В известный момент времени действие двух указанных факторов уравновешивается и процесс начинает протекать с постоянной скоростью. Увеличение числа активных центров на поверхности оксида может происходить только до определенного значения, после чего наблюдается их стабилизация. Концентрация же кислорода в оксиде по мере развития процесса непрерывно уменьшается, что объясняет тот факт, что конечные этапы восстановления фазы (постепенный переход в фазу ) во всех случаях протекают с уменьшающейся скоростью. Вторые горизонтальные участки кривых соответствуют переходу UO2,6-xмакс. U4O9. Этот переход совершается с постоянной скоростью в кинетическом режиме. На этом этапе скорость восстановления пропорциональна давлению водорода. В условиях кинетического режима наличие зависимости скорости процесса от давления водорода указывает на определяющую роль поверхностной реакции. Последний этап восстановления (переход U4O9 в фазу UO2+xмакс) протекает в диффузионном режиме, определяющей стадией, повидимому, является диффузия кислорода к месту осуществления поверхностной реакции. На этом этапе не происходит значительных изменений в структуре кристаллической решетки и отщепление кислорода должно идти постепенно. Поэтому скорость реакции на данном этапе падает по мере развития процесса. Восстановление оксида урана состава U4O9 водородом при 400– 600оС и PH2=200–500 мм.рт.ст. протекает до UO2,02±0,02. При этом образуется кристаллическая решетка диоксида урана типа флюорита. Промежуточный продукт восстановления имеет нестехиометрический состав UO2,02+x, где 0,1x0,06. Константа скорости восстановления эмпирическому уравнению: К отвечает E К k f (p) exp RT где k – постоянный множитель; f(p) – некоторая функция давления водорода, для 0,7 f ( p ) P восстановления U4O9 водородом уменьшением H2 показателя степени с увеличением давления; Е – энергия активации, для восстановления Е=10513 кДж/моль. Скорость восстановления закиси-окиси урана водородом зависит от размера кристаллов, с уменьшением размера частиц скорость процесса, как правило, увеличивается, лишь для самых тонких порошков этот эффект не всегда заметен вследствие частичного спекания оксидов урана (см. табл. На следующем слайде). Зависимость скорости восстановления закиси-окиси урана водородом от среднего размера кристаллов при PH2=400 мм рт.ст. Скорость восстановления триоксида урана до диоксида водородом определяется теми же факторами: температурой, парциальным давлением водорода, физическими характеристиками оксида. На рис. следующего слайда отражено влияние температуры и парциального давления водорода на скорость восстановления триоксида урана. Влияние температуры и степени восстановления триоксида урана на скорость ее восстановления водородом. Парциальное давление водорода 200 мм рт. ст Изменение степени восстановления триоксида урана во времени при различных парциальных давлениях водорода. Температура 4000С. Во-первых, можно заметить, что скорость восстановления триоксида урана гораздо выше, чем закиси-окиси. При 500оС в начальный период скорость восстановления закиси-окиси составляет 0,6% за минуту, в то время как скорость восстановления триоксида – 16% за минуту. При всех температурах и давлениях водорода начальный этап восстановления протекает с постоянной скоростью. Величина этих участков увеличивается с ростом температуры при постоянном давлении и с увеличением давления при постоянной температуре. При неизменной температуре зависимость скорости процесса от парциального давления водорода на этом этапе описывается уравнением: 1/ 2 V K PH 2 Энергия активации процесса на этом участке 87 кДж/моль. После горизонтального участка скорость процесса резко падает, конечный этап восстановления характеризуется также постоянной скоростью. Исключение представляют данные, полученные при 500оС и мм.рт.ст. Здесь после второго горизонтального участка на кривой имеется еще участок с уменьшающейся скоростью процесса по мере дальнейшего восстановления. На первых горизонтальных участках происходит восстановление UO3 до U3O8. Лимитирующей стадией на этом этапе восстановления является поверхностная реакция между водородом, адсорбированным на поверхности, и кислородом оксида. Адсорбция водорода на поверхности триоксида урана протекает достаточно быстро, причем изотерма адсорбции выражается уравнением 1/ 2 a K PH 2 . Появление показателя степени 1/2 объясняется тем, что молекулы водорода диссоциируют на атомы. Скорость же поверхностной реакции между адсорбированным водородом и кислородом оксида прямо пропорциональна концентрации водорода на поверхности оксида, так как концентрацию кислорода в начальный период можно считать постоянной. Поскольку эта стадия является лимитирующей, то суммарная скорость процесса восстановления пропорциональна давлению водорода в степени 1/2, K' – константа адсорбции. Участки кривых, на которых скорость уменьшается с увеличением степени восстановления, соответствуют переходу закиси-окиси урана в фазу UO2,6+x с минимальным при данной температуре содержанием кислорода. Падение скорости объясняется уменьшением концентрации кислорода в оксиде. Вторые горизонтальные участки соответствуют восстановлению фазы UO2,6x до тетрагональной фазы. Лимитирующей стадией на данном этапе восстановления является адсорбция водорода на поверхности оксида, суммарная скорость восстановления здесь пропорциональна парциальному давлению водорода в первой степени. Кажущаяся энергия активации при 70% восстановления равна 126 кДж/моль. Восстановительные процессы связаны с изменением размера кристаллов; прокаливание триоксида урана в водороде во всех случаях приводит к измельчению частиц, то же наблюдается при восстановлении закиси-окиси. Переход же триоксида урана в закись-окись сопровождается укрупнением кристаллов. Н2, 700оС UO2(NO3)2·6H2O UO2 (d=0,33 мкм) UO3 (d=0,59 мкм) Воздух, Н U O (d=2,3 мкм) 2 о UO2 (d=0,85 мкм) 800-900оС 3 8 700 С (NH4)2U2O7 воздух UO (d=0,08 мкм) UO2 (d=0,03 мкм) 3 300оС 700оС (NH4)2U2O7 воздух U O (d=0,48 мкм) UO2 (d=0,38 мкм) 3 8 800-900оС 700оС здесь – ḋ средний размер кристаллов. Определенное влияние на скорость восстановления триоксида урана оказывают примеси, присутствующие в оксиде. Процесс восстановления значительно ускоряется в присутствии сульфатиона до его концентрации 0,15%; это объясняется либо напряженным состоянием решетки триоксида, либо разрывом сформированных кристаллов. Другие примеси, например, натрий, калий и кальций (до 0,05%), а также железо и алюминий (до 0,3%) практически не вызывают изменения реакционной способности триоксида урана. Обширные экспериментальные данные по восстановлению триоксида урана водородом могут быть представлены в форме интегральных уравнений, используемых для расчета аппаратов восстановления. В частности, восстановление триоксида урана, получаемого из уранилнитрата, описывается уравнением: (1 )1/ 3 1 K где – степень восстановления, К – постоянная, включающая в себя константу скорости реакции, – время процесса. Режим восстановления зависит от последующих процессов. Если диоксид урана направляется на получение тетрафторида урана, то триоксид урана восстанавливается водородом при 625 оС. Полученный диоксид урана сохраняет форму сферических агрегатов триоксида размером ~40 мкм, размер отдельных кристаллов ~1 мкм. Если диоксид урана используется для изготовления керамических тепловыделяющих элементов, то триоксид урана восстанавливают при 8000С. При этом получается порошок диоксида урана со средним размером агрегатов 40––60 мкм при размере кристаллов ~0,1 мкм. При холодном прессовании под давлением 3–5 т/см2 получаются таблетки плотностью 5300– 5700 кг/м3. При последующем спекании в атмосфере водорода или аммиака при 1600оС получается материал с плотностью, близкой к теоретической (10,95 г/см3). АППАРАТУРНОЕ ОФОРМЛЕНИЕ ПРОЦЕССА ВОССТАНОВЛЕНИЯ ОКСИДОВ УРАНА Восстановление триоксида урана осуществляется непрерывным методом по следующей технологической схеме конденсатор фильтр UO3 Пыль на регенерацию газодувка Слив Н2О Реактор восстановления Подача водорода Порошок UO2 Технологическая схема восстановления триоксида урана В реакторе восстановления порошок триоксида и электролитический водород движутся противотоком, полученная газовая фаза проходит фильтр для удаления пыли, конденсатор для удаления воды и после этого возвращается в аппарат восстановления. Для непрерывного процесса восстановления триоксида урана применяются реакторы с перемешиваемым слоем и реакторы кипящего слоя. Процесс с перемешиваемым слоем основан на механическом перемещении триоксида урана винтовым шнеком через нагретую трубу, в которую противотоком подают водород. Трубу реактора изготавливают из нержавеющей стали, диаметр аппарата 410 мм, длина 6700 мм, толщина стенки 6 мм. Внутри трубы вращается ленточный шнек со скоростью 1– 10 об/мин. Шнек изготовлен из четырех кусков ленты 6,3х40 мм, для перемещения порошка в шнеке предусмотрены небольшие лопатки. Четырехходовой ленточный винт с лопастями. 1 – лопатки-толкатели; 2 – спиральная лента. Вал мешалки изготавливают из трубы диаметром 150 мм, из нержавеющей стали или инконеля. Часть трубы реактора (5,45 м) находится в электрической печи сопротивления с четырьмя зонами нагрева. Для процесса восстановления триоксида урана в рассматриваемом реакторе важное значение имеют температура восстановления, скорость подачи триоксида и скорость потока водорода. Если температура ниже оптимальной, скорость реакции падает, что приводит к снижению производительности и неполноте восстановления. Если температура выше оптимальной, частицы спекаются, что мешает восстановлению и последующему гидрофторированию. Реакционная способность исходного триоксида урана также влияет на выбор температуры восстановления. Если триоксид обладает высокой активностью, то скорость восстановления при определенной температуре будет высокой, что приведет за счет экзотермичности процесса восстановления к значительному тепловыделению. Так как теплопередача в шнековых аппаратах сравнительно малоинтенсивна, то это может привести к спеканию материала. В этом случае следует снизить интенсивность нагрева печи. Диоксид урана, предназначенный для получения тетрафторида урана, получают при температуре восстановления 650оС во всех четырех зонах реактора. Когда диоксид предназначается для упаковки и хранения, то поддерживают температуру 800оС, чтобы получить менее химически активный продукт. Скорость вращения шнека – около 4 об/мин., время пребывания порошка оксида в аппарате – 1,5 часа, расход водорода в 1,5 раза больше стехиометрического. Реактор кипящего слоя состоит из двух вертикальных труб из нержавеющей стали, смонтированных рядом (рис. 9.9). Порошок триоксида урана из бункера 7 вводят сбоку в первую трубу шнековым питателем 6. Частично восстановленный продукт из первой трубы «переливается» во вторую, где реакция заканчивается. Водород подается параллельно в обе трубы (иногда он разбавляется азотом). Из второй трубы порошок диоксида урана отводится по трубе 10 в циклон 12, где отделяется от газовой фазы и поступает в бункер 13. После дополнительной пылеочистки отходящий газ направляется на сжигание. восстановления поддерживают в пределах 540–620оС, скорость газа 0,24–0,45 м/с. Каждая труба реактора имеет систему нагрева и охлаждения. Трубы обогревают электропечами сопротивления (4). Для охлаждения используются трубки 8, спиралью навитые вокруг каждой трубы, через которые пропускается пар или холодный воздух. Температуру восстановления поддерживают в пределах 540–620оС, скорость газа 0,24–0,45 м/с. Реактор кипящего слоя для восстановления триоксида урана. 1 – патрубок для подачи водорода; 2 – газораспределительное устройство; 3 – патрубок для вывода пара; 4 – электронагреватель; 5 – электродвигатель с редуктором; 6 – шнековый дозатор; 7 – бункер с исходным триоксидом урана; 8 – змеевик для охлаждения реактора; 9 – патрубок для ввода пара; 10 – труба для вывода UO2; 11 – патрубок для вывода газа на пылеочистку; 12 – циклон; 13 – сборник продукта. Реактор кипящего слоя имеет высокую объемную производительность. Так, при суммарной высоте обеих труб 4 м, диаметре 355 мм, объем реактора 0,49 м3, он обеспечивает получение 250–540 кг/час диоксида урана. Шнековый реактор длиной 6,7 м, диаметром 410 мм, объемом 0,84 м3 дает в час 91 кг продукта при 593оС.