Вода - Euroakadeemia
реклама

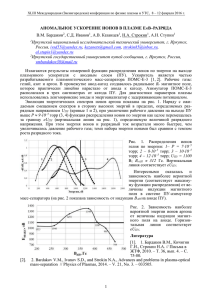
Химия окружающей среды ВОРОБЬЁВ Д., MSC 2015 Лекция 3 Химия воды Состав и классификация природных вод Химия морской воды Гидросфера Гидросфера – это водная оболочка Земли. В гидросферу входят все воды суши, а также воды мирового океана, плюс ледники. Вода Вода – это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (льда) и газа (пара). При нагревании воды от 0о до 4о по шкале Цельсия, вода сжимается. Благодаря этому в регионах с отрицательными зимними температурами воздуха в воде сохраняются пригодные для живых организмов условия. Когда температура падает ниже 4оС, более холодная вода, как менее плотная, остается на поверхности и замерзает, а подо льдом сохраняется положительная температура. Природная вода Природная вода является ничем иным, как раствором. В природе не бывает чистой(без примеси) воды 0,01% - 0,1% массы пресной воды приходится на разного рода примеси. 90 -95 % от общей солености - это соли анионов гидрокарбонатов, хлоридов, сульфатов с катионами металлов калия, магния, натрия и кальция. Морская воды Это раствор Среди катионов в водах Мирового океана преобладающими являются в порядке убывания: натрий — 0,47, магний — 0,053, калий — 0,01, кальций — менее 0,01 моль/л; из анионов: хлор — 0,55, сульфат-анион — 0,028, ионы — 0,003 моль/л. НСО3 Независимо от абсолютных концентраций ионов количественные со-отношения между главными компонентами остаются постоянными. Основные химические элементы, растворенные газы и их классификация компоненты химического состава природных вод делят на пять групп. Растворенные газы: основными является кислород и углекислый газ. Главные ионы (макрокомпоненты) : K+, Na+, Mg++,Ca++, Cl-, SO4--, HCO3-, CO3-Биогенные компоненты : NO3-, NO2- NH4+ PO4-3 SiO2. Микроэлементы : Br, J, Mn, Cu, Ti, B, F, Ba, Li, Ni, Co, Ra и др. Растворенные органические вещества, т.е. органические формы биогенных элементов. Эта группа включает практически все классы органических соединений. Растворенные газы Растворенными газами в природной воде преимущественно являются: кислород и углекислый газ. Углекислый газ выделяется при дыхании, разложении органики, из окружающей среды. Растворенные газы Растворенный кислород находится в природной воде в виде молекул O2. Увеличивают кислород в воде: фотосинтез, поступающие в водоемы, снеговые и дождевые воды, а также абсорбция из атмосферы. Снижают: окисление органических веществ при дыхании организмов, разложение органических веществ, окисление ионов Fe2+, Mn2+, NO2-, NH4+, CH4 , H2S. Скорость потребления кислорода увеличивается с повышением температуры. Концентрация кислорода определяет величину окислительно-восстановительного потенциала водной среды. Для нормального развития рыб необходимо 5 мг/дм3 понижение содержания кислорода до 2 мг/дм3 вызывает массовую гибель рыбы. Макрокомпоненты Хлорид-ионы. Присутствие хлорид-ионов объясняется присутствием в породах наиболее распространенной на Земле соли – хлорида натрия. Часто повышенное содержание хлоридов объясняется загрязнением водоема сточными бытовыми или промышленными водами, в водоемах в городах - обогащением хлоридами поверхностных вод вблизи крупных транспортных магистралей. Макрокомпоненты Сульфат-ионы. Главным естественным источником сульфат-ионов в воде являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы . Значительное количество сульфат-ионов поступают в водоемы в процессе окисления органических веществ растительного и животного происхождения в наземных и водных сообществах. Антропогенные источники сульфатов-ионов в водоемах - это в первую очередь шахтные воды и промышленные стоки производств, в которых используется серная кислота. Сульфаты могут попадать в водоемы также со сточными водами коммунального хозяйства и сельскохозяйственного производства. Растения и бактерии извлекают растворенные в воде сульфаты для построения белкового вещества. Биогенные компоненты Кроме нитрат- и нитрит-ионов, важными биогенными ионами являются ионы аммония. Фосфор и его соединения Азотосодержащие ионы Возникновение Некоторое количество нитратов возникает при электрических разрядах – молниях O3 + NO = NO2 + O2 NO2 + ½ O2 = NO3 2 NO3 + H2O = 2( H+ ) + 2( NO3 - ) 1. При поглощении органикой кислорода образуются углекислый газ, вода, аммиак, который в свою очередь далее участвует в окислительно-восстановительных реакциях, конечным продуктом которых будет азот (промежуточными - нитриты и нитраты). CnHaObNc + (n+a/4 – b/2 – 3c/4 ) O2 = nCO2 + (a/2 – 3c/2)H2O + cNH3 Также засорение водоемов промышленными и хозяйственно-бытовыми отходами способствует увеличению азотосодержащих компонентов. Снижение концентрации нитрат-ионов в воде происходит в процессе потребления их фитопланктоном и денитрофицирующими бактериями. Фосфорные соединения Бывает: Фосфор органический, минеральный и виде полифосфатов Фосфор органический - Природные соединения органического фосфора поступают в природные воды в результате процессов жизнедеятельности и посмертного распада водных организмов, обмена с донными отложениями. Фосфор минеральный. Соединения минерального фосфора поступают в природные воды в результате выветривания и растворения пород, содержащих ортофосфаты (апатиты и фосфориты) и поступления с поверхности водосбора в виде орто-, мета-, пиро- и полифосфат-ионов (удобрения, синтетические моющие средства, добавки, предупреждающие образование накипи в котлах и т.п.), а также образуются при биологическом разложении остатков животных и растительных тканей. Основной формой неорганического фосфора при значениях pH водоема больше 6.5 является ион HPO42- (около 90%). В кислых водах неорганический фосфор присутствует преимущественно в виде иона H2PO4-. Микроэлементы Хром отличается широким разнообразием состояний окисления (от +2 до +6) и способностью формировать комплексные анионные и катионные ионы. Токсичное действие хрома увеличивается с увеличением его валентности . Хром и его соединения находят широкое применение в качестве окислителей при органических синтезах, в синтезе лекарственных средств, в производстве красителей и т.п. Микроэлементы Важные для понимания экологической роли этого элемента химические особенности хрома приведены в уравнениях. В природе хром является распространенным металлом, его оксиды взаимодействуют с органическими веществами, с активными металлами, например с двух валентным железом, где железо повышает свою степень окисления до трех валентного и хром понижается до трех валентного. Его оксид вступает в реакцию с другими окислителями, например, с хлором. Реакция с хлором : 6Cl -+ Cr2O7-2 + 14H+ = 3Cl2 + 2Cr 3+ + 7H2O Реакция с двухвалентным железом : Fe2+ + Cr2O7-2 + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O Реакция с органикой : CnHaObNc + d Cr2O7-2 + ( 8d + c) H + = n CO2 + (a + 8d -3c) / 2 H2O + c NH4+ + 2d Cr3+ Органика в воде Ультрачистая вода обычно производится многоступенчатой обработкой водопроводной воды. Органические соединения в питающей воде бывают естественного происхождения и искусственного. Первое из них представляет собой сложную смесь фульвиновой и гуминовой кислот и танинов, образующихся при разложении листьев и травы или торфяной и болотной сред. Кроме того, в воде присутствуют бактерии, другие живые существа и их продукты жизнедеятельности. Источники искусственных соединений включает отходы производства (моющие средства, растворители и масла) и сельского хозяйства (удобрения, гербициды и пестициды). Комплексные показатели природной воды pH воды - один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ. Классификация природных вод по водородному показателю (рН) сильнокислые воды рН < 3 результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) кислые воды рН = 3...5 поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате слабокислые воды рН = 5...6.5 нейтральные воды рН = 6.5...7.5 слабощелочные воды рН = 7.5...8.5 присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) наличие в водах Ca(HCO3)2, Mg(HCO3)2 то же щелочные воды рН = 8.5...9.5 сильнощелочные воды рН > 9.5 присутствие Na2CO3 или NaHCO3 то же Химия морской воды. Существуют три основных свойства, которые определяют специфику хи-мических процессов морской воды: 1) высокая ионная сила морской воды, связанная с соленостью (концентрацией солей); 2) химический состав морской воды с высоким содержанием ионов натрия и хлора; 3) закон Дитмара, согласно которому количественные соотношения между главными компонентами основного солевого состава всегда постоянны. Соленость морской воды. Соленость воды. Соленость определяется как вес в граммах неорганиче-ских ионов в 1 кг воды. Измеряется по проводимости электрического тока (электропроводности). Воды открытого океана имеют соленость порядка 32–37 г/л. Плотность поверхностной соленой воды 1,028 г/см3 при 0 ºС. На глубине плотность выше. Например, на глубине 5 км плотность 1,05 г/см3, т. е. не на-много больше, чем на поверхности, хотя давление достигает 500 атм. Морская вода, содержащая 3,5 % солей, не имеет температурного максимума плотности, что является одним из ее важных отличий от пресной воды. Чем морская вода холоднее, тем тяжелее, вплоть до температуры –2 °С, когда в ней появляются кристаллы льда. Соленость морской воды Соленость морских вод различна: Балтийское море — 5 г/л, Черное море — 18 г/л, Красное — 41 г/л, Мертвое — 260–310 г/л. Соленость и ионный состав морской воды оставались примерно постоян-ными в течение последних 900 млн лет. Эти данные были получены при изучении древних морских отложений — эвапоритов. Эвапориты — это соли, которые выпали в результате испарения воды в бассейнах, отрезанных от открытого океана. Ионная сила морской воды. Ионная сила. Концентрация ионов солей может быть выражена в виде ионной силы I=1/2Σсizi2 где I — ионная сила; ci — концентрация ионов, моль/л; zi — заряд иона. Размерность ионной силы — моль/л. Морская вода имеет очень высокое значение ионной силы, равное 0,7 моль/л. Речные воды имеют на три десятичных порядка меньше, т. е. 0,5 · 10 моль/л. –3 Активность Свойства морской воды как концентрированной системы существенно отличаются от свойств идеальных растворов. Поэтому в физико-химии морских вод необходимо учитывать снижение реакционной способности ионов путем введения так называемой активности. В теории растворов рас-сматривают термодинамическую активность. На практике применяется более простой подход. Эффективная концентрация ионов вычисляется с помощью коэффициента активности. Активная концентрация равна произведению концентрации, выраженной в моль/л, на коэффициент активности. Морская вода слишком сложная система, чтобы измерить коэффициенты активности всех ионов. Однако для некоторых они известны. Например, для Са коэффициент активности равен 0,26, для карбонат-иона — 0,20. Химический состав неосновных ионов В химии морской воды преобла-дают семь основных ионов. Однако оказалось, что в ней есть и другие ионы и элементы (практически вся таблица элементов Менделеева). Концентрации растворенных металлов достаточно малы — обычно порядка наномоль на литр. Наличие металлов связано с различными источниками. Химический состав неосновных ионов окислительно-восстановительные реакции на океаническом (морском) дне; атмосферные процессы; привнесение ионов металлов с речной водой. В настоящее время эти процессы активизировались в связи с антропогенной деятельностью (сжигание угля, плавление металлов). Химизм растворенных в воде металлов подразделяется на три класса, описывающие поведение их в процессах химического круговорота: консервативный класс; поведение по типу питательных веществ; класс реакций выноса (извлечения). Химический состав и круговорот ионов В открытом океане происходят глобальные химические циклы. Привнос ионов в морскую воду определяется тремя источниками — это реки, атмосфер-ные осадки и гидротермальные источники. Для химического круговорота глав-ных ионов в морской воде важным индикатором процессов являются времена пребывания ионов. Эти времена пребывания очень продолжительны и состав-ляют от 1 000 лет до 100 млн лет. Расчет времени пребывания основывается на предположении, что основным источником ионов, которые привносятся в океан, являются реки и второстепенные источники — это привносы из атмосферы и гидротермальные воды из океанических горных хребтов. Вынос ионов. К основным процессам удаления ионов относят: выброс ионов в атмосферу (потоки «море — воздух»); процессы отложения в виде эвапоритов, химического осаждения карбо-натов, абиогенного осаждения карбонатов кальция, опаловых силикатов, сульфидов; гидротермальную циркуляцию морской воды через срединные океанические хребты. Потоки «море — воздух» Потоки «море — воздух» у главных ионов вызваны разрывами пузырей и ударами волн на поверхности моря. В результате морские соли выбрасываются в атмосферу, основная их часть немедленно падает обратно в море. Другая часть переносится на большие расстояния и попадает в речную воду. Считается, что эти переносимые по воздуху морские соли имеют такой же относительный ионный состав, что и морская вода. С точки зрения глобальных запасов пе-реносимые по воздуху морские соли являются важным стоком из морской воды только для K и Сl . + – Эвапориты. Эвапориты. Испарение воды способствует осаждению составляющих ее со-лей, так называемых эвапоритных минералов. Осаждение начинается с наименее растворимых солей и заканчивается наиболее растворимыми. Когда испаряется 55 примерно половина (47 %) объема воды, выпадает СаСО3. Затем при приблизи-тельно четырехкратном увеличении солености выпадает СаSО4 · 2Н2О (гипс). Когда испаряется около 90 % воды, при концентрациях растворенных солей около 220 г/л выпадает NaСl. Затем начинают кристаллизоваться некоторые соли магния (Мg2+). Если процесс испарения продолжается, выпадают высокорастворимые соли калия (K+). В настоящее время процесс накопления эвапоритных минералов в значительной степени слабее, чем в доисторические времена. Гидротермальная циркуляция Гидротермальные реакции как источники главных ионов играют сравнительно небольшую роль. Химия гидротермальных флюидов показывает, что взаимодействия «базальт — морская вода» в районах горячих источников являются источником некоторых элементов Са2+ и силика-тов, которые отрываются от океанической коры и впрыскиваются в морскую воду. Кальций выщелачивается, по-видимому, из кальциевых полевых шпатов (анортита), тогда как силикаты могут выщелачиваться из любого разрушающе-гося силиката, входящего в состав базальта. Это обеспечивает 35 % поступления этих ионов от объема поступлений с речными водами. Протекают также гидротермальные реакции с участием сульфатов калия. В частности, установ-лено, что осаждение SО4 (в виде ангидрита (СаSО4)) происходит как в коре из нисходящей просачивающейся морской воды, так и на участках гидротермаль-ных выходов. Все эти процессы обеспечивают циркуляцию ионов и таким образом реализуется химический круговорот ионов в природе. Использованная литература Андруз, Д. Введение в химию окружающей среды [Текст] / Д. Андруз, П. Бримблекумб, Т. И. Джикелз, П. Лисс. — М. : Мир, 1999. — 272 с. 2. Астафьева Л. С. 2006. Экологическая химия. -, Издательский центр »Академия», Москва. 3. Голдовская, Л. Ф., 2007. Химия окружающей среды.- Издательство Мир, Москва. 4. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 568 575. Просто о сложном…, 2015: http://prosto-oslognom.ru/chimia/18_chim_reak.html