Министерство образования и науки Республики Казахстан Техническое и профессиональное образование
реклама

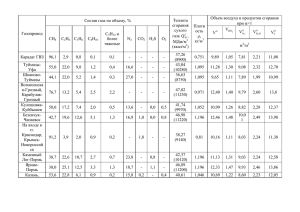
Министерство образования и науки Республики Казахстан Техническое и профессиональное образование Уральский колледж газа, нефти и отраслевых технологий Открытый интегрированный урок по дисциплинам «Прикладная информатика» и «Природные и искусственные газы» в группе МГ-122 специальности 1405000 «Монтаж и эксплуатация оборудования и систем газоснабжения» Тема урока: «Решение задач по дисциплине природные и искусственные газы с помощью табличного процессора MS в Excel» Подготовила: преподаватель информатики Казмагамбетова Катима Гайисовна. Уральск – 2014 г «Решение задач по дисциплине природные и искусственные газы с помощью табличного процессора MS в Excel» Цели урока: 1. Образовательные: - закрепить знание газовых законов термодинамики для изопроцессов, определение объема и упругости насыщенных паров жидких углеводородных смесей путем решения задач; - сформировать у учащихся умение решать химические задачи, используя среду электронной таблицы; - закрепить умения и навыки учащихся: ввод и редактирование данных в таблицу, выполнение расчетов, использование функции автозаполнения, построение графиков и диаграмм в среде Excel. 2. Развивающие: -формирование критического и творческого мышления; -формирование умения практически применять знания, умения и навыки в различных ситуациях; -развивать мыслительную деятельность учащихся. 3. Воспитательные: -формирование в сознании учащихся научной картины мира, самостоятельности и активности в учебном процессе; -использование информационных технологий с целью повышения интереса к изучению информатики и химии. 4. Оборудование: -компьютеры - программное обеспечение: табличный процессор Excel - презентация в среде PowerPoint; - опорный конспект к уроку для учащихся 5. План урока: 1. Организационный момент 2. Актуализация знаний: Информатика и Химия 5. Моделирование решения физической задачи: 6. Анализ и обсуждение решения задачи 7. Нахождение решения задачи с помощью MS Excel 8. Построение с помощью MS Excel графиков и диаграмм, отражающих зависимости различных величин 9. Анализ полученных результатов, графиков и диаграмм 10. Подведение итогов 11. Домашняя работа Ход урока Организационный момент. Учитель химии: Сегодня у нас не совсем обычный урок. Во-первых, в нем соединены два предмета – прикладная информатика и природные и искусственные газы. Сегодня на уроке вы будете решать задачи по химии и анализировать физические процессы, используя среду электронной таблицы. Во-вторых, в рамках реализации проекта, который мы с вами выполняем, данный урок является первым шагом, чтобы показать прикладное значение прикладной информатики при изучении химии. Учитель по прикладной информатике: Эпиграфом к нашему уроку можно взять слова Аристотеля "Ум заключается не только в знании, но и в умении прилагать знание на деле". Сегодня на уроке мы еще раз должны подтвердить эти слова. Но прежде чем мы приступим к основной цели нашего урока - составлению модели решения химических задач, немного повторим вопросы химии и прикладной информатики. Актуализация знаний: Учитель химии: Так как сейчас мы изучаем "Основы термодинамики", поэтому и задачи будут на применение первого закона термодинамики. Учитель информатики: 1. В чем заключаются возможности табличного процессора MS Excel? Табличный процессор относится к программным средствам, позволяющим автоматизировать табличные расчеты, создавать, редактировать и печатать ведомости. 2. Какого вида информацию можно вводить в ячейки таблицы? Вычислительные возможности табличного процессора MS Excel позволяет создавать любые документы, содержащие текстовые и числовые данные, рисунки, диаграммы. 3. Какие типы данных можно вводить в табличный процессор MS Excel? Табличный процессор MS Excel поддерживает три типа данных: текстовые данные, числовые константы, формулы. 4. Что такое формула? Как записывается формула в ячейку таблицы? Формула представляет собой последовательность значений, ссылок на ячейки, имен, функций или операндов и вычисляют новое значение на основе существующих. Формула всегда начинается со знака равенства «=» 5. В чем отличие относительной и абсолютной адресации? При перемещении или копирование формулы относительные ссылки автоматически обновляются в зависимости от нового положения. Если при копирование формулы необходимо сохранить ссылку на конкретную ячейку, то необходимо использовать абсолютную ссылку. 6. Диаграмм. Как построить диаграмму в табличный процессор MS Excel? Excel позволяет улучшить наглядность представления данных с помощью различных диаграмм. Для создания диаграмм используется МАСТЕР ДИАГРАММ, состоящий из четырех шагов. 7. Перечислите физические и тепловые свойства газов? К физическим свойствам газа относятся –плотность, влажность, вязкость, молярная масса. К тепловым свойствам газа относят – теплоемкость, теплопроводность, теплосодержание и теплота сгорания? 8. Что такое влажность? Влажностью называется содержание в газе водяного пара. 9. Что такое точка росы? Температура при которой газ, находящийся под определенным давлением, насыщен до предела водяными парами называется точкой росы? 10. Что понимают под низшей и высшей теплотой сгорания? Низшей теплотой сгорания топлива называют количество теплоты, выделяющейся при полном сгорания топлива при отсутствии конденсации водяных паров в продуктах сгорания Высшей теплотой сгорания топлива называют количество теплоты, выделяющейся при полном сгорания топлива при условии конденсации водяных паров в продуктах сгорания, образующихся при горении. 11. Что такое горение топлива и почему теплотехнические расчеты производят по низшей теплоте сгорания? Горение - это химическая реакция соединения горючих компонентов топлива с кислородом с выделением теплоты. Потому что температура уходящих газов , отводимых из топливоиспользуемых установок, превышают 1000С, следовательно конденсации водяного пара в продуктах сгорания не происходит, поэтому теплотехнические расчеты выполняют на основе низшей теплоты сгорания топлива. Моделирование решения химических задач Учитель информатики: Так как вам нужно решить химические задачи с помощью Ms Excel, то я напомню вам этапы решения задачи: Этапы решения задачи: 1. Анализ условия, поиск общего решения задачи. 2. Решение задачи с помощью компьютера (MS Excel). 3. Анализ полученных результатов. Задачи перед вами следующие: Следующий шаг в составлении модели решения задачи - это решение задачи с помощью компьютера. На рабочем столе находится файл Задачи по химии.xls, в котором записаны необходимые данные для решения задачи. Необходимо правильно записать формулы для вычисления вышеуказанных величин в соответствующих ячейках. Какой вид адресации мы буем использовать? Почему? Решение задач Задача № 1 Определить упругость насыщенных паров при температурах 20 0С; 35 0С; 400С газовых смесей, состоящих из 70 % пропана, 27 % нормального бутана и 3 % этана. Построить диаграмму упругости паров данной смеси. Решение: По таблице находим t =20 0С рС3Н8=0,85 МПа рС4Н10 =0,21 МПа рС2Н6 = 3,8 МПа 0 t =35 С, рС3Н8=1,26 МПа рС4Н10 =0,34 МПа рС2Н6 = 5,4 МПа t = 400С рС3Н8= 1,43 МПа р С4Н10 =0,39 МПа рС2Н6 = 5,9 МПа Р1= ( 0,7х0,85+0,27х0,21+0,03х3,8) = 0,595+0,056+0,114=0,765 МПа Р2= (0,7х1,26+0,27х0,34+0,03х5,4) =0,882+0,091+0,162=1,135 МПа Р3=(0,7х1,43+0,27х0,39+0,03х5,9) =1+0,10+0,177=1,277 МПа Задача № 2 а) Определить точку росы смеси пропана, изобутана и н-бутана при атмосферном давлении, состоящей из 25% пропана, 55% н-бутана и 20% изобутана. б) Определить точку росы смеси пропана, изобутана и н-бутана при атмосферном давлении, состоящей из 45% пропана, 45% н-бутана и 10% изобутана. в) Определить точку росы смеси пропана, изобутана и н-бутана при атмосферном давлении, состоящей из 35% пропана, 55% н-бутана и 10% изобутана. Задача № 3 Вычислить молекулярную массу бензола, зная, что масса 600 мл его паров при 87°С и давлении 83,2 кПа равна 1,3 г. Решение. Выразив данные задачи в единицах СИ (Р = 8,32.104 Па; V = 6 . 10-4 м3; т = 1,3.10-3 кг; Т = 360 К) и подставив их в уравнение Клапейрона – Менделеева, находим: PV mRT M 3 , отсюда M mRT PV 3 M 18,,332101084 ,63110360 кг / моль 78г / моль . 4 78 10 . 0,29.103 Задача № 4 Имеется смесь газов под давлением 2,94.103кПа. Молярная концентрация первого газа у1 = 0,4; второго у2 = 0,2; третьего у3 =1,3 и четвертого у4 = 0,1.Определить парциальное давление этих компонентов в смеси. Решение. Согласно закону Дальтону pi y i P , Закон гласит: в данном объеме газа при постоянной температуре полное давление смеси газов, равняется сумме парциальных давлений ее компонентов: тогда: р1 = 0,4 . 2,94.103 =1,18.103 кПа р2 = 0,2 . 2,94.103 =0,59.103 кПа р3 = 0,3 . 2,94.103 =0,88.103 кПа р4 = 0,1 . 2,94.103 =0,29.103 кПа _______________________ . 3 Итого Рсм =1,18 10 + 0,59.103 + 0,88.103 + 0,29.103 =2,94.103кПа Задача № 5 Определить плотность, теплоту сгорания, теоретический объем кислорода необходимый для сгорания, объем и состав продуктов сгорания природного газа следующего состава: СН4 - 90,0%; С2Н6 - 3,0%; С3Н8 - 2,6%; С4Н10 – 1,4%; СО2 – 1,0%; N2 - 2,0%. Решение: 1.Плотность при нормальных условиях определяем по формуле: ρ0 = 0,01 (ρ1 V1 + ρ2 V2+…….+ ρn Vn) ρ0 = 0.01(0.717 СН4 + 1.35 С2Н6 + 2.00 С3Н8 + 2.703 С4Н10 + 1.25 N2 + 1.98 СО2) = 0.01(0.717 . 90.0 + 1.35 . 3,0 + 2.00 . 2,6 + 2.703 . 1,4 + 1.25 . 2,0 + 1.98 . 1,0) = 0,82 кг/м3. Ответ: ρ0 = 0,82 кг/м3. 2.Теплоту сгорания (низшую) определяем по формуле: Qн = Σ Qi xi Qн = 0.358 СН4 + 0.636 С2Н6 + 0.91 С3Н8 + 0.88 С4Н10 = 0,38 . 90,0 + 0,636 . 3,0 +0,91. 2,6 + 0,88 . 1,4 = 37,73 МДж/м3. Ответ: Qн = 37,73 МДж/м3. 3. Теоретический объем кислорода при сжигании газа, находим по формуле: V ТO2 = 0,01[ x СmHn ], где x-коэффициент; СmHn , - компоненты горючего газа, % по объему VO2 = 0,01(2СН4+3,5С2Н6+5С3Н8+6,5С4Н10) = 0,01(2.90,0+3,5 . 3,0+5 . 2,6+6,5 . 1,4)=2,126 м3 Ответ: VO2 =2,126 м3 Задача №6. Сжиженный газ состоит из пропана 40%, изо-бутана 25% и н-бутана 35%. Определить парциальное давление компонентов при 400С и состав паровой фазы. Решение. Согласно закону Рауля Pi xi Pi1 упругость паров Рi1 чистых компонентов при 400С равна (см. таблица 5) Рi1 (С3Н8) =1,43МПа, Рi1 (и-С4Н10) =0,55МПа, Рi1 (н-С4Н10) =0,39МПа. Парциальное давление компонентов будет равно: р1 = 0,4 . 1,43 =0,572 р2 = 0,25 . 0,55 =0,137 р3 = 0,35 . 0,39 = 0,136 Р = р1+р2+р3= 0,572+0,137+0,136= 0,845МПа. Далее находим состав паровой фазы по формуле; 1 P y i xi i Pi y1 0.4 1.43 0.676 (67,6%);пропан(С3Н8) 0.845 y2 0.25 0.55 0.162 (16,2%);изобутан(и-С4Н10) 0.845 y3 0.35 0.39 0.162 (16,2%);н- бутан(н-С4Н10) 0.845 Подведение итогов Учитель химии: Давайте проанализируем полученные вами результаты. Как можно охарактеризовать каждый процесс, происходящий с кислородом, используя графики? Какие еще данные можно извлечь, исходя из данных графических зависимостей? О чем свидетельствует диаграмма, полученная вами? Учитель информатики: В чем преимущества и недостатки оформления решения задач с помощью компьютера? Выставление оценок. Домашняя работа. Составьте модель решения следующей задачи с помощью табличного процессора MS Excel: Давление газа под поршнем цилиндра 8·105 Па, а температура 1500С. Какую работу совершает 1 кмоль газа и какая его температура, если газ, нагреваясь изобарно расширился до объема вдвое больше начального. Начальный объем равен 3 л. Спасибо за урок!