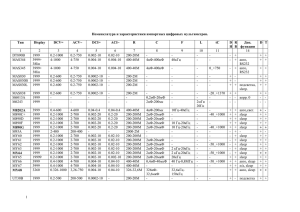
Диетотерапия с применением энтерального
advertisement

Проект Клинические рекомендации Диетотерапия с применением энтерального питания у больных ожирением с синдромом обструктивного апноэ сна Москва 2015 1 Содержание Стр. Разработчики………………………………………………………………………. 3 1. Введение………………………………………………………………………. 4 2. Методология………………………………………………………………….. 5 3. Описание медицинской разработки.……………………………………….. 6 3.1. Диагностика пищевого статуса больных с синдромом обструктивного апноэ сна на фоне ожирения………………………………………………. 6 3.1.1. Клиническое обследование больного и оценка его фактического питания………………………………………………………………. 3.1.2. Оценка композиционного состава тела……………………………. 3.1.3. Оценка показателей метаболометрии……………………………… 8 9 11 3.1.4. Исследование биохимических маркеров пищевого и метаболического статуса …………………………………………... 3.2. Методология диетотерапии больных с ожирением 15 18 3.2.1.Специализированные продукты питания, смеси для энтерального питания рекомендованные для больных с ожирением…………………… 20 3.3. Результаты научно-исследовательской работы……………………… 21 3.4. Сведения о патентовании……………………………………………… 30 3.5. Степень готовности медицинской технологии к внедрению………. 30 3.6. Область применения медицинской технологии……………………. 30 3.7. Реализация в практике……………………………………………….. 30 4. Заключение…………………………………………………………………… 30 Список литературы……………………………………………………………. 31 Приложение……………………………………………………………………… 40 2 Разработчики: Академик РАН, доктор медицинских наук, профессор; директор ФГБНУ «НИИ питания» Тутельян В.А., к.м.н. Богданов А.Р., к.м.н. Дербенева С.А., к.м.н. Богданова А.А., к.м.н. Феофанова Т.Б., к.м.н. Шамшева Д.С., Залетова Т.С. Организация-разработчик: Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт питания» 3 1. ВВЕДЕНИЕ Ожирение представляет собой хроническое заболевание обмена веществ, тесно ассоциированное с рядом метаболических, эндокринологических и сердечно-сосудистых заболеваний, и являющееся одним из самых распространенных неинфекционных заболеваний в мире. Повсеместный рост ожирения приводит к прогрессирующему росту ассоциированных с ним заболеваний. Среди состояний, патогенетически тесно связанных с ожирением, особую роль играет синдром обструктивного апноэ сна (СОАС) – состояние, характеризующееся повторяющимися эпизодами остановок дыхания во сне, возникающими вследствие спадения верхних дыхательных путей, что приводит к рецидивирующим эпизодам ночной десатурации, фрагментации сна и повышенной дневной сонливости. В настоящее время доказана связь СОАС с развитием ожирения, сахарного диабета 2 типа и «преддиабетических» состояний (инсулинорезистентности, гипергликемии натощак, нарушения толерантности к глюкозе), атеросклероза и ассоциированных с нимсердечнососудистых заболеваний, а также с артериальной гипертензией, в том числе рефрактерной к терапии, нарушениями ритма и проводимости сердца, хронической сердечной недостаточностью, внезапной сердечной смертью, эректильной дисфукцией. Золотым стандартом лечения СОАС, в т.ч. у больных с ожирением, является респираторная вентиляционная поддержка в постоянном (CPAP-терапия) или двухуровневом режиме (ВРАР-терапия). Тем не менее, диетотерапия и модификация образа жизни остаются актуальными способами ведения данной категории больных. Комплексная терапия пациентов с СОАС и ожирением, включающая модификацию образа жизни и аппаратные методы лечения (респираторная вентиляционная поддержка) является наиболее предпочтительным способом лечения пациентов с СОАС и ожирением. Основными требованиями к лечебному питанию при ожирении являются: разнообразие рациона, соответствие макро- и микронутриентного состава и энергетической ценности рациона потребностям пациента, дифференцированный подход к диетотерапии в зависимости от степени ожирения, наличия осложнений и сопутствующих заболеваний. Исследования показателей нутриметаболомного статуса у пациентов с ожирением и сопутствующим СОАС немногочисленны, что делает актуальным изучение метаболического статуса и разработку специализированной диетотерапии для этой категории пациентов. В стратегии улучшения качества медицинской помощи больных ожирением важную роль играет своевременная диагностика нарушений пищевого статуса как интегрального показателя, отражающего адекватность обеспечения организма энергией, макро- и микронутриентами, характеризующего компонентный состав тела, обменные процессы на уровне целостного организма, позволяющего оценить риск сопутствующих алиментарнозависимых заболеваний. Многоуровневая диагностика нарушений пищевого статуса у больных ожирением, оценка выраженности метаболических нарушений и стратификация риска развития осложнений ожирения, необходимы для назначения специализированной персонифицированной диетотерапии, что позволит повысить эффективность и безопасность комплексной терапии больных ожирением и оказывать всестороннее воздействие на профилактику возможных осложнений. 4 2. МЕТОДОЛОГИЯ Технология диетологического лечения больных ожирением должна быть основана на оценке их пищевого и метаболического статуса. Для адекватной оценки многофакторных изменений пищевого и метаболического статуса больных с ожирением представляется целесообразным использование многоуровневого методического подхода, включающий в себя клиническое обследование больного и оценку его фактического питания, оценку композиционного состава тела, оценка показателей метаболометрии, исследование биохимических маркеров пищевого и метаболического статуса. Основными этапами оценки статуса питания на основе метаболических данных являются: • оценка отклонений энерготрат, скоростей окисления белка, жира и углеводов от данных по фактическому питанию для каждого пациента; • оценка отклонений энерготрат, скоростей окисления белка, жира и углеводов от нормальных величин для каждого пациента; • сопоставление метаболических данных с данными, полученными в специальных исследованиях (биохимические, иммуноферментные, витаминномикроэлементные исследования); • расчет корректирующего индивидуального рациона с учетом рекомендаций для диетотерапии данной патологии с применением специализированной нутритивной поддержки. Основными признаками нарушения метаболизма по определению являются отклонения энергетического и белкового метаболизма. Энергетические нарушения должны классифицироваться, как нарушения без изменения УСМ, так и с нарушением УСМ. В первом случае расчет лечебного рациона осуществляется путем простой сбалансированной коррекции энергетической ценности рациона, во втором, необходимы дополнительные стандартные исследования гормонального, цитокинного, биохимического, иммунохимического, витаминно-микроэлементного и других показателей статуса в зависимости от назначения врача. Назначение диетотерапии также осуществляется с учетом основных особенностей патогенеза заболевания и характера специальных измерений. Белковые нарушения также корригируются в первую очередь восстановлением нормального энергетического обмена. Однако имеются и самостоятельные, устойчивые нарушения, типа мальабсорбции, вследствие нарушений всасывания, для которых необходима специальная диагностика и применение специальных терапевтических мероприятий. Обычно скорость окисления белка у здорового взрослого человека колеблется в небольшом диапазоне от 15 до 20%, а остальная часть скорости оборота белка приходится на реутилизацию аминокислот. Известно также, что скорость окисления белка соответствует его минимальной суточной потребности (50-65 грамм/сутки). В случаях белковой недостаточности особенно важно соблюдение сбалансированной аминограммы лечебного рациона. Скорость окисления жира (около 90 грамм на 70 кг массы тела) также соответствует его суточной потребности, причем уровень окисления постоянен в периоде покоя и при 5 физической деятельности. Снижение скорости окисления жира в принципе характеризует снижение предстоящей потребности в нем, а с другой – развитию инсулинорезистентности, что требует дополнительных специальных исследований. Вместе с тем усиление окисления жира является хорошим прогностическим признаком при лечении ожирения. Скорость окисления углеводов находится в диапазоне 150-160 грамм/ сутки на 70 кг массы, что составляет около 1/3 от суточной потребности. Отклонения от этой скорости должны рассматриваться специалистами, как признак нарушения углеводного обмена. В целом остается неизменным одно правило: полученные отклонения по скорости энерготрат и скоростям окисления макронутриентов должны быть основой для расчета состава корригирующего лечебного рациона. Показаниями для проведения специализированной диетотерапии СН у больных ожирением являются: наличие характерной клинической картины, признаков кардиального ремоделирования по данным функциональных методов исследования и повышение специфических биомаркеров плазмы крови (альдостерон, ренина, ангиотензин II, натрийуретические пептиды). Энергетическая ценность рациона питания и его химический состав должны рассчитываться с учетом исходного индекса массы тела больного, композиционного состава тела и уровня энерготрат покоя. Недопустимо избыточное снижение калорийности, т.к. это приводит к потере мышечного компонента тела, снижению уровня энерготрат покоя, увеличению риска рецидива заболевания (прогрессирования массы тела) в ранний постстационарный период. Оптимизация химического состава и калорийности диетических рационов осуществляется путем использования в лечебном и профилактическом питании стандартных лечебных диет, специализированных диет для больных ожирением (с модифицированным макронутриентным составом), специализированных продуктов питания (СПП) для энтерального питания, продуктов с заданным химическим составом, а также путем включения в диетотерапию биологически активных добавок (БАД) к пище. Это позволяет улучшить функциональное состояние сердечно-сосудистой системы и всего организма в целом, оказывать профилактическое воздействие на развитие возможных осложнений (в частности синдрома обструктивного апноэ сна). Одна из важнейших целей оптимизации диетотерапии является коррекция композиционного состава тела у больных ожирением и СОАС, что может проводиться путем включения в диету смесей для энтерального питания, содержащих легковсасывающиеся белки и пептиды, сбалансированные по микронутриентному составу. 3. ОПИСАНИЕ МЕДИЦИНСКОЙ РАЗРАБОТКИ 3.1 ДИАГНОСТИКА ПИЩЕВОГО СТАТУСА БОЛЬНЫХ С СИНДРОМОМ ОБСТРУКТИВНОГО АПНОЭ СНА НА ФОНЕ ОЖИРЕНИЯ В настоящее время при эпидемиологических исследованиях состояния питания и здоровья различных популяций, организованных групп населения целесообразным представляется оценка пищевого статуса – стандартного интегрального показателя, учитывающего количественные оценки поступления пищевых веществ (пищевой анамнез или фактическое питание), состава тела и обменных процессов на уровне целостного организма. 6 Как известно, с изменением жизнедеятельности человека изменяется его фактическое питание, количество и качество потребляемой пищи. Изучение статуса питания имеет большую социально-гигиеническую значимость, так как способствует своевременному выявлению групп риска и обнаружению у них предболезненных состояний, обусловленных неправильным питанием. Оценка питания и связанного с ним состояния здоровья личного состава конкретного воинского коллектива позволяют определить необходимость проведения, объем и характер организационных, лечебно-диагностических и гигиенических мероприятий, направленных на предупреждение возникновения и развития заболеваний, обусловленных алиментарным фактором. По классификации Н.Ф.Кошелева (1968), статус питания подразделяется на обычный, оптимальный, избыточный (первой, второй, третьей и четвертой степени) и недостаточный (неполноценный, преморбидный и морбидный). Обычный статус питания, присущий большинству людей, характеризуется отсутствием нарушений со стороны функционального состояния, работоспособности и здоровья в целом, обусловленных неполноценным и неадекватным питанием. Под оптимальным статусом питания подразумевается не только соответствие норме показателей умственной и физической работоспособности, функциональных возможностей организма и состояния здоровья в целом, но и наличие адаптационных резервов, позволяющих эффективно выполнять задачи в экстремальных условиях. Такое состояние питания обеспечивается за счет использования специальных рационов. Избыточный статус питания характеризуется нарушением морфо-функциональных показателей и иммунного статуса организма, обусловленных избыточным поступлением энергии с пищей. Энергетический дисбаланс, наблюдаемый при длительном употреблении пищи в количествах, превышающих потребности, приводит к нарушению обмена веществ, изменению морфологической структуры тканей гипертрофического характера. Следствием этого является избыточное отложение жира в подкожно-жировой клетчатке и внутренних органах, снижение функциональных возможностей и адаптационных резервов организма, проявляющееся в ухудшении работоспособности и здоровья в целом. Недостаточный статус питания характеризуется нарушениями, обусловленными частичным или полным дефицитом поступающей с пищей энергии и отдельных нутриентов, возникающим при количественной или качественной неадекватности питания. В зависимости от вида и степени выраженности выявляемых нарушений здоровья недостаточный статус питания может быть неполноценным, преморбидным и морбидным. Оценка статуса питания как индивидуума, так и группы обследуемых лиц производится на основе сравнения результатов исследования показателей, характеризующих структуру, функции и адаптационные резервы организма, с нормативными величинами для данных категорий с учетом возраста, пола, характера профессиональной деятельности, воздействия факторов окружающей среды, в том числе и экстремальных. Перечень изучаемых показателей статуса питания, набор используемых методов и численность обследуемых лиц определяются, с одной стороны, задачами проводимого исследования, а с другой - уровнем квалификации участвующего в нем медицинского персонала, а также наличием соответствующего оборудования и реактивов. Основная часть исследований последних десятилетий, касающихся изучения пищевого статуса, посвящена синдрому недостаточности питания, когда его оценка является 7 важным прогностическим показателем. Лишь небольшое число популяционных исследований касается оценки пищевого статуса у пациентов без дефицита массы тела. Вместе с тем изучение пищевого статуса в клинической практике у пациентов различной нозологии может быть полезным как при выборе, так и при оценке эффективности дието- и фармакотерапии. Из вышесказанного вполне очевидной становится практическая значимость оценки интегрального показателя состояния питания. Для адекватной оценки многофакторных изменений пищевого и метаболического статуса больных с наиболее распространенными хроническими неинфекционными заболеваниями представляется целесообразным использование многоуровневого методического подхода, который можно разделить на несколько этапов. 3.1.1.Клиническое обследование больного и оценка его фактического питания. Описание клинического и функционального обследования больного с целью верификации диагноза хронической сердечной недостаточности не является целью настоящих рекомендаций, и поэтому опущен. Изучение характера питания больных различных нозологий – важнейший этап оценки пищевого статуса больного, являющийся основой для расчетов потребления пищевых веществ и энергии, оценки адекватности питания, выяснения роли алиментарного фактора в развитии и прогрессировании хронических неинфекционных заболеваний. Для оценки фактического потребления пищи в клинико-эпидемиологических исследованиях используются различные методы, в том числе метод 24-часового воспроизведения питания, метод регистрации потребляемой пищи в дневнике, метод анализа частоты потребления пищи. Метод непосредственной регистрации (взвешивания) пищи перед употреблением наиболее точен и достоверен, однако трудоемок и может оказать влияние на привычное питание индивидуума. Наиболее широко в клинической практике используются метод 24-часового воспроизведения питания и метод анализа частоты потребления пищи, позволяющий, в частности, оценить фактическое питание, как по частоте потребления пищи, так и по профилю потребления пищевых продуктов. Оценка характера и количества потребляемой пищи за определенный временной период проводится с использованием: специальной карты-вопросника; альбома цветных фотографий продуктов и блюд или их муляжей, стандартизированных по объему и весу; компьютерной программы, основанной на реализации частоты фактического потребления пищи в величины потребления пищевых веществ и энергии. Результаты исследований, проведенных в ФГБНУ «НИИ питания», свидетельствуют о существенных нарушениях питания больных с алиментарно-зависимыми заболеваниями (атеросклероз, гипертоническая болезнь, сахарный диабет 2 типа, ожирение и др.). В частности, у больных сердечно-сосудистыми заболеваниями выявлено повышение в 1,5-2 раза энергетической ценности рациона с преобладанием жиров животного происхождения (39,5% по калорийности/день), повышение в рационе содержания холестерина (510 мг/день) и насыщенных жирных кислот (12,2% по калорийности/день), недостаточное потребление полиненасыщенных жирных кислот (ПНЖК, 7,4% по калорийности/день), пищевых волокон (11,3 г/день), витаминов А (на 34%) и группы В, некоторых макро- и микроэлементов. 8 Наиболее распространенными нарушениями химического состава рационов питания больных СД типа 2 являются избыточное потребление жира (36,8% от общей калорийности), холестерина (490 мг/день), натрия, дефицит в питании ПВ (суммарное потребление клетчатки и пектина менее 10 г/сут), витаминов А, Д и бета-каротина. На фоне снижения общего количества углеводов в домашнем рационе у значительной части больных (47%) выявляется потребление рафинированных углеводов, а у 18% их количество составляет более 20 г/день. Анализ частоты потребления различных групп продуктов больными разных нозологических групп показывает, что у мужчин выявляется большая частота потребления хлеба и круп, овощей, кондитерских изделий, жиров, мясных продуктов и алкогольных напитков. У женщин имеет место большая частота потребления фруктов, рыбы и молочных продуктов. Во всех группах наблюдения отмечается высокий уровень потребления жиров и мясных продуктов при крайне низком уровне потребления рыбы, с возрастом увеличивается потребление хлебобулочных изделий и круп, овощей, молочных продуктов и снижается потребление картофеля и алкоголя. Сопоставление данных о потреблении основных пищевых веществ и энергии с клинико-метаболическими показателями у больных сердечно-сосудистыми заболеваниями позволило выявить наличие положительной корреляции между общей калорийностью рациона и индексом массы тела (r=0,36, p<0,05), общим содержание НЖК в рационе и уровнем общего холестерина в сыворотке крови у женщин (r=0,57, p<0,05), отрицательной корреляции между общим содержание жира и НЖК и уровнем артериального давления (r=0,4, p<0,05; r=-0,38, p<0,05 соответственно). У СД типа 2 выявлено наличие достоверной отрицательной связи между уровнем глюкозы в капиллярной крови и количеством потребляемого животного белка (r=–0,269, p<0,05), положительной связи между уровнем триглицеридов крови и количеством углеводов в рационе (r=0,212, p<0,05), положительной связи между массой тела с количеством углеводов и количеством общего жира ((r=0,212, p<0,05;r=0,264, p<0,05 соответственно). Также выявлена положительная корреляция положительная связь систолического артериального давления с количеством потребляемого натрия (r=0,244 p=0,05) и ИМТ (r=0,374 p=0,01). Таким образом, изучение фактического питания пациентов различных нозологических групп, как важнейшей составляющей оценки пищевого статуса, играет важную роль в выяснении роли алиментарного фактора в развитии и прогрессировании алиментарнозависимых заболеваний (атеросклероз, ГБ, сахарный диабет, ожирение, остеопороз, подагра и др.) и позволяет оптимизировать диетологические подходы в лечении и профилактики наиболее распространенных хронических неинфекционных заболеваний. 3.1.2. Оценка композиционного состава тела. Проводится с использованием как традиционных антропометрических, так и современных методов исследования - биоимпедансометрии и рентгеновской остеоденситометрии. Антропометрические методы включают в себя измерение массы тела, роста, окружности талии (ОТ) и обхвата бедер (ОБ), толщины подкожных жировых складок, окружностей различных частей тела, расчет ряда индексов и соотношений. Масса тела является основной мерой накопления жира в организме и играет важную роль в оценке состояния пищевого статуса. Доступным и информативным показателем 9 оценки массы тела является индекс массы тела. При отсутствии отеков и необычно развитой мускулатуры эта величина прямо коррелирует с количеством жира в организме, со степенью белково-энергетической недостаточности или ожирения. Измерение ОТ, ОБ и расчет их соотношения у больных ожирением позволяет определить тип преимущественного отложения жира (андроидный или геноидный) и оценить риск развития ряда заболеваний: СД 2-го типа, ишемической болезни сердца (ИБС), гипертонической болезни (ГБ) и др. Толщина подкожно-жировых складок, свидетельствующая о величине общего депо жира в организме, может быть измерена калипером, обеспечивающим стандартное давление на складки (10 г/мм2). Наиболее часто практикуется измерение толщины складок в следующих точках: в области трехглавой и двуглавой мышц плеча, в подлопаточной области, над гребнем подвздошной кости, по передней аксилярной линии. Для сопоставления жировой и тощей массы тела толщина жировой складки сопоставляется с окружностью плеча по специальной формуле. Наряду с этим в клинической практике используется ультразвуковой метод, позволяющий в течение 1–2 мин получить достаточно объективные данные о величине подкожно-жирового слоя. Исследования состава тела больных проводятся биоимпедансометрическим методом по стандартной методике с помощью анализаторов («АВС-01» фирмы «МЕДАСС» (Россия) и др.). Основанный на различии электрических свойств биологических тканей биоимпедансный метод позволяет по измеренному импедансу (электрическому сопротивлению) оценить количественно различные компоненты состава тела. Следует отметить особо неинвазивность, хорошую воспроизводимость метода, достаточно высокую точность и достоверность получаемых результатов, а также безопасность и комфортность исследования для пациента. Продолжительность обследования в зависимости от методики и время, необходимое для получения результатов, в целом составляет 5-10 мин. Использование в устройстве анализатора переменного тока низкой амплитуды и высокой частоты не оказывает негативного влияния на здоровье пациента и позволяет, что чрезвычайно важно, проводить многократные исследования состава тела в процессе длительной реабилитации и контролируемого лечебного питания. Исследования состава тела проводят не ранее, чем через 2 часа после приема пище в положение больного лежа на спине. На кожу тыльной поверхности правой кисти и стопы наклеиваются по два одноразовых электрода, к которым прикрепляются клеммы прибора. Руки и туловище и обе ноги не должны соприкасаться. Схема измерения от запястья до щиколотки по одной стороне тела используемая в данной методике наиболее исследована и освещена в литературе, широко применяется в клинике внутренних болезней для мониторинга состава тела при использовании различных вариантов лечебного и профилактического питания, оценки эффективности комплекса лечебных (диетологических, фармакологических, физиотерапевтических) мероприятий в коррекции неблагоприятных изменений состава тела и прогноза развития ряда метаболических нарушений и сопутствующих заболеваний. Биомпедансометрия позволяет анализировать состав тела по следующим показателям: жировая масса тела (кг, % от массы тела) тощая масса тела (кг, % от массы тела) активная клеточная масса (кг, % от тощей массы тела) 10 жидкость (кг) По точности получаемых результатов биоимпедансометрия приближается к данным высокоточного и одновременно дорогостоящего исследования – рентгеновской денситометрии, которая из-за высокой лучевой нагрузки может проводится не чаще одного раза в год. Измерения жировой и тощей массы тела двумя вышеупомянутыми методами дают сопоставимые результаты (коэффициент корреляции от 0,99 до 0,84, p<0,05 в зависимости от индекса массы тела пациента). Результаты, полученные при оценке состава тела с использованием совокупности различных методов исследования, продемонстрировали прямую корреляционную зависимость между толщиной подкожно-жировой складки и жировой массой тела пациентов. Весьма перспективным в настоящее время для оценки состава тела представляется использование метода остеоденситометрии, основанного на прямом измерении физической плотности различных тканей тела. Следует перечислить и другие достаточно информативные методы изучения состава тела: измерение содержания калия с использованием изотопа калия, анализ общего содержания воды методом изотопного разведения, экскреция креатинина с мочой, измерение плотности тела методом гидростатического взвешивания, электрическая проводимость тела, ядерно-магнитный резонанс, компьютерная томография, рентгеноскопия энергии двойного излучения, эхокардиография. Однако в силу высокой сложности и стоимости эти методы значительно реже используются в клинической практике. 3.1.3. Оценка показателей метаболометрии Анализируются показатели основного обмена, дыхательного коэффициента с использованием метода непрямой калориметрии, а также приближенного баланса азота и расчета скоростей окисления различных макронутриентов. Методы исследования энергопродукции могут быть достаточно информативны в рамках комплексного подхода к оценке пищевого статуса, поскольку именно энергетическая целесообразность определяет все многообразие метаболических путей в организме. Известно, что общая энергопродукция складывается из следующих составных частей: основного обмена, специфического динамического действия пищи (пищевой термогенез) и энергии, производимой в процессе физической деятельности. Основным методом исследования на этом этапе является прямая (с помощью метаболических камер) и непрямая калориметрия, основанная на устойчивом взаимоотношении между выделенным теплом и количеством поглощенного кислорода. Существуют стандартные методики определения основного обмена – энергии, выделяющейся в процессе поддержания динамического баланса между катаболизмом и анаболизмом, обеспечивающего сохранение структур клетки и минимального функционирования органов и систем в состоянии покоя. Технология оценки метаболического статуса включает в себя несколько этапов: исходные исследования основного обмена (ОО) и дыхательного коэффициента (ДК); оценка белковой квоты путем измерения приближенного баланса азота; 11 расчет скоростей окисления макронутриентов (белков, жиров и углеводов) с использованием промежуточных показателей небелковых энерготрат и небелкового дыхательного коэффициента; Метод непрямой калориметрии, несмотря на некоторые ограничения, имеет исключительное важное значение для оценки метаболического статуса, поскольку создает возможности не только для измерения энерготрат, но и для оценки скоростей эндогенного окисления белков, жиров и углеводов. Теоретической основой метода являются следующие допущения: все энергообразующие реакции в теле зависят от О2; по измерению поглощенного О2 возможна непрямая оценка энергетического метаболизма; фактор конвертации составляет примерно 4.82 килокалории на 1 л потребленного О2; возможны 2 варианта использования: а) спирометрия в закрытом контуре (спирометр состоит из 100% О2 , поток обеспечивается вдыханием и выдыханием воздуха через спирометр); б) спирометрия в открытом контуре (дыхание производится смесью имитирующей окружающий воздух (20.93% О2 , 0.03% СО2 , 79.04% N2), во вдыхаемом и выдыхаемом воздухе оценивается содержание О2 и СО2; При этом соотношение скоростей продуцируемого СО2к скорости потребленного О2 зависит от используемого субстрата. Это соотношение, известное под названием ДК, в принципе характеризует соотношение окисляемых белков, жиров и углеводов. Пределы значения ДК теоретически колеблются от 0,7 до 1.0. Так, для углеводов ДК =1 согласно уравнению окисления глюкозы: С6Н12О6 + 6 О2 = 6СО2 +6Н2О; ДК= 6СО2 /6 О2 =1.0; для липидов согласно суммарному уравнению окисления жирных кислот: С16 Н32 О2 + 23 О2 = 16 СО2 + 16Н2О; ДК = 16 СО2/23 О2 = 0.7; для белков согласно суммарному уравнению окисления: С72 Н112N2O22S +77 О2 = 63 СО2 +38 Н2О +SO3 +9 CO (NH2)2; ДК = 63/77 = 0.82; Обычно при сбалансированном питании значение ДК в состоянии отдыха находится в районе 0,82. Факторами, которые могут повлиять на величину ДК являются гипервентиляция, интенсивные физические упражнения. ОО - это наименьший уровень энерготрат, необходимых для поддержания жизнедеятельности, включая биосинтезы макромолекул и клеток, дыхание, синтез мочевины, сердечную деятельность и др. ОО зависит от: 1) температуры тела; 2) площади поверхности тела; 3) состава тела; 4) стрессов (как правило, увеличивают ОО); 5) окружающей температуры; 6) состояния питания (голода, недостаточности питания и др.). Измерение ОО обычно проводится в состоянии отдыха, без стрессовой ситуации. Перед измерением больные обычно не питаются 8-12 часов, измерения проводятся при комфортной температуре. Обычно увеличение ОО отмечают при лактации, лихорадке, росте и репарации ткани, снижение – при голодании, пожилом возрасте (голодание снижает мышечную массу и соотношение Т3/Т4). Низкая скорость метаболизма при отдыхе обычно идентифицируется 12 как фактор риска для прироста веса и ожирении при одновременном снижении уровня свободного трийодтиронина. Стандартными значениями ОО считаются: у мужчин – 1.0 ккал/ кг/ час , 0.9 ккал/кг/час – у женщин. Таким образом, метод непрямой калориметрии позволяет оценить величину энергетического обмена в покое и при нагрузке по скорости потребления О 2 и скорости выдыхаемого СО2 . Одним из основных звеньев патогенеза заболеваний является наличие метаболических блоков в процессах обмена веществ на органном или межорганном уровне. Таким образом, оценка метаболического статуса в стадии развернутого заболевания в целом играет лишь вспомогательную роль применительно к стандартному лечению. Тем не менее, для целого ряда заболеваний, например заболеваний включенных в метаболический синдром (ожирение, сахарный диабет 2 типа, ранние проявления атеросклероза и др.) оценка метаболических нарушений играет первостепенную роль. Скорость поступления выдыхаемого СО2, а точнее соотношение выдыхаемого СО2 к вдыхаемому О2 - дыхательный коэффициент (СО2/О2), является показателем, характеризующих структуру энерготрат, и при определенных допущениях, рассмотренных ниже, может характеризовать скорости окисления белка, жира и углевода. Основная трудность в использовании метода непрямой калориметрии хорошо известна и связана со стандартизацией условий измерения энергообмена в состоянии покоя или в состоянии отдыха. Кроме того, наличие гипервентиляции, либо состояния ацидоза может влиять на величину дыхательного коэффициента. Обычно измеряют количество поглощенного О2 и далее по формуле конвертации переводят в энергию. При этом 4.82 ккал соответствуют 1 л потребленного О 2. В открытой системе дыхание обеспечивается окружающим воздухом (20,93%О 2, 0,03 %СО2, 79,04 N). Прибор непосредственно переводит величины объемов О2 и СО2 в величину ОО (обычно используется английская терминология REE - энерготраты в состоянии отдыха) в килокалориях за единицу времени на весь организм. Метод непрямой калориметрии – неинвазивный и доступный метод для определения величин и структуры энерготрат в состоянии покоя, отдыха или нагрузки, позволяющий осуществить индивидуальный мониторинг изменений метаболизма за 24-48 часов до исследования. Конкретные исследования проводились на оборудовании Vmaxspectrum (SensorMedics) в конфигурации со шлемом. Исследуемые с помощью непрямой калориметрии пациенты различаются по составу тела, определяемого методом биоимпедансометрии (тощая, жировая массы), поэтому метаболические параметры следует приводить в соответствие с этими параметрами. В тех случаях, когда количество жира в организме невелико, оправдано приводить основной обмен к тощей массе тела, так как в этом случае корреляция между основным обменом и обезжиренной (тощей) массой организма весьма высока, при большом же содержании жира в организме лучшим стандартом является определение энергетических затрат на 1 кг «сухой массы» тела, считая воду метаболически инертной. Состав тела подвержен циклическим изменениям, что также следует учитывать. Исследование протеиновой квоты необходимо для а) самостоятельной оценки баланса азота в период исследования; б) для оценки скорости окисления белка по показателю 13 экскреции мочевины с суточной мочой; в) для вычета протеиновой квоты из уравнения Вейра (приводится ниже) для оценки скоростей окисления жиров и углеводов. Приближенный баланса азота рассчитывают по формуле баланс азота (г/день) = Nвход - ( Nэкскр. + A3) где Nвход - количество азота, поступившего с пищей , Nэкскр. - количество азота мочевины, выделившегося за сутки, A3 - показатель остальных эндогенных потерь азота к азоту мочевины( при уровне поступления азота 15-16 гр./день А3 численно равно 3.1). В расчетах используется известный коэффициент перевода 6.25, после умножения на который величины азота в граммах получается величина содержания белка в граммах. Реальное измерение баланса осуществляется путем сбора суточной мочи и отбора проб на измерение мочевины мочи с обязательной регистрацией диуреза. Необходим тщательный учет потребленного белка за период сбора мочи. Расчет баланса проводят по вышеприведенному уравнению с использованием коэффициента перевода азота белка в азот мочевины. Уравнением связывающим скорости окисления белков, углеводов и жиров является уравнение Вейра: REE (ккал/сут) = (3.94 * VO2 + 1.1 * V CO2) * 1.44 – 2.17 * АМ* где REE – основной обмен в состоянии отдыха, VCO2 - минутный объем выделяемого СО2 (л/мин), VO2 - минутный объем потребляемого О2 (л/мин), АМ* – азот мочевины, экскретируемый с мочой в течение суток в граммах / сутки, скорректированный на величину баланса азота. В этом уравнении скорректированный член АМ* по сути является скоростью окисления белка, выраженным в ккал/сутки, который может быть переведен в единицу ккал/сутки после деления на коэффициент 4.1. После вычета белковой квоты из общей скорости окисления остается скорость окисления, обусловленная жирами и углеводами (в основном глюкозой и жирными кислотами). Использование небелкового ДК позволяет вычислить пропорции окисляемого жира и углевода в процентах или долях, принимая во внимание то, что ДК при окисление чистой глюкозы составляет 1.0, а триглицеридов - 0.7. После умножения пропорций на величину небелкового основного обмена получаются величины скоростей окисления жиров и углеводов в граммах/сутки или в ккал/ сутки (после умножения на коэффициенты Атвоттера: 1г белка - 4,1 ккал, 1 г жира - 9,3 ккал, 1 г углевода - 4,0 ккал). Таким образом, метод непрямой калориметрии позволяет разграничить структуру окисляемого потока по величине ДК при условии отделения белковой квоты и расчета небелковых энерготрат и может служить в качестве основного метода для оценки предстоящей потребности организма в макронутриентах и энергии. Обычно величины скоростей окисления белка, жира и углевода приводятся на общую массу тела. Однако наиболее информативной характеристикой энергетического обмена является удельная скорость метаболизма (УСМ), получаемая делением величины REE на массу тела (ккал/ кг час). Стандартно принятой величиной УСМ считается величина 1.0 –для мужчин и 0.9 –для женщин. Уровень УСМ характеризует величину энергетических возможностей организма (аналог мощности), а ее снижение расценивается, как тотальное снижение энергетического потенциала или энергетическая недостаточность. Известный смысл имеют и другие производные величины, полученные в антропометрических исследованиях с применением биоимпедансометрии и денситометрии. 14 Так величина скорости окисления жира в расчете на жировую массу дает производную величину, по смыслу характеризующую эффективность утилизации жира, а аналогичная величина скорости окисления белка в отношении к тощей массе дает величину эффективности утилизации (или оборота) белка. Рекомендуемый перечень показателей, характеризующих индивидуальные особенности метаболизма основных пищевых веществ и энергии приводится ниже: ОО (REE) - основной обмен или скорость энерготрат в покое, ккал/сутки; УСМ - удельная скорость метаболизма, ккал/сутки на 1 кг массы тела; СОБ – скорость окисления белка (по скорости экскреции мочевины), грамм /сутки; НЭП – небелковые энерготраты в покое (ЭП – скорость окисления белка, в ккал), ккал/ сутки; УНЭП - удельная скорость небелковых энерготрат, ккал/ сутки на 1кг массы; КОЖ - квота окисляемых жиров (по дыхательному коэффициенту), % ккал от НЭП; КОУ - квота окисляемых углеводов (по дыхательному коэффициенту), % ккал от НЭП; СОЖ - скорость окисления жира (КОЖ * НЭП), грамм/сутки; СОУ - скорость окисления углеводов (КОУ * НЭП), грамм/ сутки; УСОЖ - удельная скорость окисления жира, грамм/ сутки на 1 кг массы; УСОУ - удельная скорость окисления углеводов, грамм/ сутки на 1 кг массы; КУЖ - коэффициент утилизации жира (СОЖ/ жировая масса) - % г/г жировой массы; КУБ - коэффициент утилизации белка (СОБ/ тощая масса) - % г/г тощей массы; Существенным критерием на данном этапе оценки пищевого статуса может служить исследование пищевого термогенеза – повышение энергопродукции организма в ответ на прием пищи за счет активации метаболизма в процессе накопления и утилизации поступивших с пищей энергоемких веществ. По мнению некоторых авторов, нарушения в регуляции пищевого термогенеза, осуществляемой гипоталамусом, являются более важной причиной развития ожирения, чем недостаточный контроль. Величина и направленность изменения пищевого термогенеза могут служить прогностическим тестом при дифференциальной диагностике различных форм ожирения. Оценка пищевого термогенеза, температурной реакции кожи и органов, а также ДК в рефлекторную фазу (первые 5–10 мин после приема пищи), в дополнение к определению основного обмена, может быть ценной составляющей пищевого статуса, так как позволяет наблюдать состояние регуляторных центров энергообмена. Эти исследования целесообразно сочетать с мониторированием сердечной деятельности. Энергопродукция в процессе физической деятельности оценивается чаще всего по табличным данным. 3.1.4. Исследование биохимических маркеров пищевого и метаболического статуса Проводится оценка лабораторных биомаркеров обменных процессов (глюкоза, фруктозамин, гликированный гемоглобин, липидные фракции, общий белок, преальбумин, ретинолсвязывающий белок, трансферрин, глобулины, креатинин, мочевая кислота, показатели витаминного статуса – витамины А, С, Е, В6, минерального и микроэлементного статуса – натрий, калий, магний, кальций, цинк, селен, хром, йод, гормонального статуса – тиреотропный гормон, Т3 и Т4, инсулин, глюкагон и др., функциональные показатели состояния печени – АЛТ, АСТ, ЩФ, билирубин прямой и непрямой, показатели иммунного статуса, антиокислительной системы), которые позволяют выявить доклинические формы 15 нарушения питания и обеспеченности организма пищевыми веществами и энергией, не проявляющиеся внешними клиническими симптомами и методами функциональной диагностики. Методы определения биохимических маркеров пищевого статуса можно подразделить на статические и функциональные. Статические методы включают анализ содержания пищевых веществ или их метаболитов в биологическом материале, который адекватно отражает содержание пищевых веществ во всем организме или той части тела, где обновление запасов пищевого вещества наступает наиболее быстро при недостаточном или избыточном поступлении его с пищей. На результаты и интерпретацию статических биохимических тестов оказывает влияние множество факторов, в том числе суточные колебания концентрации, гормональный статус, инфекционные и воспалительные процессы, применение лекарственных средств и т. д. Функциональные методы включают определение активности специфических ферментов или концентрации специфических компонентов, активность или образование которых зависит от биологических функций пищевых веществ, анализ метаболитовксенобиотиков, накапливающихся при дефиците пищевых веществ, нагрузочные пробы, балансовые исследования, включая методы с использованием стабильных изотопов. Для оценки состояния белкового обмена определяют сывороточный альбумин, общий белок сыворотки крови, белок и азот мочи; при более глубоком анализе – отношение общего азота мочевины к общему азоту мочи, содержание в сыворотке трансферрина, преальбумина, ретинолсвязывающего белка, фибронектина. Жировой обмен характеризуется содержанием общего жира и холестерина крови; при более глубоком изучении – уровнем триглицеридов сыворотки, фракций холестерина. Для оценки углеводного обмена определяют содержание глюкозы, гликозилированного гемоглобина крови, сахара мочи; при необходимости проводят тест на толерантность к глюкозе. Для анализа витаминной обеспеченности определяют экскрецию витамина Сс мочой, содержание фолиевой кислоты, витаминов В2, В12 – по гемоглобину крови, количеству эритроцитов и их морфологии. Эритроциты также являются субстратом для оценки обеспеченности железом и другими макро- и микроэлементами, липидами. Наиболее часто подвергаются анализу сыворотка и форменные элементы крови, достаточно часто анализируются моча и кал, реже – биоптаты тканей, волосы, ногти. В целом для характеристики пищевого статуса определяется до 40 незаменимых нутриентов, включая 13 витаминов, микроэлементы и большое количество связанных метаболитов, ферментов, гормонов. Выбор различных биохимических тестов, как правило, определяется задачами исследования и должен быть адекватным для оценки эффективности как отдельных компонентов пищи, так и диетотерапии в целом. Исследования отдельных биохимических маркеров пищевого статуса, по данным ряда авторов, позволили установить, в частности, более выраженное снижение обеспеченности больных ГБ витаминами В2 и В6 при увеличении тяжести заболевания. Обеспеченность больных ИБС и ГБ природными антиоксидантами, от количественного содержания которых зависит адекватное функционирование неферментной системы антиокислительной защиты (АОЗ), также оказалась низкой и составила в среднем 50–85% от рекомендуемых величин суточной потребности. Основными этапами оценки статуса питания на основе метаболических данных являются: 16 оценка отклонений энерготрат, скоростей окисления белка, жира и углеводов от данных по фактическому питанию для каждого пациента; оценка отклонений энерготрат, скоростей окисления белка, жира и углеводов от нормальных величин для каждого пациента; сопоставление метаболических данных с данными, полученными в специальных исследованиях (биохимические, иммуноферментные, витаминномикроэлементные исследования); расчет корректирующего индивидуального рациона с учетом рекомендаций для диетотерапии данной патологии. Основными признаками нарушения метаболизма по определению являются отклонения энергетического и белкового метаболизма. Энергетические нарушения должны классифицироваться, как нарушения без изменения УСМ, так и с нарушением УСМ. В первом случае расчет лечебного рациона осуществляется путем простой сбалансированной коррекции энергетической ценности рациона, во втором, необходимы дополнительные стандартные исследования гормонального, цитокинного, биохимического, иммунохимического, витаминно-микроэлементного и других показателей статуса в зависимости от назначения врача. Назначение диетотерапии также осуществляется с учетом основных особенностей патогенеза заболевания и характера специальных измерений. Белковые нарушения также корригируются в первую очередь восстановлением нормального энергетического обмена. Однако имеются и самостоятельные, устойчивые нарушения, типа мальабсорбции, вследствие нарушений всасывания, для которых необходима специальная диагностика и применение специальных терапевтических мероприятий. Обычно скорость окисления белка у здорового взрослого человека колеблется в небольшом диапазоне от 15 до 20%, а остальная часть скорости оборота белка приходится на реутилизацию аминокислот. Известно также, что скорость окисления белка соответствует его минимальной суточной потребности (50-65 грамм/сутки). В случаях белковой недостаточности особенно важно соблюдение сбалансированной аминограммы лечебного рациона. Особенностью измерения скорости окисления белка при данной схеме является то, что исследование проводится в первые дни после перевода пациента на стандартный клинический рацион. Это и обуславливает применение корректирующей роли оценки баланса азота для расчета общей скорости окисления белка по уравнению Вейра. Скорость окисления жира (около 90 грамм на 70 кг массы тела) также соответствует его суточной потребности, причем уровень окисления постоянен в периоде покоя и при физической деятельности. Снижение скорости окисления жира в принципе характеризует снижение предстоящей потребности в нем, а с другой – развитию инсулинорезистентности, что требует дополнительных специальных исследований. Вместе с тем усиление окисления жира является хорошим прогностическим признаком при лечении ожирения. Скорость окисления углеводов находится в диапазоне 150-160 грамм/ сутки на 70 кг массы, что составляет около 1/3 от суточной потребности. Отклонения от этой скорости должны рассматриваться специалистами, как признак нарушения углеводного обмена. В целом остается неизменным одно правило: полученные отклонения по скорости энерготрат и скоростям окисления макронутриентов должны быть основой для расчета состава корригирующего лечебного рациона. 17 Комплексная оценка пищевого статуса с использованием различных критериев позволяет подобрать адекватную диетотерапию, учитывающую выявленные нарушения, и в дальнейшем оценить ее эффективность. Дополнительное обогащение стандартной диеты витаминами Е, С, селеном больных ИБС с выявленной ранее низкой обеспеченностью этими нутриентами способствовало более выраженной коррекции нарушений антиокислительного баланса по интегральным показателям – общему и частным антиоксидантным индексам – в отличие от пациентов группы сравнения. Следует отметить, что эти показатели также могут служить дополнительными критериями для оценки пищевого статуса и использоваться в клинической практике при мониторинге различных схем лечебно-профилактического питания. Использование современных компьютерных программ позволяет достаточно быстро получить данные по фактическому расходу энергии и потребности в нутриентах, своевременно выявить недостаток питания, назначить адекватную диетотерапию, осуществить мониторинг состояния пациента и диагностику возможных осложнений. Доказательность медицинской технологии соответствует классу IV согласно приложению 1. 3.2 МЕТОДОЛОГИЯ ДИЕТОТЕРАПИИ БОЛЬНЫХ С ОЖИРЕНИЕМ Наиболее эффективным является умеренное поэтапное снижение массы тела с учетом показателей ИМТ и сопутствующих факторов риска. В настоящее время принята методика постепенного(0,5–1,0 кг в неделю) снижения массы тела в течение 4 -6 месяцев и удержание результата в течение длительного времени, что обеспечивает снижение массы тела на 5 -15% от исходной, преимущественно за счет жировой ткани. (уровень доказательности 1, класс рекомендаций А) Важным принципом диетотерапии при ожирении является индивидуализация питания больных с прогрессирующей формой ожирения с постепенным, длительным изменением характера питания и пищевых привычек. Калорийность диетического рациона рассчитывается индивидуально с учетом массы тела, возраста, пола, уровня физической активности, энерготрат покоя и ряда других факторов. Степень ограничения калорийности определяется также условиями, в которых проводится терапия: стационар, санаторий, амбулаторное лечение. Уровень снижения энергетической ценности рациона в большой степени зависит и от интенсивности трудовой деятельности пациента: для работников преимущественно умственного труда допускается более выраженная редукция калорийности; для людей, занятых тяжелым физическим трудом, значительно меньшая. При назначении гипокалорийного режима следует руководствоваться правилом не начинать диетотерапию с резкого ограничения калорийности. Показателем правильного применения лечебного режима должно служить не только снижение массы тела, но и уменьшение риска развития сопутствующих ожирению заболеваний. При ошибочно заниженной калорийности рациона общее самочувствие больных ухудшается, что выражается появлением резкой слабости, повышенной раздражительности, ухудшении сна. (уровень доказательности 2, класс рекомендаций В) По результатам специальных исследований был установлен предел допустимости ограничения калорийности пищи, который не вызывал нежелательных изменений в обмене веществ, в первую очередь, в белковом обмене. 18 Установлено, что без опасности для процессов жизнедеятельности организма можно ограничивать введение калорий с пищей до 700–800 ккал. Однако, такая диета может назначаться во время лечения в стационаре не более чем на 1 неделю, главным образом больным, резистентным к проводимой традиционной диетотерапии. Для того чтобы калорийность рациона соответствовала потребностям больного с ожирением и обеспечивала снижение массы тела, энергетическую ценность диеты уменьшают поэтапно на 30–50%. Установлено, что даже при минимальной физической активности диета, содержащая 1400–1500 ккал/сут, независимо от состава пищи, обеспечивает снижение массы тела. В настоящее время в лечебно-профилактических учреждениях используются разработанные в ФГБНУ «НИИ питания» диеты с различной степенью редукции калорийности. (уровень доказательности 1, класс рекомендаций А) При составлении любого варианта редуцированных диет, в первую очередь, необходимо соблюдать принцип сохранения сбалансированности питания, касающийся в равной степени содержания макро – и микронутриентов. Основными принципами диетотерапии при ожирении являются следующие: ограничение калорийности диеты (в среднем на 500–1000 ккал в день). Степень калорической редукции определяется индивидуально и зависит от выраженности ожирения, наличия сопутствующих заболеваний, пола, возраста больных, их физической активности и др.; при любой степени редукции калорийности необходимо обеспечить адекватное содержание белка в диете за счет включения в рацион продуктов как животного, так и растительного происхождения; снижение общего количества жира в диете до 30% от энергетической ценности рациона за счет жиров животного происхождения при достаточном введении растительных жиров с обеспечением равного соотношения между насыщенными, моно- и полиненасыщенными жирными кислотами. Для профилактики сердечнососудистых заболеваний диета обогащается полиненасыщенными жирными кислотами семейства омега-3 за счет натуральных продуктов – некоторых сортов рыбы (скумбрия, мойва, палтус) или растительных масел (льняное, соевое). Необходимо обогащать рацион липотропными факторами с достаточным количеством фосфолипидов и серосодержащих аминокислот (творог, треска, судак, яйца, бобовые, гречневая крупа, пшеница, соя); ограничение количества углеводов, особенно рафинированных быстро всасывающихся. Потребность в углеводах обеспечивается, главным образом, за счет продуктов, обладающих невысокой энергетической ценностью и имеющих низкие значения гликемического индекса (овощи, фрукты, зерновые). Чрезмерное ограничение углеводов не оправдано, поскольку при этом увеличивается образование углеводов из белков (глюконеогенез). Кроме того, недостаток углеводов в пище может привести к кетозу, особенно при достаточном содержании жиров. Целесообразно ограничить углеводы в рационе до 200 г в сутки; соотношение основных пищевых веществ в рационе белков : жиров : углеводов должно приближаться к классическому – 1:1:4. 19 ограничение потребления поваренной соли до 5 г/сутки, что определяется высокой ассоциированностью ожирения с развитием артериальной гипертонии. Гипотензивный эффект на фоне ограничения поваренной соли потенцируется обогащением рациона калием за счет растительных продуктов, богатых калием (сухофрукты, бобовые, тыква, кабачки, гречневая и овсяная крупы). нормализация водно-солевого обмена наряду с ограничением поваренной соли необходимо ограничение жидкости в среднем до 1,5–2,0 л в сутки [6]. обогащение рациона витаминами как за счет традиционных продуктов (фрукты, овощи, ягоды, отвар шиповника, растительные масла, орехи), так и диетических продуктов, обогащенных витаминами и β-каротином, а также регулярного применения поливитаминных препаратов; создание чувство сытости путем назначения малокалорийной, но значительной по объему пищи (сырые овощи, фрукты, продукты, обогащенные пищевыми волокнами и др.); частый дробный прием пищи (до 5–6 раз в сутки); исключение из рациона продуктов, возбуждающих аппетит (острые закуски, пряности, приправы и др.); использование контрастных разгрузочных дней (1–3 раза в неделю): белковых (мясных, рыбных, творожных, молочных), овощных, фруктово- ягодных и др.; использование в диетотерапии специализированных пищевых продуктов диетического (лечебного и профилактического) питания, предназначенных для контроля массы тела и снижения риска ассоциированных с ожирением заболеваний. 3.2.1.Специализированные продукты питания, смеси для энтерального питания рекомендованные для больных с ожирением Специализированные продукты питания используются в диетотерапии больных с ожирением в качестве лечебных и профилактических средств для повышения эффективности диетотерапии, профилактики возможных осложнений в ходе диетотерапии, нормализации функционирования сердечно-сосудистой системы. Они могут оказывать свое действие только на фоне соблюдения основных принципов лечебного питания. Специализированными продуктами питания могут быть натуральные природные источники пищи или продукты специально созданные путем обогащения или модификации естественных компонентов питания, путем извлечения или удаления нежелательных компонентов из перерабатываемого сырья, продуктов питания или сочетанием указанных приемов. В качестве специализированных продуктов питания в лечебно-профилактических учреждениях кардиологического профиля могут быть использованы смеси, содержащие основные макронутриенты и микронутриенты в оптимальных соотношениях или в количестве, необходимом для коррекции основных компонентов пищи. Адекватное применение специализированных диетических продуктов и смесей для энтерального и парентерального питания, биологически активных добавок к пище, разработанных с использованием современных технологий является составной частью комплекса диетических мероприятий при кардиоваскулярных заболеваниях. 20 Индивидуальная диета назначается конкретному больному, состояние которого требует исключения из пищевого рациона отдельных пищевых продуктов, формируется индивидуально в соответствии с показателями композиционного состава тела, энергетического обмена и наличия осложнений. Одним из обоснованных путей оптимизации диетотерапии больных ожирением является включение в стандартные диеты специализированных пищевых продуктов в виде смесей для энтерального питания, не только сбалансированных по макро- и микронутриентному составу и адаптированных к функциональному состоянию организма, но и обладающих направленным лечебным эффектом. Энтеральное питание у больных ожирением может применяться с целью эффективной коррекции белково-энергетической недостаточности, а также при необходимости увеличения содержания в рационе конкретного макро- или микронутриента (белка, пищевых волокон, калия). В качестве нутритивной поддержки используются как стандартные, так и специализированные смеси для энтерального питания с модифицированным химическим составов. Дозу и способ введения энтеральных пищевых смесей устанавливает врач в зависимости от клинической ситуации. Таблица 1. Классификация СПП для энтерального питания, рекомендованных для применения в диетотерапии больных ожирением Тип СПП Характеристика Примеры Стандартные смеси Могут использоваться в качестве Унипит, полноценной диеты для перорального Нутриэн Стандарт, дополнительного питания, а также Клинутрен, могут быть введены через зонд в Берламинмодуляр, желудок или тонкую кишку. Нутрикомп Стандарт, Как правило, стандартные диеты Нутрикомпликвид, содержат все необходимые макро- и Нутризон, микронутриенты в соответствии с Нутризон стандарт, суточными потребностями организма МД Мил Клинипит. при патологическом процессе. Полуэлементные смеси Сбалансированные смеси, содержат Пептамен, белковые гидролизаты и Нутриэн, предназначены для энтерального Элементал, питания хирургических и Импакт Орал терапевтических больных различного Resourse 2.0+fibre профиля, имеющих нарушения функций желудочно-кишечного тракта Модули МСТ модуль Содержат отдельные пищевые Протеин модуль, вечества направленного метода. Карнитин модуль, Глютамин модуль, Пектин модуль РЕЗУЛЬТАТЫ НАУЧНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЫ В отделении сердечно-сосудистой патологии клиники ФГБНУ «НИИ питания» было обследовано 422 пациента с различной степенью ожирения. Вошедшие в исследование больные были госпитализированы в отделение сердечно-сосудистой патологии (зав. – к.м.н. 3.3. 21 Богданов А.Р.) клиники ФГБНУ «НИИ питания» (дир. – акад. РАН, проф. Тутельян В.А.) В зависимости от степени ожирения все больные были разделены на три группы: I ст. ожирения (ИМТ 30,0 - 34,9 кг/м2), n=52, II степень ожирения (ИМТ 35,0 - 39,9 кг/м2), n=96, III степень ожирения (ИМТ 40,0 - 49,9 кг/м2), n=274. Учитывая низкую распространенность СОАС при ожирении I степени, в дальнейшее исследование были включены пациенты II и III степени ожирения. Оценка пищевого статуса пациентов включала анализ фактического питания в домашних условиях, оценку показателей композиционного состава тела пациентов методом биоимпедансометрии, оценку лабораторных показателей крови. При анализе фактического питания в домашних условиях у пациентов исследуемых групп нами было установлено, что питание пациентов с ожирением II и III ст. с СОАС характеризуется повышенной калорийностью рациона (3312±201 ккал/сут и 3160,9±152,7 ккал/сут, соотв.), избыточным потреблением жира (164,1±12,3 г/сут и 158,6±9,9 г/сут, соотв.) и углеводов (441,1±81,1 г/сут и 400,4±76,1 г/сут, соотв.), недостаточным потреблением пищевых волокон (10,6±1,1г/сут и 13,6±0,9 г/сут, соотв.). При оценке показателей композиционного состава тела у пациентов обследованных групп было выявлено увеличение относительно нормальных величин содержания жировой массы, скелетно-мышечной массы, а также общей жидкости независимо от наличия СОАС. При анализе биохимических показателей крови нами установлено, что во всех исследуемых группах наблюдалось повышение уровня триглицеридов выше референсных значений. У пациентов с тяжелой ст. СОАС уровень триглицеридов достоверно превысил таковой в группе пациентов с СОАС легкой ст. (2,28±0,15 и 1,78±0,2 ммоль/л, соответств., p<0,05). Уровень мочевой кислоты повышался по мере прогрессирования тяжести СОАС и составил 442,1±10,7 мкмоль/л в группе СОАС тяжелой ст., (достоверно выше, чем в группе СОАС легкой ст. - 395,0±24,7 мкмоль/л, p<0,05). Во всех исследуемых группах уровень гликозилированного гемоглобина превышал референсные значения. Среди пациентов с III ст. ожирения уровень триглицеридов был достоверно выше при наличии СОАС, чем в группе без СОАС (2,2±0,14 ммоль/л и 1,9±0,09ммоль/л, соотв., р=0,019). У пациентов с СОАС и ожирением II и III ст. уровень мочевой кислоты (433,7±17,2 мкмоль/л и 447,9±10,3 мкмоль/л, соотв.) был достоверно выше, чем в соответствующих группах без СОАС (366,6±13,7 мкмоль/л и 419,2±7,86 мкмоль/л соотв., р<0,05). Достоверное повышение уровня мочевой кислоты при СОАС может быть следствием того, что мочевая кислота является фактором антиоксидантной защиты организма и ее увеличение возникает в ответ на выраженный оксилительный стресс при СОАС. Другим возможным объяснением повышения уровня мочевой кислоты может служить развитие эндотелиальной дисфункции у пациентов с СОАС и ожирением, что приводит к прогрессирующему нарушению фильтрационной функции почек. У больных с ожирением III ст. и СОАС уровень инсулина был достоверно выше, чем уровень инсулина в группе контроля без СОАС (30,5±2,7 мкМЕ/мл и 22,7±1,7 мкМЕ/мл, соотв., р=0,012). Развитие инсулинорезистентности у пациентов с ожирением и СОАС связано, в первую очередь, с развитием окислительного стресса вследствие интермиттирующей гипоксии. Кроме того, механизмами, ответственными за нарушение чувствительности тканей к инсулину при СОАС, являются активация вегетативной нервной 22 системы с развитием симато-вагального дисбаланса, повышение уровня глюкокортикоидов, повышенная дневная сонливость, избыточная продукция провоспалительных цитокинов. Таким образом, результаты, полученные нами при анализе биохимических показателей крови у пациентов с СОАС и ожирением, свидетельствуют о наличии у них нарушений различных звеньев метаболизма (белкового, липидного и углеводного обмена). При исследовании показателей основного обмена нами было показано, что у пациентов с СОАС и ожирением II ст. показатели основного обмена были достоверно выше, чем в группе пациентов II ст. ожирения без СОАС (2046±138,0 ккал/сут и 1678±75,6 ккал/сут, соотв., р=0,018); СОЖ составила 141,4±17,6 г/сут и 102±11,6 г/сут, соотв., р=0,04, а СОУ - 126,6±20,1 г/сут и 170,9±24,0 г/сут, соотв., (p<0,05). В группе пациентов с ожирением III ст. и СОАС показатели основного обмена также достоверно превышали соответствующие показатели в группе без СОАС (2430,6±50,6 ккал/сут против 2159,7±51,0 ккал/сут, р=0,01), СОЖ была ( 177,6±7,3г/сут и 130,1±6,46 г/сут, соотв., р=0,05, а СОБ имела лишь тенденцию к повышению (88,6±4,7г/сут против 78,4±2,76 г/сут соотв., р=0,09). Напротив, СОУ была достоверно выше в группе пациентов без СОАС. В группе пациентов III ст. ожирения без СОАС отмечались более высокие показатели СОЖ, чем в группе II ст. ожирения (130,1±6,4 и 102±11,6 г/сут соотв., p<0,05). По скорости окисления других макронутриентов нами не было получено достоверных различий. У пациентов с СОАС показатели основного обмена составили 2430,6±50,6 ккал/сут в группе пациентов с ожирением III ст. и 2046±138,0 ккал/сут - в группе пациентов с ожирением II ст., (p<0,05). Полученные данные также свидетельствуют о достоверном увеличении СОЖ в группе пациентов с СОАС и III ст. ожирения по сравнению со II ст. ожирения (177,6±7,3 и 141,4±17,6 соотв., p<0,05), а также о соответствующем увеличении СОУ (146,1±7,3 г/сут в группе с СОАС и ожирением III ст. и 126,6±20,1 г/сут в группе с СОАС и ожирениемIIст., p<0,05). Таким образом, ожирение в сочетании с СОАС сопровождается выраженными изменениями пищевого и нутриметаболомного статуса пациентов, включая более высокую потребность в энергии по сравнению с пациентами без СОАС, что обосновывает необходимость оптимизации рационов питания у данной категории больных. Нутриметаболомный статус пациентов с ожирением III ст. характеризуется повышением уровня основного обмена и увеличением СОЖ по сравнению с пациентами II ст. ожирения независимо от наличия СОАС. Таким образом, ожирение в сочетании с СОАС сопровождается выраженными изменениями пищевого и нутриметаболомного статуса пациентов, включая более высокую потребность в энергии по сравнению с пациентами без СОАС, что обосновывает необходимость оптимизации рационов питания у данной категории больных. Повышение уровня основного обмена у пациентов с повторяющимися эпизодами апноэ, вероятнее всего, связано с интенсивной дыхательной работой и постоянными микропробуждениями головного мозга, возрастанием симпатической активности и повышением уровня кортизола у этих больных. Снижение СОУ у этих пациентов может быть следствием развития инсулинорезистентности при СОАС, в результате чего глюкоза не используется организмом в качестве энергетического субстрата. Вероятно, повышение СОЖ в этом случае происходит компенсаторно. Современная диетотерапия при ожирении и сопутствующих сердечно-сосудистых заболеваниях базируется на принципах строгого контроля энергетической ценности диеты, 23 количества и качественного состава белка, жира, углеводов, пищевых волокон (ПВ), адекватного содержания витаминов, макро- и микроэлементов, соответствующих потребностям каждого конкретного больного. В настоящее время согласно приказу Минздрава РФ от 5 августа 2003 г №330 «О мерах по совершенствованию лечебного питания в лечебно-профилактических учреждениях Российской Федерации» введена новая номенклатура диет (система стандартных диет). Для больных с ожирением применяется стандартная антиатерогенная диета, имеющая среднесуточную энергетическую ценность 2288 ккал и определенный химический состав (белки – 99,5 г/сут, жиры - 71,5 г/сут, углеводы - 311,8г/сут) (Табл.1,2). Табл.1 Среднесуточное содержание пищевых веществ и энергетическая ценность антиатерогенной диеты Дни недели Белки, г Жиры, г Углеводы, г Понедельник 91,3 79,2 242,7 Вторник 98,6 95,6 234,8 Среда 90,1 82,0 242,8 Четверг 97,3 96,6 210,3 Пятница 83,9 64,0 235,2 Суббота 83,0 60,4 218,4 Воскресенье 94,4 60,7 248,0 Среднее: (за неделю) 91,4 77,1 232,6 + Буфетная продукция 14,5 4,2 110,1 Всего 105,9 81,3 342,7 % потерь при тепловой обработке -6% -12% -9% 99,5 (17% энергии) 71,5 (28% энергии) 311,8 (55% энергии) Итого: Химический состав и энергетическая ценность примерного дня стандартной антиатерогенной диеты представлена в табл.2. Табл.2 Химический состав и энергетическая ценность примерного дня стандартной антиатерогенной диеты Наименование блюда Вес блюда, г Содержание, г белки жиры углеводы 110 9,1 1,5 2,6 170/10 1,8 1,8 14,1 I Завтрак 1.Омлет белковый паровой без соли 2.Салат из моркови и яблок со 24 сметаной 3.Каша пшенная молочная, с маслом сливочным 200/10 8,7 13,1 43,9 4.Кофейный напиток с молоком 130/50 1,4 1,6 2,3 150 0,5 0,5 12,9 250 1,7 2,7 12,1 2.Плов с отварным мясом без соли 55/200 23,0 11,4 46,7 3.Компот из сухофруктов с сахаром 200 0,6 0,2 34,6 1.Отвар шиповника 200 - - - 2.Чернослив размоченный 60 1,1 0,3 26,4 100/60 24,8 6,7 3,6 2.Капуста цветная и брокколи в молочном соусе 190 9,1 9,8 13,7 3.Биточки (запеканка) морковнояблочные 200 5,8 7,7 26,5 130/50 1,4 1,6 2,3 180 5,4 1,8 7,2 94,4 60,7 248,0 II Завтрак 1.Фрукты свежие (яблоки) Обед 1.Суп перловый вегетарианский, без соли Полдник Ужин 1.Рыба отварная, соус «Польский», без соли 4.Чай с молоком На ночь Кефир или йогурт Итого: + буфетная продукция Хлеб ржаной (или с отрубями) 100 6,6 1,2 34,2 Хлеб пшеничный 100 7,7 3,0 50,1 Сахар 25 - - 24,9 Лимон 30 0,2 - 0,9 Итого: 14,5 4,2 110,1 ВСЕГО: 108,9 64,9 358,1 В ходе настоящего исследования нами было установлено, что существующий стандартный рацион для больных ожирением не полностью учитывает энергетические потребности и особенности метаболизма пациентов с СОАС и ожирением, что также было показано ранее [de Jonge L., 2012, Kezirian E., 2008, Ucok K., 2011]. Чрезмерное снижение суточной калорийности рациона при ожирении приводит к снижению уровня основного обмена, что в последующем снижает эффективность 25 диетотерапии [Ravussin E.,1985]. Напротив, умеренное снижение суточной калорийности рациона (на 250-500 ккал/сут) способствует редукции массы тела и снижению сердечнососудистых рисков у пациентов с ожирением [Mayo clinic special report, 2010.]. В связи с этими данными существующий стандартный рацион был модифицирован нами за счет включения СПП для энтерального питания Импакт Орал, Нестле (Швейцария). В упаковке продукта (237 мл) содержится 334 ккал, 18 г белка, 44,8 г углеводов, 9,2 г жира, комплекс витаминов и микроэлементов, 3,3 г пищевых волокон, омега-3 полиненасыщенные жирные кислоты (табл.3). Табл.3 Состав специализированного пищевого продукта для энтерального питания «Импакт Орал» Пищевая ценность Ед. изм. На 100 мл. На 237 мл. Калорийность ккал. кдж. 141 595 334 1410 Белки гр. 7,6 18 включая L-Аргинин гр. 1,8 4,2 включая Нуклеотиды гр. 0,18 0,43 Углеводы гр. 18,9 44,8 Из которых: Моно/дисахариды Лактоза гр. гр. 11,1 0,0 26,3 0,0 Жиры Из которого насыщенные мононенасыщенные полиненасыщенные Омега-3 жирные кислоты, в том числе эйкозапентаеновая (EPA)/ докозагексаеновая (DNA) гр. гр. гр. гр. гр. гр. 3,9 1,8 0,73 1,3 0,6 0,5 9,2 4,3 1,7 3,1 1,4 1,1 Пищевые волокна (растворимые) гр. 1,4 3,3 Натрий мг. 148 350 Калий мг. 190 450 Кальций мг. 114 270 Фосфор мг. 101 240 Магний мг. 32 76 Минералы и микроэлементы 26 Железо мг. 1,7 4 Цинк мг. 2,1 5 Медь мг. 0,25 0,6 Марганец мг. 0,3 0,7 Хром мкг. 14,1 33,3 Молибден мкг. 22,5 53,3 Селен мкг. 6,6 15,6 Йод мкг. 21 50 Витамин А мкг. 139 330 Витамин С мг. 30,5 72,3 Витамин D 3 мкг. 0,94 2,2 Витамин Е мг. 4,2 10 Витамин К мкг. 9,4 22,3 Витамин B 1 мг. 0,17 0,4 Витамин B 2 мг. 0,25 0,6 Ниацин мг. 2,2 5,3 Витамин B 6 мг. 0,21 0,5 Фолиевая кислота мкг. 28 66,7 Пантотеновая кислота мг. 1,14 2,7 Витамин B 12 мкг. 0,8 1,9 Биотин мкг. 10,1 24 Холин мг. 38 89 Витамины Для оценки эффективности комплексной терапии у пациентов с СОАС и ожирением нами было обследовано 90 больных с ожирением III ст. и СОАС, из которых 30 пациентов получали стандартную антиатерогенную диету, 30 пациентов получали стандартную антиатерогенную диету и СПП для энтерального питания в дополнение к основному рациону Оценка эффективности диетотерапии проводилась на 21 сутки стационарного лечения. Анализ показателей метаболического статуса у больных, получавших стандартную антиатерогенную диету, выявил снижение показателей основного обмена относительно исходных значений в динамике наблюдения. Через 21 сут диетотерапии показатели основного обмена снизились до 2276,5±90,6 ккал/сут (относительно 2352,6±68,9 ккал/сут в начале исследования, р=0,069). СОЖ до начала диетотерапии в этой группе составляла 27 162,9±11,8 г/сут; на фоне диетотерапии была отмечено достоверное ее снижение к 21 сут (151,5±13,5 г/сут, р=0,015) относительно исходного уровня. СОБ имела тенденцию к снижению (с 90,1±4,9 до 78,4±4,5 г/сут, р>0,05). Наблюдалась тенденция к увеличению СОУ (с 145,9±14,1 до 161,5±19,2 г/сут, р=0,44) (рис.1). Скорость оксления, г/сут 200 150 До лечения 100 Через 21 день 50 0 Белки Углеводы Жиры Рисунок 1. Динамика показателей метаболометрии в группе больных, получавших стандартную антиатерогенную диету По данным метаболометрии в группе больных, получавших стандартную антиатерогенную диету и СПП, была выявлена тенденция к снижению основного обмена относительно исходных значений (с 2435,8±100,1 ккал/сут до 2300,1±96,1 ккал/сут, р>0,05), достоверное увеличение СОУ (170,0±15,2 г/сут против 149,2±14,1 г/сут, р=0,03); СОБ и СОЖ недостоверно снизились (рис. 2). Рисунок 2. Динамика показателей метаболометрии в группе больных, получавших стандартную антиатерогенную диету+СПП Анализ динамики показателей состава тела пациентов данных групп показал тенденцию к снижению тощей массы, скелетно-мышечной массы и общей жидкости как у пациентов, получающих стандартную антиатерогенную диету, так и у пациентов, 28 получавших СПП (р>0,05). Абсолютное содержание жировой массы у пациентов в обеих группах имело тенденцию к снижению, однако в процентном отношении к общей массе тела положительная динамика отсутствовала (табл.4,5). Табл.4 Динамика показателей состава тела у пациентов, получавших стандартную антиатерогенную диету Показатель Жировая масса, кг Жировая масса, %от общей Тощая масса,кг Скелетно-мышечная масса, кг Общая жидкость, кг До лечения Через 21 сут (n=30) 69,8±2,4 49,3±0,01 71,1±1,6 39,6±0,95 (n=30) 67,7±2,2 50,2±0,01 66,9±1,7 37,3±1,0 52,5±1,3 49,0±1,3 Табл.5 Динамика показателей состава тела у пациентов, получавших стандартную антиатерогенную диету+СПП Показатель До лечения Через 21 сут (n=30) (n=30) Жировая масса, кг 68,9±2,1 67,0±2,2 Жировая масса, %от общей 50,3±0,01 50,5±0,01 Тощая масса,кг 72,9±1,9 67,3±1,4 Скелетно-мышечная масса, кг 36,9±1,2 35,1±1,1 Общая жидкость, кг 55,9±1,7 52,0±2,3 Показатели основного обмена и биоимпедансометрии у пациентов, получавших различные виды диетотерапии, на 21 сут наблюдения достоверно не различались. Таким образом, применение стандартной антиатерогенной диеты у больных СОАС и ожирением III ст. приводит к недостоверному снижению уровня основного обмена и достоверному снижению скорости окисления жиров к 21 сут диетотерапии на фоне недостоверного увеличения скорости окисления углеводов. Применение СПП для энтерального питания в дополнение к основному рациону у больных с ожирением III ст. и СОАС приводит к недостоверному снижению уровня основного обмена и скорости окисления жиров к 21 сут диетотерапии и достоверному увеличению скорости окисления углеводов без снижения эффективности диетотерапии и степени снижения жирового компонента. 29 Суммируя все вышесказанное, можно заключить, что применение системы высокотехнологичной поликомпонентной диагностики нутриметаболомного статуса, позволяет на качественно новом уровне оценить нарушения пищевого статуса больных ожирением и СОАС, разработать методологию и провести специализированную комплексную коррекцию выявляемых нарушений клинико-метаболического статусов для повышения эффективности проводимых лечебно-профилактических мероприятий при данных патологиях. 3.4. СВЕДЕНИЯ О ПАТЕНТОВАНИИ: нет 3.5. СТЕПЕНЬ ГОТОВНОСТИ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ К ВНЕДРЕНИЮ Медицинская технология может быть внедрена в практику лечебнопрофилактических учреждений Российской Федерации в виде методических рекомендаций по диетотерапии пациентов с ожирением и синдромом обструктивного апноэ сна. 3.6. ОБЛАСТЬ ПРИМЕНЕНИЯ МЕДИЦИНСКОЙ ТЕХНОЛОГИИ Здравоохранение: внутренние болезни, диетология, терапия, кардиология, обучение студентов высших медицинских учебных заведений, курсантов сертификационных и тематических циклов усовершенствования и специализации врачей по диетологии и нутрициологии. 3.7. РЕАЛИЗАЦИЯ В ПРАКТИКЕ Клиника ФГБНУ «НИИ питания», кафедра диетологии и нутрициологии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, кафедра диетологии и нутрициологии ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России. 4. ЗАКЛЮЧЕНИЕ Таким образом, результаты позволяют заключить следующее: разработки настоящей медицинской технологии Энергетическая ценность рациона питания и его химический состав должны рассчитываться с учетом исходного индекса массы тела больного, композиционного состава тела и уровня энерготрат покоя. Оптимизация химического состава и калорийности диетических рационов осуществляется путем использования в лечебном и профилактическом питании специализированных продуктов питания (СПП) для энтерального питания, продуктов с заданным химическим составом. Это позволяет улучшить функциональное состояние сердечно-сосудистой системы и всего организма в целом. 30 ЛИТЕРАТУРА 1. Батурин А.К. Особенности витаминного статуса у мужчин и женщин с сердечнососудистыми заболеваниями и ожирением / Батурин А.К. [и др.] // Вопросы питания. – 2012. Т. 81. № 4. - С. 58-64. 2. Богданов А.Р. Показатели метаболометрии у больных с заболеваниями сердечнососудстой системы и ожирением/ Богданов А.Р. [и др.] // Доктор.Ру. - 2012. - №10(78). -C. 17-23. 3. Богданов А.Р. Показатели метаболизма и маркеры сердечно-сосудистого риска у больных с различной степенью ожирения/ Богданов А.Р. [и др.] // Доктор.Ру. - 2013. № 2 (80). - С. 31-38. 4. Богданов А.Р.Изучение состояния сердечно-сосудистой системы у больных с избыточной массой тела и ожирением/ Богданов А.Р. [и др.] // Вопросы питания. - 2012. - Т. 81. № 1. - С. 69-74. 5. Бузунов Р.В. Храп и синдром обструктивного апноэ сна у взрослых и детей. Практическое руководство для врачей /Бузунов Р.В. [и др.], Москва, 2012. 6. Васильев А.В. Методические подходы к оценке пищевого статуса /Васильев А.В., Хрущева Ю.В. // Клиническая диетология. – 2004. - №1. – С.4-13. 7. Голубева А.А., Сильвестрова Г.А. Лечение нарушений сердечного ритма и проводимости при синдроме обструктивного апноэ сна /Голубева А.А., Сильвестрова Г.А. // Лечебное дело.-2010. - №3. - С.91-96. 8. Дербенева С.А. Особенности функционального статуса сердечно-сосудистой системы у больных ожирением / Дербенева С.А. [и др.] // Медицинская наука и образование Урала. 2012. - Т. 13, № 1. -С. 126-129. 9. Курлыкина Н.В. Брадиаритмии во время сна: связь с синдромом обструктивного апноэ и влияние терапии постоянным положительным давлением: автореф. дис. … канд.мед.наук : 14.00.06 / Курлыкина Н.В. –М., 2009. 10. Литвин А.Ю. Особенности диагностики, поражения органов-мишеней и лечения больных с артериальной гипертонией и синдромом обструктивного апноэ во время сна: диссертация ... док.мед.наук : 14.00.06 / Литвин А.Ю. - Москва, 2009.- 182 с. 11. Мартинчик А.Н. Общая нутрициология. Учебное пособие/ Мартинчик А.Н.- Москва, «МЕДпресс-информ», 2005 год, 391 стр. 12. Матова Е.А. Синдром апноэ во сне/ Матова Е.А. // Здоровая Украина. – 2007. - № 2. С. 28-29. 13. Пальман А.Д. Синдром обструктивного апноэ во сне в терапевтической практике. Пособие для врачей под редакцией Синопальникова А.И. /Пальман А.Д. - Москва, 2007 год, 77 стр. 14. Погожева А.В. Система многоуровневой диагностики и коррекции нарушений пищевого статуса пациентов с сердечнососудистыми заболеваниями/ Погожева А.В. [и др.] // Вопросы питания. – 2009. - том 78, № 3. - С. 43-52. 15. Тутельян В.А. Методические рекомендации по мониторингу пищевого статуса с использованием современных методов нутриметаболомики и оптимизации диетотерапии при внутренней патологии / Тутельян В.А., Гаппаров М.М.Г., Каганов Б.С. и др. – М. – 2005. – 30 с. 31 16. Тутельян В.А. Мониторинг пищевого статуса с использованием современных методов нутриметаболомики и оптимизации диетотерапии при внутренней патологии / Тутельян В.А., Гаппаров М.М.Г., Каганов Б.С. и др. – М.: Минздравсоцразвития РФ. – 2006. – 36 с. 17. Тутельян В.А. Лечебное питание: современные подходы к стандартизации диетотерапии / Под ред. В.А.Тутельяна, М.М.Г. Гаппарова, Б.С.Каганова, Х.Х.Шарафетдинова. 2-е изд., перераб. и доп. - М.: Династия, 2010. – 304 с. 18. Феофанова Т.Б. Клинические и функциональные показатели ишемии миокарда у больных с различной степенью ожирения / Феофанова Т.Б.[и др.] // Вопросы диетологии. 2013. - № 2. - С. 6-15. 19. Шевченко О.П. Ишемическая болезнь сердца. Шевченко [и др.] Издательство Реафарм, Москва, 2005 год, стр.22 20. Шестопалов А.Е. Энтеральное питание – основа лечебных мероприятий при различных заболеваниях / Шестопалов А.Е. // Эффективная фармакотерапия. - 2010. - № 20. - С. 16-19. 21. Altekin RE. Evaluation of subclinical left ventricular systolic dysfunction in patients with obstructive sleep apnea by automated function imaging method; an observational study/ Altekin R[et al.]// Anadolu Kardiyol Derg. – 2012. - 12(4) – P. 320-30. 22. Arnaud C. Obstructive sleep apnea, immuno-inflammation, and atherosclerosis /Arnaud C. [et al.]//SeminImmunopathol. – 2009. - 31(1). – P. 113-25. 23. Aronsohn RS. Impact of untreated obstructive sleep apnea on glucose control in type 2 diabetes /Aronsohn RS[et al.]// Am J Respir Crit Care Med. – 2010. – 181. – P. 507-513. 24. Aslan M. Serum paraoxonase enzyme activity and oxidative stress in obese subjects / Aslan M.[et al.]//Pol. Arch. Med. Wewn. - 2011. – 121. – P. 181–186. 25. Atkeson A. Endothelial function in obstructive sleep apnea / Atkeson A. [et al.]//Prog Cardiovasc Dis. - 2009. – 51. – P. 351-362. 26. Balachandran JS. Effect of mild, asymptomatic obstructive sleep apnea on daytime heart rate variability and impedance cardiography measurements/Balachandran JS. [et al.]//Am J Cardiol. – 2012. -109(1). – P. 140-145. 27. Barcelo A. Insulin resistance and daytime sleepiness in patients with sleep apnoea / Barcelo A. [et al.]// Thorax. - 2008. - 63(11). – P. 946-950. 28. Bełtowski J. Leptin and the regulation of endothelial function in physiological and pathological conditions / Bełtowski J. // Clin. Exp. Pharmacol. Physiol. – 2012. – 39. – P. 168–178., 29. Bondia-Pons I. Oxidative stress and inflammation interactions in human obesity / BondiaPons I. [et al.]//J. Physiol. Biochem. – 2012. – 68. – P. 701–711. 30. Botros N. Obstructive sleep apnea as a risk factor for type 2 diabetes ? Botros N. [et al.]//Am J Med. – 2009. – 122. – P.1122-7. 31. Bradley D. Obstructive Sleep Apnea and Heart Failure:Pathophysiologic and Therapeutic Implications /Bradley D. [et al.]//.Cardiology Rounds. -2004. - Vol.8, Issue 3. 32. Braga B. Sleep-disordered breathing and chronic atrial fibrillation / Braga B [et al.]//Sleep Med.– 2009. - 10(2). – P.212-6. 33. Broocs D. Baroreflex control of heart rate in a canine model of obstructive sleep apnea /Broocs D [et al.]//Am J Respir Crit Care Med. - 1999. - 159(4 Pt 1). – P.1793-1797. 34. Bryan S. Redox-inflammatory synergy in the metabolic syndrome /BryanS.[et al.]//Can. J. Physiol. Pharmacol. – 2013. - 91. - 22–30. 32 35. Bulcun E. Disorders of glucose metabolism and insulin resistance in patients with obstructive sleep apnoea syndrome /Bulcun E[et al.]//Int J Clin Pract. – 2012. - 66(1). – P. 91-7. 36. Calhoun DA. Aldosterone excretion among subjects with resistant hypertension and symptoms of sleep apnea / Calhoun DA [et al.]//Chest. - 2004. - 125(1). – P.112–117. 37. Cappuccio FP. Meta-analysis of short sleep duration and obesity in children and adults / Cappuccio FP [et al.]//SLEEP. – 2008. - Vol. 31, Issue 5. –P. 619-626. 38. Cho KI. Impact of obstructive sleep apnea on the global myocardial performance beyond obesity / Cho KI [et al.]//Echocardiography. - 2012. - 29(9). – P. 1071-80. 39. Chobanian AV. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood PressureChobanian AV. [et al.]//Hypertension. – 2003. 42(6). – P.1206–1252. 40. Cizza G. Obstructive sleep apnea is a predictor of abnormal glucose metabolism in chronically sleep deprived obese adults /Cizza G [et al.]//PLoS One. – 2013. - 29;8(5):e65400. 41. Clarenbach CF. Is obstructive sleep apnea a risk factor for diabetes? / Clarenbach CF [et al.]//DiscovMed. – 2011. - 12(62). – P. 17-24. 42. Coen P.M. Role of intramyocelluar lipids in human health / Coen P.M., Goodpaster B.H. // Trends Endocrinol.Metab. – 2012. - 23. - 391–398. 43. Crummy F. Obesity and the lung: 2. Obesity and sleep-disordered breathing / Crummy F. [et al.]// Thorax. – 2008. - 63(8). – P.738-46. 44. D’Archivio. Predominant role of obesity/insulin resistance in oxidative stress development / D’Archivio [et al.]//Eur. J. Clin. Invest. – 2012. - 42. – P. 70–78. 45. Dandona P. Macronutrient intake induces oxidative and inflammatory stress: Potential relevance to atherosclerosis and insulin resistance / Dandona, P.[et al.]//Exp. Mol. Med. – 2010. 42. – P. 245–253. 46. de Jonge L. Poor sleep quality and sleep apnea are associated with higher resting energy expenditure in obese individuals with short sleep duration /de Jonge L. [et al.]//J Clin Endocrinol Metab.– 2012. - 97(8). – P. 2881-9. 47. Dematteis M. Intermittent hypoxia induces early functional cardiovascular remodeling in mice / Dematteis M. [et al.]//Am J Respir Crit Care Med. -2008. - 177(2). – P.227-235. 48. Einhorn D. Prevalence of sleep apnea in a population of adults with type 2 diabetes mellitus / Einhorn D [et al.]//Endocr Pract. - 2007. – 13. – P. 355-62. 49. Eskafi M.Sleep apnoea in patients with stable congestive heart failure an intervention study with a mandibular advancement device / Eskafi M. // Swed Dent J Suppl. - 2004. - 168. – P.1-56 50. Feng J. Endothelial mechanisms of endothelial dysfunction in patients with obstructive sleep apnea / Feng J [et al.]//Sleep Breath. – 2012. - 16(2). – P. 283-94. 51. Ferretti G. HDL-paraoxonase and membrane lipid peroxidation: A comparison between healthy and obese subjects. Ferretti G. [et al.]//Obesity. - 2010. –18. – P. 1079–1084. 52. Filgueiras-Rama D. Atrial Arrhythmias in Obstructive Sleep Apnea: Underlying Mechanisms and Implications in the Clinical Setting /Filgueiras-Rama D. [et al.]// Pulm Med. 2013; 2013: 426758. Published online 2013 April 3. 53. Foster GD. Sleep AHEAD Research Group. Obstructive sleep apnea among obese patients with type 2 diabetes / Foster GD. [et al.]//Diabetes Care. – 2009. – 32. – P.1017-9. 54. Fredheim J. Type 2 diabetes and pre-diabetes are associated with obstructive sleep apnea in extremely obese subjects: A cross-sectional study / Fredheim J. [et al.]//Cardiovasc Diabetol. 2011. – 10. – P.84. 33 55. Furukawa S. Increased oxidative stress in obesity and its impact on metabolic syndrome /Furukawa S.[et al.]//J. Clin. Invest. – 2004. - 114. – P. 1752–1761. 56. Gami AS.Day-night pattern of sudden death in obstructive sleep apnea /Gami AS [et al.]//N Engl J Med. – 2005. – 352. – P.1206–1214. 57. Gangwisch JE. Short Sleep Duration as a Risk Factor for Hypercholesterolemia: Analyses of the National Longitudinal Study of Adolescent Health / Gangwisch JE [et al.]// Sleep. – 2010. - 1; 33(7). – P. 956–961. 58. Guanxia Z. NADPH Oxidase Mediates Hypersomnolence and Brain Oxidative Injury in a Murine Model of Sleep Apnea / Guanxia Z. [et al.] // Am J Respir Crit Care Med. – 2005. 1; 172(7). – P. 921–929. 59. Halliwell, B. Free radicals and antioxidants: Updating a personal view/ Halliwell B. //Nutr.Rev. – 2012. - 70. - P.257–265. 60. Higuchi M. Differentiation of human adipose-derived stem cells into fat involves reactive oxygen species and forkhead box o1 mediated upregulation of antioxidant enzymes/ Higuchi, M [et al.]//Stem. CellsDev. – 2013. - 22. – P. 878–888., 61. Horvath, T.L. Fuel utilization by hypothalamic neurons: Roles for ROS /Horvath, T.L [et al.]//TrendsEndocrinol.Metab.- 2009. - 20. – P. 78–87. 62. http://www.sasw2012.org/ 63. Iiyori N. Intermittent hypoxia causes insulin resistance in lean mice independent of autonomic activity / Iiyori N. [et al.]//Am J Respir Crit Care Med. – 2007. - 15;175(8). – P. 851-7. 64. Ip MS. Circulating nitric oxide is suppressed in obstructive sleep apnea and is reversed by nasal continuous positive airway pressure / Ip MS[et al.]//Am J Respir Crit Care Med. – 2000. 162(6). – P. 2166-71. 65. Ip MS. Serum leptin and vascular risk factors in obstructive sleep apnea / Ip MS[et al.]//Chest. – 2000. - 118(3). – P. 580-6. 66. Ip MS. Endothelial function in obstructive sleep apnea and response to treatment /Ip MS[et al.]//Am J Respir Crit Care Med. – 2004. - 169(3). – P. 348-53. 67. Iwasaki Y. K.Determinants of atrial fibrillation in an animalmodel of obesity and acute obstructive sleep apnea / Iwasaki Y. K. [et al.]//// Heart Rhythm. 2012. - vol. 9, № 9. - P.1409– 1416. 68. Keaney J.F. Framingham Study. Obesity and systemic oxidative stress: Clinical correlates of oxidative stress in the Framingham Study/ Keaney J.F. [et al.]//Arterioscler.Thromb.Vasc. Biol. – 2003. – 23. – P.434–439. 69. Kezirian E. Resting Energy Expenditure in Adults With Sleep Disordered Breathing / Kezirian E. [et al.]//Arch. Otolaryngol Head Neck Surg . – 2008. – V. 134 (№12). 70. Kim SH. Impact of obstructive sleep apnea on left ventricular diastolic function /Kim SH [et al.]//Am J Cardiol. – 2008. -101(11). - P. 1663-8. 71. Kohler M. CPAP and measures of cardiovascular risk in males with OSAS / Kohler M [et al.]//Eur Respir J. – 2008. - 32(6). – P. 1488-1496. 72. Kourouklis SP. Effective sleep apnoea treatment improves cardiac function in patients with chronic heart failure / Kourouklis SP [et al.]// Int J Cardiol. – 2013. - 168. – P. 157-162. 73. Kunze DL. Hypertension in sleep apnea: the role of the sympathetic pathway / Kunze DL. [et al.]// Cleve Clin J Med. – 2007. - 74(Suppl 1). – P.34–6. 74. Lam J. A randomised controlled trial of nasal continuous positive airway pressure on insulin sensitivity in obstructive sleep apnoea / Lam J. [et al.]// Eur Respir J. - 2010. – 35. – P. 138–145. 34 75. Lam JC. Hypoadiponectinemia is related to sympathetic activation and severity of obstructive sleep apnea /Lam JC. [et al.]// Sleep. – 2008. - 31(12). – P.1721-7. 76. Lee H. Reactive oxygen species facilitate adipocyte differentiation by accelerating mitotic clonal expansion /Lee, H [et al.]//J. Biol. Chem. –2009. - 284. – P.10601–10609. 77. Li C. Prevalence of self-reported clinically diagnosed sleep apnea according to obesity status in men and women: National Health and Nutrition Examination Survey, 2005-2006 / Li C [et al.]// Prev Med. – 2010. - 51(1). – P. 18-23. 78. Lindberg E. Epidemiology of OSA /Lindberg E. // Respiratory Society Monograph. - 2010. - Vol. 50 - P.51-68. 79. Linz D. Negative tracheal pressure during obstructive respiratory events promotes atrial fibrillation by vagal activation /Linz D.[et al.]// Heart Rhythm. 2011. - № 9. – P. 1436–1443. 80. Logan AG. High prevalence of unrecognized sleep apnoea in drug-resistant hypertension /Logan AG [et al.]// J Hypertens. – 2001. - 19(12). – P.2271-7. 81. Louis M. Effects of acute intermittent hypoxia on glucose metabolism in awake healthy volunteers / Louis M,Punjabi NM. //J Appl Physiol. – 2009. - 106(5). – P. 1538-1544. 82. Lui MM. C-reactive protein is associated with obstructive sleep apnea independent of visceral obesity /Lui MM. [et al.] // Chest. – 2009. -135(4). – P. 950-6. 83. Mahmood K. Prevalence of type 2 diabetes in patients with obstructive sleep apnea in a multi-ethnic sample / Mahmood K [et al.]//J. Clin. Sleep Med. -2009.- 5. – P. 215–221. 84. Makino S. Obstructive sleep apnoea syndrome, plasma adiponectin levels, and insulin resistance /Makino S [et al.]// Clin Endocrinol (Oxf). – 2006. - 64(1). – P. 12-9. 85. Marin JM. Long-term cardiovascular outcomes in men with obstructive sleep apnoeahypopnoea with or without treatment with continuous positive airway pressure: an observational study /Marin JM [et al.]//Lancet. – 2005. -365(9464). – P.1046-53. 86. Matiello M. Low efficacy of atrial fibrillation ablation in severe obstructive sleep apnoea patients /Matiello M [et al.]// Europace. – 2010. - 12(8). – P. 1084-9. 87. Mayo clinic special report, 2010. URL: https://healthletter.mayoclinic.com/secure/pdf/SRHW.pdf 88. McNicholas WT. Obstructive sleep apnea and inflammation / McNicholas WT. //Prog Cardiovasc Dis. – 2009. - 51(5). – P.392-9. 89. Mehra R. Nocturnal Arrhythmias across a spectrum of obstructive and central sleepdisordered breathing in older men: outcomes of sleep disorders in older men (MrOS sleep) study /Mehra R. [et al.]//Arch Intern Med.- 2009. - 169(12). – P. 1147-55. 90. Meslier N. Impaired glucose-insulin metabo- lism in males with obstructive sleep apnoea syndrome / Meslier N. [et al.]// Eur. Respir. J. -2003. – 22. – P. 156–160. 91. Mlinar B. New insights into adipose tissue dysfunction in insulin resistance /Mlinar B.,Marc J.// Clin. Chem. Lab. Med. – 2011. - 49. – P. 1925–1935. 92. Monahan K.Triggering of nocturnal arrthythmias by sleep disordered breathing events / Monahan K. [et al.]//J Am Coll Cardiol. – 2009. - 54(19). – P. 1797. 93. Narkiewicz K.Sympathetic nerve activity in obstructive sleep apnoea / Narkiewicz K.,Somers VK. //Acta Physiol Scand. – 2003. - 177(3). – P. 385-90. 94. Nena E.Sleepiness as a marker of glucose deregulation in obstructive sleep apnea / Nena E [et al.]// Sleep Breath. – 2012. - 16(1). – P.181-6. 95. Olivares-Corichi I.M. Oxidative stress present in the blood from obese patients modifies the structure and function of insulin / Olivares-Corichi I.M.[et al.]// Horm. Metab. Res. – 2011. - 43. 35 P. 748–753. 96. Oliveira W. Left atrial volume and function in patients with obstructive sleep apnea assessed by real-time three-dimensional echocardiography/ Oliveira W.[et al.]// JAmSocEchocardiogr. – 2008. - 21(12). – P. 1355-61. 97. Onen SH. Occult nighttime hypertension in daytime normotensive older patients with obstructive sleep apnea /Onen SH.[et al.]// J Am Med Dir Assoc. – 2012. - 13(8). – P. 752-6. 98. Patel C. Prolonged reactive oxygen species generation and nuclear factor-kappaB activation after a high-fat, high-carbohydrate meal in the obese /Patel C.[et al.]// J. Clin. Endocrinol.Metab. – 2007. - 92. – P. 4476–4479. 99. Pialoux V. Effects of exposure to intermittent hypoxia on oxidative stress and acute hypoxic ventilatory response in humans /Pialoux V. [et al.]// Am J Respir Crit Care Med. – 2009. 180(10). – P. 1002-1009. 100. Pimenta E. Increased dietary sodium is related to severity of obstructive sleep apnea in patients with resistant hypertension and hyperaldosteronism / Pimenta E. [et al.] //Chest. – 2013. 143(4). – P. 978-83. 101. Plamen D. Update on Energy Homeostasis and Insufficient/ Plamen D. //Sleep J Clin Endocrinol Metab. – 2012. - 97(6). – P. 1792–1801. 102. Polotsky V.Y. Intermittent Hypoxia Increases Insulin Resistance in Genetically Obese Mice /Polotsky V.Y. [et al.] // J Physiol. – 2003. - 552(Pt 1). – P. 253–264. 103. Prabhakar NR. Intermittent hypoxia-mediated plasticity of acute O2 sensing requires altered red-ox regulation by HIF-1 and HIF-2 / Prabhakar NR. [et al.]// AnnNYAcadSci. – 2009. – 1177. – P.162–8. 104. Pratt-Ubunama MN. Plasma aldosterone is related to severity of obstructive sleep apnea in subjects with resistant hypertension / Pratt-Ubunama MN [et al.]// Chest. - 2007. – Feb. - 131(2). – P. 453-9. 105. Punjabi NM. Sleep-disordered breathing and mortality: a prospective cohort study / Punjabi NM [et al.]// PLoS Med. - 2009. - 6(8). - e1000132. 106. Quan SF. The Sleep Heart Health Study: design, rationale, and methods /Quan SF [et al.]// Sleep. – 1997. - 20(12). – P. 1077-85. 107. Rahangdale S. The influence of intermittent hypoxemia on platelet activation in obese patients with obstructive sleep apnea.Rahangdale S. [et al.]// J Clin Sleep Med. – 2011. - 15;7(2). – P. 172-8. 108. Ramos-Mondragґon R. Long-term modulation of Na+ and K+ channels by TGF-�1 109. in neonatal rat cardiac myocytes / Ramos-Mondragґon R. [et al.]// Pflugers Archiv European Journal of Physiology. – 2011. –Vol.461№2. – P. 235–247. 110. Ravussin E. Energy expenditure before and during energy restriction in obese patients / Ravussin E. [et al.] // Am J Clin Nutr. – 1985. - 41(4). – P. 753-9. 111. Rechtschaffen A. Sleep deprivation in the rat by the disk-over-water method /Rechtschaffen A., Bergmann BM. // BehavBrainRes. – 1995. – 69. – P.55–63. 112. Reichmuth, K. J. Association of sleep apnea and type II diabetes: a population-based study / Reichmuth, K. [et al.]// Am. J. Respir. Crit. Care Med. – 2005. – 172. –P.1590–1595. 113. Resnick HE. Sleep Heart Health Study. Diabetes and sleep disturbances: findings from the Sleep Heart Health Study / Resnick HE [et al.]// Diabetes Care 2003. -26. – P. 702-9. 114. Ronksley P. E. Obstructive sleep apnoea is associ- ated with diabetes in sleepy subjects /Ronksley P. E. [et al.]// Thorax. – 2009. – 64. – P. 834–839. 36 115. Santana A. Sleep duration in elderly obese patients correlated negatively with intake fatty Lipids / Santana A. [et al.]// Health Dis. – 2012. - 11. – P. 99. 116. Sauvet F. Effect of acute sleep deprivation on vascular function in healthy subjects / Sauvet F [et al.]// J Appl Physiol. – 2010. – 108. – P. 68-75. 117. Serra D. Mitochondrial fatty acid oxidation in obesity / Serra D [et al.]// Antioxid.Redox Signal. – Antioxid Redox Signal. – 2013. -19(3). – P.269-84. 118. Sies H. Nutritional, dietary and postprandial oxidative stress / Sies H. [et al.]// J. Nutr. – 2005. –135. – P. 969–972. 119. Simantirakis E. Severebradyarrhythmias in patients with sleep apnoea: the effect of continuous positive airway pressure treatment: a long-term evaluation using an insertable loop recorder / Simantirakis E.[et al.]//European Heart Journal. – 2004. - vol. 25, no. 12. – P. 1070–1076. 120. Spiegel K. Brief Communication: sleep curtailment in healthy young men is associated with decreased leptin levels, elevated ghrelin levels, and increased hunger and appetite / Spiegel K. [et al.]// Ann Intern Med. – 2004. – 141. – P. 845–50. 121. Stamatakis KA. Effects of sleep fragmentation on glucose metabolism in normal subjects /Stamatakis KA.,Punjabi NM.// Chest. – 2010. - 137(1). – P. 95-101. 122. Stenlöf K. Energy expenditure in obstructive sleep apnea: effects of treatment with continuous positive airway pressure /Stenlöf K [et al.]// Am J Physiol.– 1996. - 271(6 Pt 1). – P.1036-43. 123. Stevenson I. H. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea / Stevenson I. H.[et al.] // Heart Rhythm. – 2010. - vol. 7, no.9. – P. 1263–1270. 124. Stiegler P. The role of diet and exercise for the maintenance of fat-free mass and resting metabolic rate during weight loss /Stiegler P., Cunliffe A. // Sports Med. – 2006. - 36(3). – P.23962. 125. Takase B. Effect of chronic stress and sleep deprivation on both flow-mediated dilation in the brachial artery and the intracellular magnesium level in humans / Takase B. [et al.]// Clin Cardiol. – 2004. – 27. – P. 223-227. 126. Tang RB. Obstructive sleep apnoea risk profile and the risk of recurrence of atrial fibrillation after catheter ablation /Tang RB. [et al.]// Europace. – 2009. - 11(1). - P. 100-5. 127. Taranto Montemurro L. Inverse relationship of subjective daytime sleepiness to sympathetic activity in patients with heart failure and obstructive sleep apnea / Taranto Montemurro L. [et al.]// Chest.– 2012. - 142(5). – P. 1222-8. 128. Thomopoulos C. Resistant hypertension and obstructive sleep apnea: the sparring partners / Thomopoulos C. [et al.] // Int J Hypertens. – 2011. - Article ID 947246. URL: http://dx.doi.org/10.4061/2011/947246 129. Tsioufis C. Association of obstructive sleep apnea with urinary albumin excretion in essential hypertension: a cross-sectional study /Tsioufis C. [et al.]// Am J Kidney Dis. – 2008. 52(2). – P.285-93. 130. Ucok K. Resting Metabolic Rate and Anthropometric Measurements in Male Sleep Apnea Patients / Ucok K. [et al.]// InternMed. – 2011. - 50. - P. 833-838. 131. Usui Y. Coexistence of obstructive sleep apnoea and metabolic syndrome is independently associated with left ventricular hypertrophy and diastolic dysfunction / Usui Y. [et al.]// SleepBreath. – 2012. - 16(3). – P. 677-84. 37 132. Usui Y. Severe obstructive sleep apnea impairs left ventricular diastolic function in nonobese men /Usui Y.[et al.]// Sleep Med. – 2013. - 14(2). – P.155-9. 133. Varol E. Influence of obstructive sleep apnea on left ventricular mass and global function: sleep apnea and myocardial performance index / Varol E. [et al.]// Heart Vessels. – 2010. - 25(5). – P. 400-4. 134. Vgontzas AN. Elevation of plasma cytokines in disorders of excessive daytime sleepiness: role of sleep disturbance and obesity / Vgontzas AN. [et al.] // J Clin Endocrinol Metab. – 1991. – 82. – P. 1313–6. 135. Wang S. The impact of the unfolded protein response on human disease / Wang S., Kaufman R.J. // J. Cell. Biol. – 2012. – 197. – P. 857–867. 136. Weck M. Strategies for successful weight reduction - focus on energy balance / Weck M. [et al.] // Dtsch Med Wochenschr. – 2012. -137(43). – P.2223-8. 137. WeinstockTG. A Controlled Trial of CPAP Therapy on Metabolic Control in Individuals with Impaired Glucose Tolerance and Sleep Apnea / Weinstock TG. [et al.] // Sleep. – 2012. 35(5). – P. 617–625. 138. World Health Organization. Obesity and overweight. Fact SheetNo 311. URL: http://www.who.int/mediacentre/factsheets/fs311/en/index.html. 139. Xu W. Increased oxidative stress is associated with chronic intermittent hypoxia-mediated brain cortical neuronal cellapoptosis in a mouse model of sleep apnea / Xu W. [et al.] // Neuroscience. – 2004. - 126(2). – P. 313-323. 140. Yamauchi M. Oxidative stress in obstructive sleep apnea: putative pathways to the cardiovascular complications / Yamauchi M., Kimura H. // AntioxidRedoxSignal. – 2008. - 10(4). – P.755-68. 141. Yamauchi M .Evidence for activation of nuclear factor kappaB in obstructive sleep apnea /Yamauchi M [et al.] // Sleep Breath. – 2006. - 10(4). – P. 189-93. 142. Yang S.Q. Mal-effects of obstructive sleep apnea on the heart / Yang S.Q [et al.] // Sleep Breath. – 2012. - vol. 16, no.3. – P.717–722. 143. Zenk JL. Effect of lean system 7 on metabolic rate and body composition / Zenk JL. [et al.] // Nutrition. – 2005. - 21(2). – P.179-85. 38 Приложение 1. Уровни доказательности и классы рекомендации Уровень Источник доказательств I (1) Проспективныерандомизированные контролируемые исследования. Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных. Крупные мета-анализы. Как минимум одно хорошо организованное рандомизированное контролируемое исследование. Репрезентативная выборка пациентов. Проспективные с рандомизацией или без исследования с ограниченным количеством данных. Несколько исследований с небольшим количеством пациентов. Хорошо организованное проспективное исследование когорты. Мета-анализы ограничены, но проведены на хорошем уровне. Результаты не презентативны в отношении целевой популяции. Хорошо организованные исследования «случай-контроль». Нерандомизированные контролируемые исследования. Исследования с недостаточным контролем. Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками. Ретроспективные или наблюдательные исследования. Серия клинических наблюдений. Противоречивые данные, не позволяющие сформировать окончательную рекомендацию. Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные. II (2) III (3) IV (4) 39