оригинальный файл 36.7 Кб
реклама

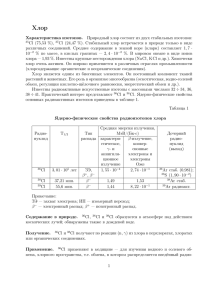
Урок-путешествие «Хлор и его соединения» Цель: познакомить учащихся с соединениями хлора: оксокислотами и их солями; изучить их окислительные свойства, применение и значение в жизни человека; расширить и углубить знания умения и навыки работы с дополнительной литературой и компьютерными технологиями; показать межпредметные связи, т.е. использование компьютерных возможностей при изучении предмета химии; совершенствовать познавательный интерес учащихся к предмету химии и информатики, стимулировать к поиску дополнительной информации и краеведческого материала; воспитывать у учащихся любовь к предмету, патриотизм. Оборудование: компьютеры, СD-диски, периодическая таблица, таблица растворимости веществ, путевые дневники, путевая карта, карточки-задания, опорные конспекты с дополнительной информацией. Вещества: NaCl (поваренная соль), р-ры HCl, AgNO3, KClO3 (бертолетова соль), проб. №1, №2 , №3 с растворами веществ NaCl, КJ, NaBr. Методика: урок-игра. Ход урока: 1. Вводное слово учителя: Сегодня у нас необычный урок: «Путешествие вокруг хлора». - Чем пахнет хлорированная водопроводная вода? - А чем пахнет отбеливатель «Белизна», которым отмывают раковину на кухне и сводят пятна фруктов на скатерти? - ( ХЛОРОМ!) Еще лучше мы знаем соединения хлора – поваренную соль – NaCl, которой солим суп. В желудке у нас находится соляная кислота для переваривания пищи. Итак, отправляемся в путь – в Страну Хлора! Классная доска превращается в путевой дневник, на которой находится путевая карта, а у каждого из вас на столах личный путевой дневник, в котором вы будете делать необходимые записи. Но прежде чем отправиться на первую станцию, вы должны получить ключ-пропуск. Плата за него - это ваши знания. Ответьте на вопросы викторины: 1. Где проживает в периодической системе хлор? Какова его улица, № дома, квартиры? 2. Какую фамилию имеет это семейство? 3. Зарисуйте строение атома хлора на доске. 4. Охарактеризуйте хлор как простое вещество. (Газ, зеленовато-желтого цвета с резким удушливым запахом, ядовит, тяжелее воздуха). 5. Какие степени окисления может проявлять хлор? Выполните задание № 1 на карточке «Степени окисления». (2 мин.) Без исправлений. (Самопроверка).Исправьте другой ручкой. - Итак, вы получаете пропуск на станцию «Информационная». Наша задача – познакомиться с другими соединениями хлора: оксокислотами и их солями, а самое главное с их применением и значением в жизни человека. I. Станция «Информационная». Эта станция находится в дремучем лесу: компьютере. -- Я попрошу открыть на рабочем столе «поляну» с названием «VIIА группа. Галогены». -- Сколько у элемента хлора «ближайших родственников»? Картину «семейной жизни» мы послушаем в пункте «Кислородсодержащие соединения хлора» и поместим в путевой дневник. Образец с соляной кислотой вам дан. - Нажмите указателем мыши на этот пункт и внимательно слушайте. Путевой дневник. Формул HCl HClO HClO2 ы кислот Названи Хлоро хлорноватис хлористая хлорноватая я кислот в. тая (солян .) -1 Ст. +1 +3 окисл. хлора Формул ClClOClO2ы анионов Названи Хлори Гипохлорит Хлориты HClO3 HClO4 хлорная +5 +7 ClO3- ClO4- Хлораты Перхлораты я солей д ы Формул NaCl KClO ы солей CaCl2 Сa(ClO)2 Изменен Сильн ие силы ая кислот Изменен Вос-ль ие окисл. св-в Свойств HClO а кислот HClO+О Свойств а KClO2 KClO3 KClO4 Сa(ClO2)2 Сa(ClO3)2 Сa(ClO4)2 Увеличивается Уменьшаются 4HClO4г=4СlO2+3O2+ 2H2O = 4HClO2=H Cl+ 3HClO+NaI HClO3+2Cl = O2 + =NaIO3+3H Cl +H2O NaCIO 2KClO3=2KCl+ +2HCl =Cl2+ +NaCl+H2O +3O2 KClO4+H2SO4к=HClO 4г+ KHSO4 солей 5NaCIO +2NaOH+I2 = 5NaCl +2NalO3 + H2O 4KClO3=2KCl+ +3KClO4 KClO3+6NaI+3H2SO4=3I2+KCl+3Na2S O4+3H2O - Что вы нашли в «дремучем лесу»? Ответьте на мои вопросы? - Что такое оксокислоты хлора? - Как называются данные вещества? (показ карточек с формулами кислот). - Каковы степени окисления в этих веществах? - Как называются данные вещества? (показ карточек с формулами солей). - Каковы степени окисления в этих веществах? - Какая кислота является самой сильной? - Какая кислота является самым сильным окислителем? Узнав много нового, мы покидаем эту станцию и переходим на следующую станцию. 1. II. Станция «Экспериментальная» Вам предстоит, пользуясь инструкцией, распознать, в какой из трех пробирок находится хлорид, т. е. вспомнить качественную реакцию на Сl-. (Соблюдать технику безопасности). -- В путевой дневник запишите уравнение данной реакции в молекулярном и ионном виде. NaCl + AgNO3 = NaNO3 + AgCl↓ Ag+ + Cl- = AgCl ↓ 1. III. Станция «Практическая». Великий Гетте сказал: «Просто знать – ещё не всё, знания нужно уметь использовать». На этой станции вы узнаете, где используются вещества, содержащие хлор. О некоторых областях применении хлора вы знаете. Задание: Перечислите области применения хлора и его соединений, которые вы знаете. Найдите на этой станции эти предметы, в которых он используется. Хлор хвалился «Нет мне равных Галоген я самый главный, Зря болтать я не люблю Все на свете отбелю!» Отбеливание тканей Дезинфекция помещений, хлорирования воды. В медицине для обеззараживания предметов. Целлюлозно-бумажной и текстильной отраслях промышленности. Соляную кислоту для пайки металлов. Однажды Бертолле растирал кристаллы КClO3 в ступке, в которой на стенках осталось небольшое количество серы. Через некоторое время произошел взрыв. Так впервые Бертолле осуществил реакцию, которую позднее стали применять при производстве... Чего? (Первых шведских спичек.) А эту соль назвали «бертолетова». Бертолетову соль применяют в фейерверках, сигнальных ракетах, для получения взрывчатых веществ. (Учитель) Применение хлора. Хлор применяется в медицине для обеззараживания предметов, помещений и в коммунальном хозяйстве для хлорирования воды, т. к. он обладает сильным дезинфицирующим действием за счет своих окислительных свойств. Такие же свойства проявляют хлорная вода (раствор хлора в воде) и хлорная известь Са(ОСl)2. Действие этих агентов основано на том, что в водных растворах этих веществ существует кислая среда, в которой свертываются белки, а при реакции хлора c водой и при гидролизе Са(ОСl)2 в присутствии СО2 образуется сильный окислитель — хлорноватистая кислота НСlО. Эта кислота на свету разлагается на НСl и атомарный кислород О, который является сильным окислителем и разрушает структуры клеток, при этом микроорганизмы погибают. IV. Станция «Историческая». Учитель: Мы покидаем эту станцию и прибываем на станцию «Историческая». Совершим экскурсию в историю. Сообщение №1. История открытия хлора и его первое применение. Имя «галоген», что в переводе означает «солерод», было дано хлору за его способность образовывать поваренную соль (хлорид натрия). Позже это имя было распространено на все элементы VIIA группы, а хлор получил свое имя – в переводе с греческого «желто-зеленый». Этот газ с резким удушливым запахом был получен в 1774 г. шведским химиком Карлом Шееле, определен как новый элемент в 1810 году англичанином Г. Дэви, а назван в 1812 году французским химиком Жозефом Луи Гей-Люссаком. Хлор называют «желто-зеленая смерть». Проникая в легкие, жадно соединяясь с водой, входящей в состав клеток, хлор убивает их. Это позволило применить его в качестве боевого отравляющего вещества в годы первой мировой войны. Это случилось ранней весной 1915 года, неподалеку от бельгийского города Ипра. Здесь лицом к лицу стояли воюющие армии Франции и Германии. Утром 22 апреля французы увидели, как в их сторону из немецких окопов поползло желто-зеленое зловещее облако. Солдаты схватились за оружие, но газ оказался ядовитым. Он ослеплял глаза, словно когтями, рвал грудь. Это было первое применение хлора. Атака вывела из строя целую дивизию – 15 тысяч человек. Из них 9 тысяч остались мертвыми на поле боя. Через месяц немцы предприняли газовую атаку против русских войск, выпустив ночью 150 тонн ядовитого хлора, унеся 9 тысяч жизней. Учитель. – Так как близится 60-летие Победы над фашистской Германией и этот учебный год проходит под его девизом, давайте вспомним годы войны… Сообщение. (Учитель) 1941 год. Немецкие танки рвутся к Москве. Наша Армия грудью сдерживает врага. Не хватает обмундирования, продовольствия, боеприпасов, а главное - противотанковых средств. В этот критический период на помощь приходят ученые - энтузиасты: за 2 дня на одном из военных заводов налаживается выпуск бутылок КС (Качугина-Солодовникова), или просто бутылок с горючей смесью. Потом эти бутылки применяли в 1942-1943 гг. – под Сталинградом, в 1944 г. – у Ясс и даже весной 1945 г. – в Берлине. - Что представляют собой эти бутылки КС? В обыкновенные бутылки заливали бензин, керосин или масло, а к бутылке прикрепляли резинкой ампулы, содержащие концентрированную серную кислоту, бертолетову соль и сахарную пудру. При ударе бутылка разбивалась, компоненты запала вступали в химическую реакцию, происходила сильная вспышка, и горючее воспламенялось. Задание. Уравняйте реакции, иллюстрирующее действие запала бутылок КС, методом электронного баланса. 3 KCl+5O3+ H2SO4 → 2 Cl+4O2 + KCl+7O4 + K2SO4 + H2O Cl+5 +1e- → Сl+4 2 2Cl+5 +2e- → 2Сl+4 в-е Cl+5 -2e- → Сl+7 1 Cl+5 -2e- → Сl+7 ок-е 2ClO2 → Cl2 + 2 O2 C12H22O11 + 12 O2 → 12 CO2 + 11 H2O Сообщение. (Учитель) Во время ночных налетов для освещения цели бомбардировщики сбрасывали на парашютах осветительные ракеты. В их состав входил спрессованный с особым составом порошок магния, и запал из угля, бертолетовой соли и солей кальция. При запуске осветительной ракеты высоко над землей горит запал красивым желтым пламенем; по мере снижения ракеты свет постепенно делается ровным, ярким и белым – это загорается магний и становится хорошо видно, как днем. И летчики начинают прицельную бомбардировку. Задание. Уравняйте реакцию, иллюстрирующую действие запала методом электрон. баланса: 2 KCl+5O3 + 3С0 → 2 KCl-1 + 3 C+4O2 (ок-ль) Сl+5 + 6e- → Сl-1 2 2Сl+5 + 12e- → 2Сl-1 в-е (в-ль) C0 - 4e- → Сl+4 Сообщение №4. 3 3C0 - 12e- → 3Сl+4 ок-е (Учитель) Было бы несправедливо не вспомнить о грозных боевых машинах тех лет - легендарных «катюшах», которые были созданы нашим земляком Флеровым. В их реактивных снарядах содержались те же вещества (бертолетова соль). - А теперь, побывав на станции «Историческая», мы переходим на станцию «Биологическая» и «Экологическая», т. к. они близки друг к другу и тесно связаны между собой. 1. V. Станция «Биологическая». На ст. «Биологическая» мы узнаем Каково биологическое значение хлора? Сообщение № 5. Хлор и здоровье человека. Это полезно знать Содержание галогенов в организме человека (по Дж. Эмели, 1993 г.) Элемент Содержание в организме человека массой 70 кг Мышечная ткань, % Костная ткань, % Фтор 2,6 г Хлор 95 г Бром 260 мг Иод 12 мг 0,05 • 10-4 0,2-1,2 0,2—0,5 0,09 7,7 • 10-4 6,7 • 10-4 0,05 • 10-4 0,27 • 10-4 Кровь, мг/л Ежедневный прием пищей мг Токсическая доза, мг Летальная доза, г с 0,5 0,3—0,5 2,89 • 103 (3—6) • 103 20 2 4,7 0,8—24 0,057 0,1 3-103 35 2 35—350 Биологическое значение хлора 1. Поддерживает нормальное осмотическое давление плазмы крови, лимфы, спинномозговой жидкости. 2. Участвует в образовании соляной кислоты, обмене веществ, построении тканей. 3. Необходим для дезинфекции клеток. 4. Способствует избавлению от лишнего веса. 1. Растворяет отложения на суставах. Соляная кислота, входящая в состав желудочного сока человека, выполняет ряд важных функций: — убивает большую часть бактерий, попадающих вместе с пищей. Например, холерный вибрион погибает в 0,5%-ной НСl в желудок — 0,5%-ная соляная кислота в желудке активизирует ферменты для переваривания белков. Поваренная соль – это вещество, жизненно необходимое каждому человеку: в составе крови у человека почти 0,9% хлорида Na. 0,9%-ный раствор NaСl называют физиологическим. Но хлор должен поступать в организм ежедневно в количестве 3—6,6 г с растительной и животной пищей, а не в виде поваренной соли (хлорида натрия), ибо последняя приводит к защелачиванию организма, сгущает кровь и вызывает заболевания сердечнососудистой системы. Нарушения в обмене хлора ведут к развитию отеков, недостаточной секреции желудочного сока. Резкое уменьшение содержания хлора в организме может привести к тяжелому состоянию, вплоть до смертельного исхода. Избыток хлора в организме является причиной заболеваний желудочно-кишечного тракта, головных болей, нарушения общего обмена веществ. Повышение его концентрации в крови наступает при обезвоживании организма, а также при нарушении выделительной функции почек. 1. VI. Станция «Экологическая». Сообщение № 6. Учитель. Основные антропогенные источники хлора – производство газообразного хлора, хлорорганических соединений, соляной кислоты, массовые выбросы сточных вод химического, фармацевтического, металлургического, целлюлозно-бумажного производств, а также поверхностные стоки, содержащие удобрения, и бытовые сточные воды. Особую опасность представляют галогенпроизводные различных органических соединений, содержащиеся в виде примесей в воде, подвергающейся хлорированию. Чтобы избежать накопления хлорорганических веществ в воде, необходимо освобождать ее от органических примесей до хлорирования. Побывав на ст. «Биологическая», «Экологическая» мы прибываем на ст. «Конечная». 1. VII. Станция «Конечная». Она тоже находится в дремучем лесу –компьютере. На поляне перед вами есть пенек, на котором написано «Тесты по химии». На него нужно наступить, т. е. указателем мышки щелкнуть по нему 2 раза. Запустится приложение. Чтобы привести тесты в действие направьте указатель мыши на слово «тест». Вам дается 5 мин, чтобы ответить на 7 вопросов. Ответы выписывайте в табличку вашего путевого дневника. Приступайте к работе. Тестирование на компьютере. 1. К оксокислотам хлора относятся: А) НСl Б) KClO3 В) НСlO4 2. Степени окисления хлора в веществе Са(СlO)2 равна: А) + 1 Б) + 3 В) +5 3. Формула хлорита алюминия А) AlCl3 Б) Аl(ClO2)3 В) Аl(ClO3)3 4. Формула хлорноватой кислоты А) HClO Б) HClO2 В) HClO3 5. Самый сильный окислитель А) HClO4 Б) HClO3 1. Самая сильная кислота А) HClO4 Б) HClO3 В) HClO В) HClO 7. Вещество, применяющееся для получения взрывчатых веществ: А) KClO4 Б) KClO3 В) KClO2 Чтобы посмотреть ответы, направьте указатель мыши на слово «ответы». Ответы: 1 2 В А Самопроверка: 3 4 5 6 7 Б В В А Б «5» – 0 ошибок, «4» –1-2 ошибки, «3» – 3-4 ошибки, «2» – 5-6 ошибок VIII. Итог урока. IX. Домашнее задание: § 23.5, зад. №2 на карточке «Степени окисления», зад №2 на ст. «Историческая». Полезные советы 1. При укусе пчелы или осы приложите к ужаленному месту увлажненную водой щепотку соли — это успокаивает боль и уменьшает опухоль. 2. Убежавшее на плиту молоко посыпьте поваренной солью — запах горелого исчезнет. 3. Носовые платки легче отстирываются, если замочить их на 2 ч в холодной подсоленной воде (1 чайная ложка на 1 л воды). 4. Цветное белье не линяет, если его на несколько минут замочить в соленой воде. 5. Если вы стираете цветное белье в машине, добавьте в воду 2—3 столовые ложки соли — вещи не полиняют, краски станут ярче. 6. Если к «подошве» утюга что-нибудь прилипло или она слегка заржавела, энергично потрите холодный утюг о рассыпанную на листе картона или плотной бумаги поваренную соль. 7. Если вы случайно пролили на ковер чернила, сейчас же бросьте на пятно горсть соли — соль вберет в себя чернила. Чернильные пятна с ковра хорошо удаляются и соком лимона, но делать это нужно сразу. 8. Поблекшие краски на ковре можно восстановить, очищая его соленой водой, подкисленной лимонным соком. 9. Щепотка поваренной соли, смешанная с уксусом, хорошее средство для сильно загрязненных стеклянных графинов, ваз, а также для удаления зеленоватого слоя, который образуется на стенках цветочных ваз. 10.Чтобы оконные стекла не запотевали и на них не образовывались грязные затеки, положите между двойными рамами небольшие мешочки с солью.