CrO 4 2 - Reshaem.Net
реклама
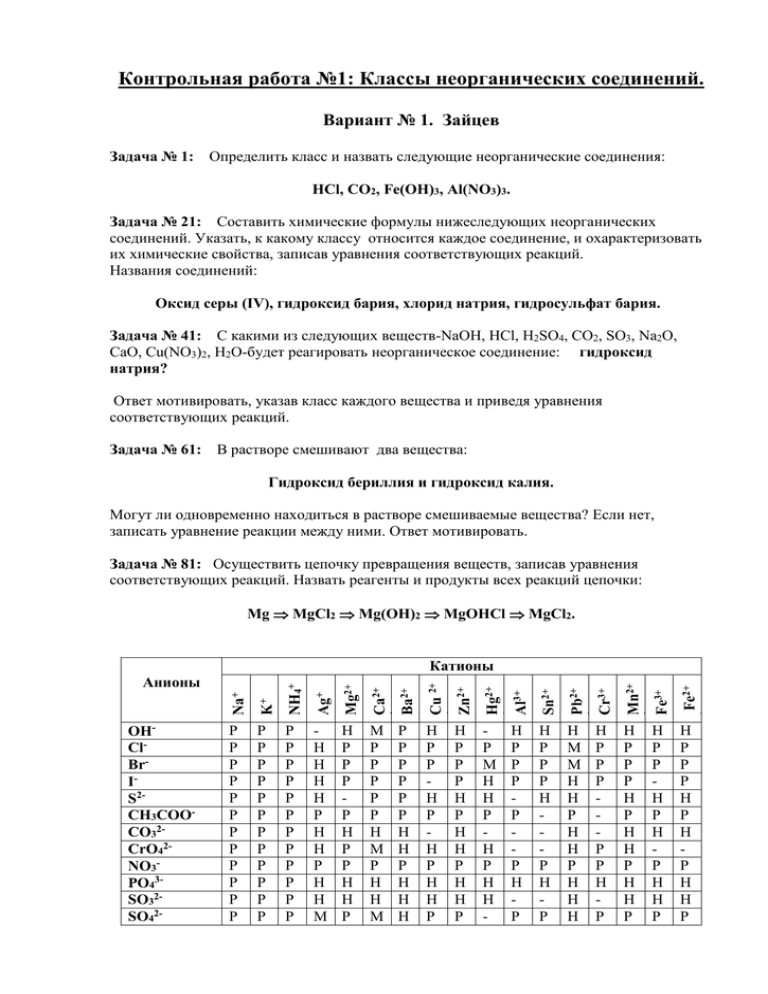
Контрольная работа №1: Классы неорганических соединений. Вариант № 1. Зайцев Задача № 1: Определить класс и назвать следующие неорганические соединения: HCl, CO2, Fe(OH)3, Al(NO3)3. Задача № 21: Составить химические формулы нижеследующих неорганических соединений. Указать, к какому классу относится каждое соединение, и охарактеризовать их химические свойства, записав уравнения соответствующих реакций. Названия соединений: Оксид серы (IV), гидроксид бария, хлорид натрия, гидросульфат бария. Задача № 41: С какими из следующих веществ-NaOH, HСl, H2SO4, CO2, SO3, Na2O, CaO, Cu(NO3)2, H2O-будет реагировать неорганическое соединение: гидроксид натрия? Ответ мотивировать, указав класс каждого вещества и приведя уравнения соответствующих реакций. Задача № 61: В растворе смешивают два вещества: Гидроксид бериллия и гидроксид калия. Могут ли одновременно находиться в растворе смешиваемые вещества? Если нет, записать уравнение реакции между ними. Ответ мотивировать. Задача № 81: Осуществить цепочку превращения веществ, записав уравнения соответствующих реакций. Назвать реагенты и продукты всех реакций цепочки: Mg MgCl2 Mg(OH)2 MgOHCl MgCl2. Н М М Н Н Р Н Н Р Н Н Н Н Р Р Н Р Н Р Н Н Р Н Р Р Р Н Р Н Р Н Н Р 2+ Fe2+ 3+ Fe3+ Н Р Р Р Н Р Н Н Р Н Н Р 2+ Н Р Р Р Р Р Н Р 2+ Pb2+ 2+ Н Р Р Р Н Р Н Р 2+ Н Р Р Р Р Р Н Р Mn2+ Р М Н Н Р Н Р Н Н - Cr3+ Н Р Р Р Н Р Н Н Р Н Н Р Sn2+ Н Р Р Н Р Н Р Н Н Р Al3+ Р Р Р Р Р Р Н Н Р Н Н Н Hg2+ М Р Р Р Р Р Н М Р Н Н М 2+ Ca2+ Н Р Р Р Р Н Р Р Н Н Р Zn2+ Mg2+ Н Н Н Н Р Н Н Р Н Н М 2+ Ag+ Р Р Р Р Р Р Р Р Р Р Р Р Cu 2+ NH4+ Р Р Р Р Р Р Р Р Р Р Р Р 2+ K+ Р Р Р Р Р Р Р Р Р Р Р Р Ba2+ Na+ OHClBrIS2CH3COOCO32CrO42NO3PO43SO32SO42- 2+ Катионы Анионы Контрольные задания №2: «Закономерности химических процессов». Вариант 00. Зайцев Задача 04. Дана реакция 2ZnS(к)+3O2(г)=2ZnO(к)+2SO2(г). Рассчитать стандартную теплоту реакции и записать её термохимическое уравнение. Какая это реакция – экзотермическая или эндотермическая? Определить тепловой эффект реакции, если в ней участвует 22,4л. О2. Задача 40. Дана реакция Fe2O3(к)+3CO(г)=2Fe(к)+3CO2(г). Рассчитать стандартную энергию Гиббса реакции при температурах 250С и 5000С. Для каждой температуры сделать вывод о возможности самопроизвольного протекания реакции. Определить температурную область самопроизвольного протекания реакции. Задача 51. Дана реакция С(графит)+2Cl2(г)=CCl4(г). Записать кинетическое уравнение реакции и определить её теоретический порядок. Определить, как изменится скорость реакции ( во сколько раз увеличится или уменьшится ): а) при уменьшении объёма в 4 раза; b) при увеличении температуры на 30 градусов, считая значение температурного коэффициента скорости реакции равным 4. Задача 66. Для обратимой гетерогенной реакции, приведенной во второй задаче Вашего варианта, записать выражения констант равновесия Кс и Кр. Определить численные значения Кс и Кр при температурах, указанных во второй задаче варианта. Задача 81. Для обратимой гетерогенной реакции, выраженной термохимическим уравнением 3С2Н2(г)С6Н6(ж); Н<0, определить направление сдвига равновесия, если: а) увеличивается концентрация С2Н2; b) увеличивается давление; с) увеличивается температура. Вещество CaCO3(к) CaO(к) CO(г) CO2(г) Fe2O3(к) H2O(г) Н2О(ж) Na2O(к) NaOH(р) NH3(г) NO(г) SO2(г) ZnO(к) ZnS(к) Fe(к) O2(г) Термодинамические характеристики химических соединений и простых веществ. S0298 Н0298,обр. кДж/моль Дж/(мольК) - 1206 92,9 - 635,1 39,7 - 110,5 197,4 - 393,51 213,6 - 822,2 87,4 - 241,84 188,74 - 285,84 69,96 - 416 75,27 - 470 48,1 - 46,19 192,5 90,37 210,62 - 296,9 248,1 - 349 43,5 - 201 57,7 0 27,15 0 205,03 G0298,обр. кДж/моль - 1128,8 - 603,9 - 137,18 - 394,47 - 740,3 - 228,76 - 237,3 - 377,1 - 419,2 - 16,64 86,69 - 300,2 - 318,23 - 198,21 0 0 Контрольная работа по химии №3: Строение вещества. Вариант 00. Зайцев Задача 04. Рассматривается химический элемент –железо. а) составить электронную формулу элемента; б) определить (подчеркнуть в электронной формуле) валентные подуровни и представить графически их электронное строение; в) определить число валентных электронов; г) определить количество электронов, имеющих значение орбитального квантового числа l=0. д) определить количество электронов с сочетанием квантовых чисел n=3 и l=1. Задача 40. Исходя из положения цезия в периодической системе химических элементов, охарактеризовать электронное строение его атомов и окислительновосстановительные свойства элемента, а именно: а) определить общее число электронов, число валентных электронов и максимальную степень окисления, количество электронных слоёв; б) записать электронную формулу валентных подуровней и определить, к какому электронному семейству (s-, p-, d-, f-) относится рассматриваемый элемент; в) какие свойства – металлические или неметаллические – характерны для рассматриваемого элемента (ответ мотивировать); г) какой элемент периода, к которому принадлежит рассматриваемый элемент, является наиболее сильным окислителем (ответ мотивировать); д) какой элемент подгруппы, в которой находится рассматриваемый элемент, имеет наибольшее значение электроотрицательности (ответ мотивировать). Задача 51. Рассматривается образование ковалентных связей между двумя невозбуждёнными атомами химических элементов – электронных аналогов: Sb и N. а) дать графическое объяснение образования ковалентных связей между данными атомами; б) записать электронную и валентную схему образующейся молекулы; в) определить порядок (кратность) связи; г) определить валентность каждого элемента; д) определить число - и -связей. Задача 66. Рассматривается образование ковалентных связей между двумя невозбуждёнными атомами химических элементов – электронных аналогов: N и B. а) дать графическое объяснение образования ковалентных связей между данными атомами; б) записать электронную и валентную схему образующейся молекулы; в) определить порядок (кратность) связи; г) определить валентность каждого элемента; д) определить число - и -связей. Задача 81. Рассматриваются молекула В2 и молекулярные ионы: В2+ и В2. Пользуясь методом МО, объяснить образование химической связи в молекуле и в молекулярных ионах. Для молекулы изобразить энергетическую схему исходных АО и образующихся МО. Записать электронные формулы всех частиц и определить порядок связи в них. Какие частицы могут существовать, и какая из них является наиболее устойчивой. Контрольная работа по химии №4: Растворы электролитов. Вариант 01. Зайцев Задача №1. V миллилитров раствора, полученного путём растворения mв грамм вещества в воде, имеет плотность, равную . Рассчитать молярную, нормальную и процентную концентрацию раствора. Численные значения V, mв и : V=100 мл., mв=13,8г., =1,07г/см3. Растворённое вещество – ортофосфорная кислота Н3РО4. Задача № 21. Рассматриваются растворы 2-х электролитов, молярная концентрация каждого из которых равна СМ. Определить силу электролитов и записать уравнения их диссоциации. Назвать электролиты (см. контр. раб. №1). Для сильного электролита определить молярную концентрацию каждого иона, считая, что он диссоциирует полностью. Для слабого электролита записать выражение константы диссоциации и определить значение степени диссоциации , если величина его константы диссоциации равна ККnAm. Определить значение рН растворов сильного и слабого электролита. Численные значения СМ и ККnAm: СМ=0,1моль/л; ККnAm=7,510-10. Электролиты: [Zn(NH3)4](OH)2 и HBO2. Задача № 41. Составить молекулярные и ионно-молекулярные уравнения реакций между следующими веществами: а) хлорид калия и серная кислота; б) нитрат серебра и хлорид алюминия; в) гидроксид натрия и угольная кислота. Если какая-либо из реакций не протекает, объяснить, почему. Задача № 61. Составить по два молекулярных уравнения для каждой из следующих реакций ионного обмена: а) Cu2+ +2OH- =Cu(OH)2; б) Mg(OH)2 +2H+ = Mg2+ +2H2O. Объяснить, почему данные реакции могут протекать в прямом направлении. Назвать все вещества, участвующие в реакциях. Задача № 81. Какие из нижеперечисленных солей подвергаются гидролизу? Составить молекулярные и ионно-молекулярные уравнения гидролиза этих солей. Какое значение рН (больше, меньше или равно 7) имеют растворы каждой из трёх солей? Соли: K2SО4, NaCN, CrCl3. Приложение. Растворимость оснований и средних солей в воде. Анионы и катионы ОН Растворимость - NO3CH3COOClSO42CO32PO43Na+,K+,NH4+ Растворимы гидроксиды щелочных и щелочноземельных металлов, а также гидроксид аммония NH4OH. Растворимы все соли. Растворимы практически все соли. Растворимы все соли, кроме AgCl, CuCl, PbCl2, Hg2Cl2. Растворимы все соли, кроме CaSO4, SrSO4, BaSO4, PbSO4. Растворимы только карбонаты аммония, натрия и калия. То же, что для карбонатов. Растворимы практически все соли. Контрольная работа по химии №5: Окислительно - востановительные процессы. Вариант№1 Зайцев Задача №1. Осуществить цепочку превращения веществ, записав уравнения соответственных реакций. Какая из двух реакций цепочки является окислительно – восстановительной? Почему? Для окислительно – восстановительной реакции записать электронные уравнения окисления и восстановления атомов, указать окислитель и восстановитель. Цепочка превращения веществ: Na=>NaOH=>Na2SO4. Задача №21. Для каждой из двух нижеприведенных схем превращения частиц составить электронно-ионные уравнения в кислой, нейтральной и щелочных средах. Указать процессы окисления и восстановления, окислитель и восстановитель. Схемы превращения частиц: 1) NO2- => N2; 2) N2 => NO2Задача №41. Дана молекулярная схема окислительно-восстановительной реакции: Ni + H2SO4 => NiSO4 + SO2 + .... Используя метод электронно-ионных уравнений, составить уравнения реакции. В электронно-ионных уравнениях указать процессы окисления и восстановления, окислитель и восстановитель. Пользуясь таблицей стандартных электродных потенциалов, объяснить, почему данная реакция возможна. Задача №61. Металлический проводник, изготовленный из железа, погружён в 0,01 М раствор соли FeSO4. Рассчитать величину относительного электродного потенциала данного электрода. Пользуясь таблицей стандартных электродных потенциалов, составить схему гальванического элемента, в котором рассматриваемый электрод является анодом. Для выбранного гальванического элемента записать уравнения электродных процессов и уравнение электрохимического процесса. Рассчитать величину ЭДС, приняв электродный потенциал катода, равный стандартному. Чему равна стандартная ЭДС? Задача №81. Раствор электролита подвергается электролизу при силе тока 2А в течение 1 часа. Записать уравнения электродных процессов и уравнение электролиза раствора. Определить массу и объём газа, выделившегося на аноде. Электролит: Pb(NO3)2. Приложение. Стандартные электродные потенциалы окислительно-востановительных пар. Окисли Восстано Число Eo,B Окислитель Восстано Число Eo,B тель витель эл-нов витель эл-нов Li+ Li 1 -3,05 Bi3+ Bi 3 0,21 + 2+ Rb Rb 1 -2,93 Cu Cu 2 0,34 K+ K 1 -2,92 Ag+ Ag 1 0,80 + 2+ Na Na 1 -2,71 Hg Hg 2 0,85 2+ 2Zn Zn 2 -0,76 S S 2 0,48 Fe2+ Fe 2 -0,44 I2 2I2 0,54 2+ Cd Cd 2 -0,40 Br2 2Br 2 1,05 Co2+ Co 2 -0,28 SO42-+4H+ SO2+4H2O 2 0,17 2+ 22Ni Ni 2 -0,25 S2O8 2SO4 2 2,01 Sn2+ Sn 2 -0,14 NO3-+2H+ NO2 + H2O 1 0,78 2+ + Pb Pb 2 -0,13 NO3 +4H NO + 2H2O 3 0,96 + 2H H2 2 0,00 2H2O H2 + 2OH 2 -0,83 Sb3+ Sb 3 0,20 O2+4H+ 2H2O 4 1,23