Тема урока :
advertisement

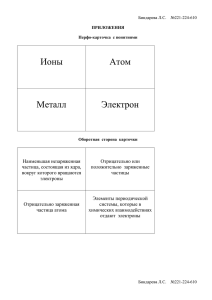
Тема урока : « Обобщающий урок по теме: « Атомы химических элементов». Вид урока – беседа. Цели и задачи урока. Обучающие. Повторить, обобщить и систематизировать сведения о строении атома, структуре периодической таблицы и периодичности свойств атомов химических элементов основанных на строении атома, видах химической связи. Развивающие. Развивать доказательную речь учащихся, умения использовать химическую терминологию, умения составлять электронные схемы и электронные формулы для атомов химических элементов, определять вид химической связи на основании анализа состава химического соединения, сравнивать, анализировать, выделять главное устанавливать причинно-следственные связи. Воспитательные. Продолжить формирование научного мировоззрения, воспитание положительного отношения к знаниям. Методы и методические приемы. Диалогический метод изложения знаний, контроль знаний с помощью теста. Структура урока. 1. 2. 3. 4. 5. Организационный момент. ( 2мин) Актуализация опорных знаний. (5мин). Повторение и обобщение знаний по теме «Атомы химических элементов» Подведение итогов урока и выставление оценок. Домашнее задание. Ход урока. 1.Организационный момент. Проверка готовности учащихся к уроку. 2. Актуализация опорных знаний. Учитель. Вот уже как почти два месяца вы путешествуете по новой для вас стране- стране под названием «Химия». Уже немало вам известно, но ещё очень многое предстоит узнать, ведь мы только лишь попытались изучить одну из областей химии- АТОМ Ы ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Впереди новые области, которые предстоит нам открыть. Но чтобы двинуться в путь дальше, нужно сегодня на уроке повторить, обобщить и закрепить то, что мы уже знаем: строение атома, умения составлять электронные схемы и формулы, определять типы химических связей и кристаллических решёток, составлять схемы образования химических связей. А чтобы было интереснее добиваться поставленных целей разделимся на две команды: Команда «АТОМ» (представление командира и членов команды) Команда «МОЛЕКУЛА» (представление командира и членов команды) 3. Повторение и обобщение знаний по теме «Атомы химических элементов» Начало состязаний Учитель. И так начнём! Первая станция: Станция: « Состав атома» ( за каждый правильный ответ команда получает жетон) 1.Что такое атом? 2.Как устроен атом? 3.Какие из частиц атома имеют о заряд? 4. А почему атом является нейтральной частицей? 5. Какими свойствами обладает электрон? 6.Где в атоме располагаются электроны? С чем это связано? 7. Что такое орбиталь? 8. Какие по форме бывают орбитали? 9.Как определить число электронов в атоме химического элемента? 10.Как называется совокупность всех электронов в атоме? 11.Из каких частиц состоит ядро? 12.Какими свойствами обладают эти частицы? 13.Имеет ли заряд ядро? Какой он по значению? 14.Имеет ли массу атом? Где сосредоточена вся масса атома? 15.Как определить, сколько протонов в атоме? Если изменить в атоме число протонов измениться ли заряд ядра? 16. Как определить, сколько нейтронов в атоме? 17.Как называются разновидности атомов химических элементов имеющие одинаковый заряд ядра, но разную атомную массу? Практическая часть (от каждой команды по два участник поочерёдно ) Задание№1. Для атома фосфора определить чему равен заряд ядра, число электронов, протонов, нейтронов. Задание№2. Запишите для атома алюминия электронную схему и формулу. Сколько энергетических уровней в вашем атоме? Почему? Сколько внешних электронов у атома и численно они равны……………? (оценка правильности выполнения заданий) Станция: « Периодическая система химических элементов Д.И.Менделеева и строение атома» ( за каждый правильный ответ команда получает жетон) 1.Как устроена периодическая система химических элементов Д.И.Менделеева? 2.Как изменяются свойства химических элементов в ПСХЭ? С чем связано такая периодичность? 3. На какие две группы условно можно разделить все элементы периодической системы? 4. Какое количество электронов на внешнем энергетическом уровне у металлов и у неметаллов? 5.Кто легче, металлы или неметаллы, отдают свои внешние электроны. Почему? 6. Как изменяются металлические и неметаллические свойства атомов химических элементов в группе. Почему? 7.Как изменяются металлические и неметаллические свойства атомов химических элементов в периоде. Почему? 8. Что вы понимаете под понятием «атомный радиус» 9 . Отчего в группе (главной подгруппе) радиус атома увеличивается, сверху вниз? 10. Отчего в периоде радиус атома уменьшается слева на право? Практическая часть (от каждой команды по одному участнику) Задание№1.Расположите элементы в порядке увеличения их металлических свойств: Mg, Sr, Ca, Ra, Ba. Кто является самым сильным металлом? Задание№1. Расположите элементы в порядке увеличения их неметаллических свойств: Na, Si, Al, P,Cl . Кто является самым сильным неметаллом? В классе после контрольной работы учителем было найдено 2 шпаргалки. В одной из них была записана электронная формула, а в другой электронная схема неизвестных атомов химических элементов. Определите: -номер группы, -номер периода, -порядковый номер -название химического элемента Задание №2 2 2 6 2 2 1s 2s 2p 3s 3p Задание №2 ) ) ) ) 2 8 8 2 (оценка правильности выполнения заданий) Станция: « Химическая связь» (за каждый правильный ответ команда получает жетон). 1.Что такое химическая связь? 2.Какие виды химической связи вам известны? 3.Какую связь называют ионной? 4. Что такое ион? Какие бывают ионы? 5. Для каких соединений она характерна? 6.Какую химическую связь называют ковалентной? 7.Для каких соединений она характерна? 8. Назовите виды ковалентной связи? Дайте им определения. 9. Какую химическую связь называют металлической? 10. Для каких веществ она характерна? Практическая часть (от каждой команды по одному участнику) Задание№1. Даны вещества: F2, Fe, H2S ,BaCl2 Определите вид химической связи для каждого вещества. Запишите механизм образования химической связи для одного любого из веществ. Задание№2. Запишите механизм образования ионной связи для вещества: CaO Задание №3 Запишите механизм образования ковалентной неполярной связи для простого вещества О2 Задание №4 Запишите механизм образования ковалентной полярной связи для вещества: HCl Задание №5 Запишите механизм образования металлической связи для простого вещества Mg (оценка правильности выполнения заданий) 4.Подведение итогов урока и выставление оценок. Дорогие ребята, вы продемонстрировали свои знания и умения. (Отметить работу учащихся, указать на знания и пробелы в них. Оценить каждого. Дать напутствия: 5 жетонов и более оценка «5» 4 жетона оценка «4» 3 жетона оценка «3») И теперь вы можете продолжать свое путешествие по химической стране в поисках новых знаний. 5.Домашнее задание Повторение основных вопросов темы: «Атомы химических элементов»Подготовка к контрольной работе.