Календарно-тематическое планирование (базовый уровень 1
реклама
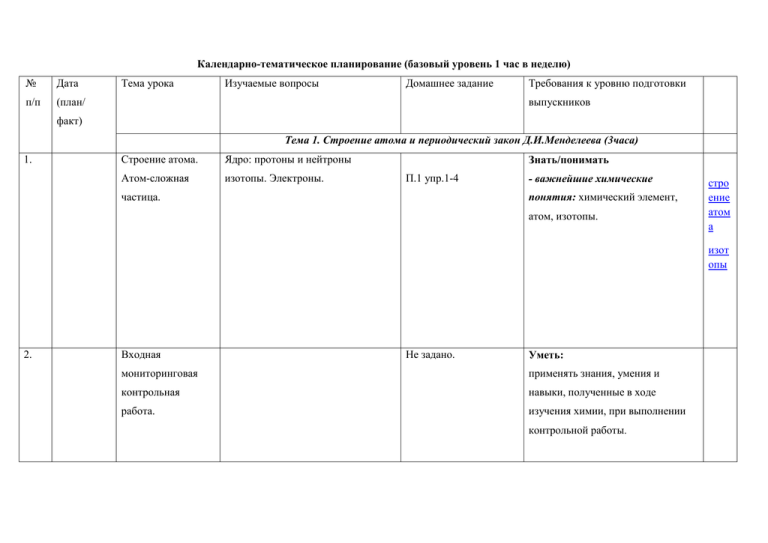
Календарно-тематическое планирование (базовый уровень 1 час в неделю) № Дата п/п (план/ Тема урока Изучаемые вопросы Домашнее задание Требования к уровню подготовки выпускников факт) Тема 1. Строение атома и периодический закон Д.И.Менделеева (3часа) 1. Строение атома. Ядро: протоны и нейтроны Атом-сложная изотопы. Электроны. Знать/понимать П.1 упр.1-4 частица. - важнейшие химические понятия: химический элемент, атом, изотопы. стро ение атом а изот опы 2. Входная Не задано. Уметь: мониторинговая применять знания, умения и контрольная навыки, полученные в ходе работа. изучения химии, при выполнении контрольной работы. 3. Электронные Электронная оболочка. П.1 упр. 5-8 конфигурации Энергетический уровень. Атомные -особенности строения атомов химических орбитали. s-, p, d, f - элементы. электронных оболочек атомов элементов. Особенности строения переходных элементов Знать/понимать электронных оболочек атомов переходных элементов. 4. Периодичес- Периодическая система химических кий закон П.2 упр.1-7 стро ение элек трон ной обол очки Знать/понимать пери элементов Д.И.Менделеева – - основные законы химии: одич Д.И.Менделеева в графическое отображение - периодический закон еская свете учения о периодического закона. Физический Д.И.Менделеева. систе строении атома смысл порядкового номера Уметь ма элемента, номера периода и номера - характеризовать: группы. Валентные электроны. элементы малых периодов по их Причины изменения свойств положению в периодической элементов в периодах и группах системе Д.И.Менделеева. (главных подгруппах). Значение периодического закона. Тема 2. Строение вещества (11часов) 1 (5) Ионная Ионная связь. Катионы и анионы. химическая связь П.3 упр. 3-9 Знать/понимать хими Ионные кристаллические решетки. - важнейшие химические ческа Свойства веществ с этим типом понятия: вещества я кристаллических решеток. немолекулярного строения связь (ионные кристаллические решетки); ион, ионная химическая связь (вещества ионного строения); Уметь - определять: заряд иона, ионную связь в соединениях; - объяснять: природу ионной связи. 2 (6) Ковалентная Электроотрицательность. Полярная и химическая связь П.4 упр. 1-8 Знать/понимать хими неполярная ковалентные связи. - химические понятия: ческа Механизмы ее образования связи электроотрицательность, я (обменный и донорно-акцепторный). валентность, степень окисления, связь Молекулярные и атомные вещества молекулярного и кристаллические решетки. Свойства атомного строения. веществ с этими типами Уметь кристаллических решеток. - определять: Степень окисления и валентность валентность и степень окисления химических элементов. химических элементов, ковалентную (полярную и неполярную) связь в соединениях. - объяснять: природу ковалентной связи. 3(7) Металлическая Особенности строения атомов химическая связь П.5 упр. 1-5 Знать/понимать хими металлов. Металлическая химическая - химическое понятие: ческа связь и металлическая металлическая связь, вещества я кристаллическая решетка. Свойства металлического строения. связь веществ с металлической связью. Уметь - объяснять: природу металлической связи - определять: металлическую связь. 4 (8) Водородная Межмолекулярная и химическая связь внутримолекулярная водородная связь. П.6 упр.1-6 Знать/понимать Значение водородной связи для - химическое понятие: организации структур биополимеров. водородная связь. Единая природа химической связи. Уметь - объяснять: природу водородной связи - определять: водородную связь. хими ческа я связь 5 (9) Газообразное Три агрегатных состояния воды. состояние вещества П.8 упр. 1-4,11-12. Знать/понимать моля Особенности строения газов. - важнейшие химические рный Молярный объем газообразных понятия: объе веществ. Представители газообразных моль, молярная масса, молярный м веществ: водород, кислород, аммиак, объем. углекислый газ, этилен. Их получение, собирание, распознавание. 6 (10) 7 (11) Практическая Химический эксперимент по работа №1 Не задано. Уметь полу получению, собиранию и -выполнять химический чени «Получение, распознаванию водорода, кислорода, эксперимент: по распознаванию е собирание и углекислого газа, аммиака и этилена. водорода, кислорода, газов распознавание углекислого газа, аммиака, газов» этилена Жидкое и Вода, ее биологическая роль. твердое Применение воды. Жесткость воды и состояние способы ее устранения. Кислые соли. вещества Минеральные воды. Жидкие кристаллы и их использование. Кристаллическое и аморфное состояние вещества. Применение П. 9упр.7,п10 упр1-4. аморфных веществ 8 (12) Дисперсные Понятие о дисперсных системах. П.11 упр.1-6 диспе системы Дисперсная фаза и дисперсионная рсны среда. Классификация дисперсных е систем. Грубодисперсные системы. систе Понятие о коллоидах и их значение мы (золи, гели) 9 (13) Состав Закон постоянства состава веществ. вещества. Смеси П.12 упр.6-9 Знать/понимать чист Вещества молекулярного и - важнейшие химические ые немолекулярного строения. понятия: вещества веще Молекулярная формула. Формульная молекулярного и ства единица вещества. Массовая и немолекулярного строения и объемная доля компонента в смеси. - основные законы химии: смес Решение задач закон постоянства состава и веществ 10 Обобщение и Выполнение упражнений и решение (14) систематизация задач Повт.п 1-12 Знать/понимать - теорию химической связи знаний по теме Уметь - объяснять: природу химической связи, зависимость свойств веществ от их состава и строения - определять: тип химической связи в соединениях 11 Контрольная Контроль знаний, умений, навыков, (15) работа №1 по полученных при изучении данной темы. Не задано Уметь: применять знания, умения и теме 1,2 навыки, полученные в ходе «Строение изучения данной темы, при вещества. выполнении контрольной Строение атома» работы. Мониторинг Тема 3. Химические реакции (9часов) 1-2 Классификация Реакции, протекающие без изменения (16- химических 17) Знать/понима ть класси состава веществ: аллотропия,. - химические понятия: фикаци реакций в аллотропные модификации углерода, аллотропия, изомерия, я неорганической серы, фосфора, олова и кислорода; гомология, углеродный скелет, веществ и органической изомеры,. изомерия, реакции тепловой эффект реакции химии изомеризации. Причины многообразия - основные теории химии: веществ: аллотропия и изомерия, строения органических гомология. соединений Реакции, идущие с изменением состава веществ: реакции соединения, разложения, замещения, обмена. Реакции соединения, протекающие при производстве серной кислоты. Экзо - и эндотермические реакции. Тепловой эффект химических реакций. Термохимические уравнения. .п.13,14 упр. 6-9 3 (18) Скорость Скорость химической реакции. П.15 упр.1-5 химической Факторы, влияющие на скорость - химические понятия: реакции химической реакции. Катализаторы и скорость химической реакции, катализ. Представление о ферментах катализ. как биологических катализаторах Уметь белковой природы - объяснять: зависимость Знать/понимать скорости химической реакции от различных факторов. 4 (19) Обратимость Необратимые и обратимые П.16 упр 3-6 химических химические реакции. Химическое - важнейшее химическое реакций равновесие и способы его смещения. понятие: химическое Общие представления о равновесие промышленных способах получения Уметь веществ на примере производства - объяснять: зависимость серной кислоты положения химического Знать/понимать равновесия от различных факторов 5 (20) 6 (21) 7 (22) Роль воды в Истинные растворы. Растворение как химических физико-химический процесс. Явления, - важнейшие химические реакциях происходящие при растворении понятия: веществ, - разрушение растворы, электролит и кристаллической решетки, диффузия, неэлектролит, диссоциация, гидратация, диссоциация электролитическая диссоциация, электролитов в водных растворах. - основные теории химии: Степень электролитической теория электролитической диссоциации, Сильные и слабые диссоциации электролиты. Кислоты, основания, Уметь соли в свете ТЭД - определять: заряд иона Гидролиз Гидролиз неорганических и П.17 упр.10 П.18 упр7-8 Знать/понимать Уметь органических соединений. Среда - определять: водных растворов: кислая, характер среды в водных нейтральная, щелочная. Водородный растворах неорганических показатель (рН) раствора. соединений Окислительно- Степень окисления. Определение П.19 упр3,7,8. восстановительн степени окисления элементов по - важнейшие химические ые реакции формуле соединения. Понятие об понятия: окислительно-восстановительных степень окисления, окислитель реакциях. Окисление и и восстановитель, окисление и восстановление, окислитель и восстановление. восстановитель. Электролиз Уметь Знать/понимать ОВР растворов и расплавов (на примере - определять: хлорида натрия). Практическое степень окисления химических применение электролиза элементов, окислитель и восстановитель 8 (23) Обобщение и Выполнение упражнений и решение систематизация задач Повт. П 13-19 знаний по теме 3 9 (24) Контрольная Контроль знаний, умений, навыков, работа №2 по полученных при изучении данной темы. Не задано. Уметь: применять знания, умения и теме 3 навыки, полученные в ходе «Химические изучения данной темы, при реакции» выполнении контрольной работы. Тема 4. Вещества и их свойства (10 часов) 1-2 Металлы Положение металлов в ПСХЭ Д.И. П.20 упр. 5-7 Знать химич (25- Менделеева. Общие физические - важнейшие вещества и еские 26) свойства металлов. Взаимодействие материалы: свойст металлов с неметаллами (хлором, основные металлы и сплавы. ва серой, кислородом). Взаимодействие Уметь металл щелочных и щелочноземельных - характеризовать: элементы ов металлов с водой. Электрохимический металлы малых периодов по их получе ряд напряжений металлов, положению в периодической ние взаимодействие металлов с растворами системе химических элементов; металл кислот и солей. Общие способы общие химические свойства ов получения металлов. Понятие о металлов; корроз коррозии металлов, способы защиты - объяснять: зависимость ия от коррозии. Сплавы. свойств металлов от их состава металл и строения ов Уметь немета Менделеева. Сравнительная - характеризовать: элементы ллы характеристика галогенов как неметаллы малых периодов по наиболее типичных представителей их положению в периодической неметаллов. Окислительные свойства системе химических элементов; неметаллов (взаимодействие с общие химические свойства металлами и водородом) неметаллов; Восстановительные свойства - объяснять: зависимость 3 (27) Неметаллы Положение неметаллов в ПСХЭ Д.И. П.21 упр.6,7. неметаллов (взаимодействие с более свойств неметаллов от их электроотрицательными неметаллами). состава и строения Благородные газы 4 (28) Кислоты Кислоты неорганические и П.22 упр. 4,5. Знать/понимать кислоты органические. Классификация кислот. - важнейшие вещества и органич Химические свойства кислот: материалы: серная, соляная еские и взаимодействие с металлами, ,азотная, уксусная кислоты неорган основными оксидами, основаниями, Уметь ические солями, спиртами. - характеризовать: общие химические свойства кислот -называть: кислоты по «тривиальной» или международной номенклатуре: - определять: характер среды водных растворов кислот 5 (29) Основания Основания неорганические и П.23 упр.5-7 Уметь основан органические. Классификация - характеризовать: общие ия оснований. Химические свойства химические свойства органич неорганических оснований: оснований; еские и взаимодействие с кислотами, - называть основания по неорган кислотными оксидами и солями. «тривиальной» и ические Разложение нерастворимых международной оснований. номенклатуре; - определять: характер среды водных растворов щелочей 6 (30) Соли Классификация солей: средние, П.24 упр.5 Уметь кислые, основные. Химические - характеризовать: общие свойства солей: взаимодействие с химические свойства солей; кислотами, щелочами, металлами, - называть: соли по солями. Представители солей и их «тривиальной» и значение. Хлорид натрия, фосфат международной номенклатуре; кальция, карбонат кальция (средние - определять: характер среды соли); гидрокарбонаты натрия и водных растворов солей аммония (кислые соли); гидроксокарбонат меди (II) – малахит (основная соль). Качественные реакции на хлорид-.сульфат-, карбонат- ионы, катион аммония, соли катионы железа (II) и (III) 7 (31) Практическая Распознавание неорганических и работа №2. органических соединений Не задано. Уметь решени - выполнять химический е Решение эксперимент по распознаванию экспер эксперименталь важнейших неорганических и имента ных задач на органических соединений льных идентификацию задач неорганических и органических соединений 8 (32) Обобщение и Понятие о генетической связи и систематизация знаний по теме 4 Повт. Материал курса. Уметь генети генетических рядах. Генетический ряд - характеризовать: общие ческая металла. Генетический ряд неметалла. химические свойства металлов, связь Особенности генетического ряда в неметаллов и основных органической химии. классов неорганических и органических соединений 9 (33) Контрольная Контроль знаний, умений, навыков, работа №3 по полученных при изучении данной темы, применять знания, умения и теме 4 курса химии. навыки, полученные в ходе Не задано. Уметь: «Вещества и их изучения данной темы, при свойства» выполнении контрольной Мониторинг. работы. 10 Анализ (34) контрольной работы. Резерв.