Урок физики вдоль теме
advertisement
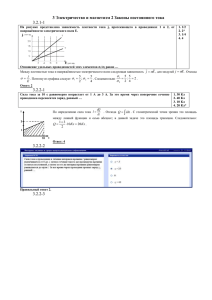
Урок физики по теме "Газовые законы" Цель: активизация познавательной деятельности учащихся при изучении темы за счет включения в исследовательскую работу с использованием ИКТ. Задачи: Образовательные: повторить зависимость между двумя изменяющимися термодинамическими параметрами при неизменном третьем, показать применение газовых законов с помощью эксперимента. Воспитательные: продолжить воспитание личностных качеств: самостоятельности, ответственности, толерантности; формирование взаимопомощи, доброжелательного отношения друг к другу, развивать культуру общения и культуру ответа на вопросы; умение выслушать других при работе в классе, в группах; формировать навыки безопасной работы. Развивающие: развивать приемы исследовательской работы, умения анализировать, делать выводы. вырабатывать умения объяснять газовые законы на основе положений МКТ; описывать состояние и изопроцессы идеального газа, давать и объяснять графическое изображение процессов. План урока № Основные этапы урока Время Приемы и методы 1 Организационный момент. Постановка проблемы/тема урока. 3 мин. Вступительное слово учителя. 2 Актуализация знаний по теме “Изопроцессы” 20мин. Защита проектов учащимися 3 Проверка знаний 15 мин. Тест 4 . Отработка знаний. 5 мин. 5 Анализ урока. 2 мин. Выставление оценок. Ход урока 1. Организационный момент. Звучит музыка. На экране видеосюжет, который показывает красивые кадры о явлениях природы. Учитель читает стихотворение. Физика горда и непреклонна Вместе с тем важна и интересна Надо уважать ее законы Ведь по ним живет наш мир чудесный. Солнце снова всходит и заходит На орбите замерли планеты Много тайн у матушки природы Вам расскажет физика об этом. И всему найдется объясненье В сказках, так конечно, покрасивей Даже тайна вашего рождения – Это просто физика и химия. Горы вырастают на планете. Происходит множество событий Не постичь всего на этом свете, Есть еще возможность для открытий. Каждый день готовит вам сюрпризы, И взрослея, узнаете многое. Пусть ведет вас физика по жизни Точной и проверенной дорогою. С 7 класса мы только знакомились с явлениями природы, а теперь учимся их объяснять с помощью законов физики и химии. И сегодня на уроке мы с вами подводим итог нашему знакомству с газовыми законами. Откроем тетради и подпишем число и тему урока. Вопрос: Вспомним, что называют газовыми законами? Ответ: Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют – газовыми законами. Вопрос: Что понимают под изопроцессами? Ответ: Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Вопрос: Между какими параметрами устанавливается зависимость в газовых законах? Ответ: В газовых законах устанавливается зависимость между объемом, давлением и температурой при постоянном значении одного из этих параметров. Сегодня вы защищаете свои проекты, в которых должны были осветить один из изопроцессов, протекающих в идеальном газе и показать его практическое применение. 2. Актуализация по теме “Изопроцессы”. Группы готовы. Начнем. Выступает 1 группа, которая готовила проект по изотермическому процессу. “Искусство экспериментатора состоит в том, чтобы уметь задавать природе вопросы и понимать ее ответы”. Майкл Фарадей. 1) ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС – это процесс, происходящий в системе при постоянной температуре. Математическая зависимость между параметрами этого процесса была установлена двумя учеными Робертом Бойлем и Эдмом Мариоттом и получила название закона БойляМариотта. ЗАКОН БОЙЛЯ–МАРИОТТА – при неизменной температуре произведение объема данной массы газа на его давление является величиной постоянной. pV = const при T = const Из закона Бойля–Мариотта следует, что при постоянной температуре газа его давление обратно пропорционально объему. Для двух состояний газа можно записать выражение p1 V1 = p2 V2 . Закон Бойля – Мариотта справедлив для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больше атмосферного, отклонения от этого закона становятся существенными. 2) Построим графическую зависимость изотермического процесса в координатных осях P(V); p(T); V(T). 3) Обратимся к исторической справке и познакомимся с биографией Роберта Бойля и Эдма Мариотта. 4) Чтобы проиллюстрировать этот процесс посмотрим опыт “Картезианский водолаз” Оборудование: пластмассовая бутылка 1,5 л, заполненная водой с крышкой; медицинская пипетка, заполненная подкрашенной водой. Опыт: Бутылка наполненная водой внутри которой плавает пипетка. Закроем плотно колбу крышкой и возьмем колбу в руки – пипетка погружается, уберем руки пипетка всплывает объясните действие пипетки. Объяснение: когда ведущий берет мягкую бутылку в руки, он ее сдавливает. Это приводит к увеличению давления внутри бутылки и уменьшения объема пузырька воздуха в пипетке, т.е. по закону Бойля-Мариотта увеличение давления на газ(воздух в пипетке) приводит к уменьшению объема этого воздуха (сжатию). При этом уменьшается сила Архимеда и пипетка тонет. Меняя нажим на бутылку, ведущий имеет возможность изменять эту силу и управлять глубиной погружения пипетки. Для этого принципиально важно, чтобы бутылка была герметично закрыта. Выступает 2 группа, которая готовила проект по изобарному процессу. 1) ИЗОБАРНЫЙ ПРОЦЕСС – это процесс, происходящий в системе при постоянном давлении. Математическая зависимость между параметрами этого процесса была установлена ученым Жозефом Луи Гей-Люссаком и получила название закона Гей-Люссака. ЗАКОН ГЕЙ-ЛЮССАКА – при неизменном давлении отношение объема данной массы газа к его температуре является величиной постоянной. = const при p = const Из закона Гей-Люссака следует, что при постоянном давлении газа его объем прямо пропорционален температуре. Для двух состояний газа можно записать выражение = При увеличении температуры газа в 4 раза, его объем увеличится тоже в 4 раза. 2) Построим графическую зависимость изобарного процесса в координатных осях: p(V); p(T); V(T). Графически изобарный процесс изображается прямой, которая называется изобарой. Различным давлениям соответствуют разные изобары. Изобара соответствующая более высокому давлению, лежит ниже изобары, соответствующей более низкому давлению. Объясним этот процесс с точки зрения молекулярно – кинетической теории: при нагревании газа увеличивается скорость движения молекул, которые при столкновении друг с другом разлетаются на большие расстояния, то есть происходит увеличение объема газа, а при охлаждении – понижении температуры, уменьшается скорость движения молекул, что приводит к уменьшению расстояния между молекулами, так как они уже не могут разлетаться на большие расстояния и объем газа уменьшается. 3) Обратимся к исторической справке и познакомимся с биографией Жозефа Луи ГейЛюссака. 4) Чтобы проиллюстрировать этот процесс посмотрим опыт “Шар в банке”. Оборудование: стеклянная банка на 2 л, воздушный шарик, горячая вода, пустой сосуд. Опыт: в пустую стеклянную банку наливаем горячей воды и держим там 1-2 мин, затем выливаем ее в пустой сосуд. Банку накрываем надутым воздушным шариком и наблюдаем как шарик втягивается в банку. Объяснение: при нагревании воздух в банке расширился, и его часть вышла из банки. При охлаждении воздух в банке сжимается, и шарик заполняет пустое место в банке под действием атмосферного давления, которое на протяжении всего опыта не менялось. Выступает 3 группа, которая готовила проект по изохорному процессу. 1) ИЗОХОРНЫЙ ПРОЦЕСС – это процесс, происходящий в системе при постоянном объеме. Математическая зависимость между параметрами этого процесса была установлена ученым Шарлем, Жак Александром Сезаром и получила название закона Шарля. ЗАКОН Шарля – при неизменном объеме отношение давления данной массы газа к его температуре является величиной постоянной. = const при V = const Из закона Шарля следует, что при постоянном объеме газа его давление прямо пропорционально температуре. Для двух состояний газа можно записать выражение = 2) Построим графическую зависимость изохорного процесса в координатных осях: p(V); p(T); V(T). Эта зависимость изображается прямой, называемой изохорой. Разным объемам соответствуют разные изохоры. Изохора, соответствующая большему объему, располагается ниже изохоры, соответствующей меньшему объему. Объясним этот процесс с точки зрения молекулярно – кинетической теории: при нагревании газа увеличивается скорость движения молекул, которые сильнее ударяют о стенки сосуда, что приводит к увеличению давления. А при охлаждении скорость движения молекул уменьшается, следовательно они реже и слабее ударяют о стенки сосуда , что приводит к уменьшению давления. 3) Обратимся к исторической справке и познакомимся с биографией Шарля, Жак Александра Сезара. 4) Чтобы проиллюстрировать этот процесс посмотрим опыт “Разрушение банки”. Оборудование: пластмассовая или металлическая банка с закручивающейся крышкой, очень горячая вода, сосуд с холодной водой. Опыт: налить горячую воду в банку подержать там 2 мин. и вылить, быстро закрыв отверстие. Затем сразу облить ее холодной водой. Банку сплющит. Объяснение: Во время нагревания вода расширяется, превращаясь в газ – пар. Когда мы закрыли банку крышкой, воздух внутри остался под таким же давлением, как окружающая атмосфера. Охлаждая ёмкость извне, мы заставили пар превращаться обратно в воду. Его давление понизилось, позволяя большему давлению воздуха внешней атмосферы раздавить банку. 3. Отработка знаний по теме “Изопроцессы”. Каждая группа отлично справилась с подготовкой и защитой проектов, а теперь мы применим полученные знания для решения графических задач. 4. Проверка знаний по теме “Изопроцессы”. Вариант 1 1. Как изменится давление идеального одноатомного газа при уменьшении его объема в 4 раза и увеличении абсолютной температуры в 2 раза? A. Увеличится в 8 раз Б.Увеличится в 4 раза B. Увеличится в 2 раза Г. Не изменится 2. Как изменится масса воздуха в помещении, если температура увеличится? А.Уменьшится . Б.Увеличится В. Не изменится 3. Чему равен объем 1 моля идеального газа при нормальных условиях? А.1м3 Б.24м3 В. 0,0224 м3 4. Масса кислорода m при давлении Р занимает объем V. Как изменится температура газа, если при увеличении давления до 2Р его объем уменьшится в V/10? А.Увеличится в 5 раз. Б. Уменьшится в 5 раз. В. Не изменится. 5. В баллоне ,при неизменной массе газа, температура увеличилась от 1 до 2˚С. Как изменилось давление? А.Увеличится в 2 раза. Б. Увеличится 1,004 раза. В. Не изменится. 6. Что и по каким физическим величинам можно вычислить на основании уравнения Менделеева - Клапейрона? 1.Плотность газа, используя R, Р, Т, М 2.Число молекул в газе, используя V, Т, Р, ν 3. Масса молекулы, используя Т, Р, ν, NА, R. А.1,2,3 Б.1,2 В.1,3 Вариант 1 1. Как изменится давление идеального одноатомного газа при уменьшении его объема в 4 раза и увеличении абсолютной температуры в 2 раза? А. Увеличится в 8 раз Б. Увеличится в 4 раза В. Увеличится в 2 раза Г. Не изменится 2. Как изменится масса воздуха в помещении, если температура увеличится? А.Уменьшится . Б.Увеличится В. Не изменится 3. Чему равен объем 1 моля идеального газа при нормальных условиях? А.1м3 Б.24м3 В. 0,0224 м3 4. Масса кислорода m при давлении Р занимает объем V. Как изменится температура газа, если при увеличении давления до 2Р его объем уменьшится в V/10? А.Увеличится в 5 раз. Б. Уменьшится в 5 раз. В. Не изменится. 5. В баллоне ,при неизменной массе газа, температура увеличилась от 1 до 2˚С. Как изменилось давление? А.Увеличится в 2 раза. Б. Увеличится 1,004 раза. В. Не изменится. 6. Что и по каким физическим величинам можно вычислить на основании уравнения Менделеева - Клапейрона? 1.Плотность газа, используя R, Р , Т, М 2.Число молекул в газе, используя V, Т, Р, ν 3. Масса молекулы, используя Т, Р, ν, NА, R. А.1,2,3 Б.1,2 В.1,3 Вариант 2 1.Как изменится давление идеального одноатомного газа при увеличении его объема и абсолютной температуры в 2 раза? А. Увеличится в 4 раз Б.Уменьшится в 2 раза В. Останется прежним 2. Как изменится плотность воздуха в помещении, если температура уменьшится? А. Не изменится. Б. Уменьшится. В. Увеличится. 3. Чему равно давление и температура газа при нормальных условиях? А.p=105Па;t=100˚С Б. p= 105Па;Т=273К В. p=105 кПа; Т=273К 4. При нормальных условиях плотность кислорода: А. Больше плотности водорода. Б.Меньше плотности водорода. В. Равна плотности водорода. 5. При повышении температуры в комнате меняется: А. Давление. Б.Давление и масса. В.Масса воздуха. 6. В цилиндре с поршнем произошло увеличение давления газа больше допустимого за счет увеличения температуры. Как можно установить прежнее давление? А.Увеличением объема цилиндра. Б. Только уменьшением массы газа. В. Только увеличением объема цилиндра. Вариант 2 1.Как изменится давление идеального одноатомного газа при увеличении его объема и абсолютной температуры в 2 раза? А. Увеличится в 4 раз . Б.Уменьшится в 2 раза В. Останется прежним 2. Как изменится плотность воздуха в помещении, если температура уменьшится? А. Не изменится. Б. Уменьшится. В. Увеличится. 3. Чему равно давление и температура газа при нормальных условиях? А.p=105Па;t=100˚С Б. p= 105Па;Т=273К В. p=105 кПа; Т=273К 4. При нормальных условиях плотность кислорода: А. Больше плотности водорода. Б.Меньше плотности водорода. В. Равна плотности водорода. 5. При повышении температуры в комнате меняется: А. Давление. Б.Давление и масса. В.Масса воздуха. 6. В цилиндре с поршнем произошло увеличение давления газа больше допустимого за счет увеличения температуры. Как можно установить прежнее давление? А.Увеличением объема цилиндра. Б. Только уменьшением массы газа. В. Только увеличением объема цилиндра. 5. Рефлексия. Домашнее задание 6. Анализ урока. Выставление оценок.