Урок 1-2
реклама
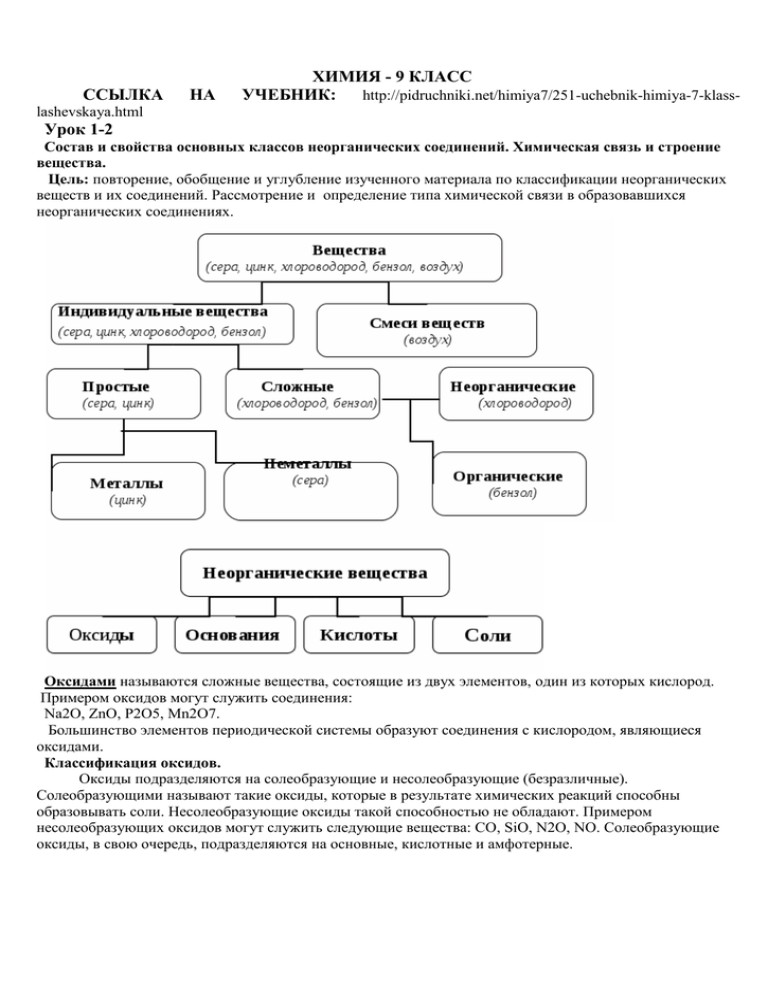
ССЫЛКА НА ХИМИЯ - 9 КЛАСС УЧЕБНИК: http://pidruchniki.net/himiya7/251-uchebnik-himiya-7-klass- lashevskaya.html Урок 1-2 Состав и свойства основных классов неорганических соединений. Химическая связь и строение вещества. Цель: повторение, обобщение и углубление изученного материала по классификации неорганических веществ и их соединений. Рассмотрение и определение типа химической связи в образовавшихся неорганических соединениях. Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Примером оксидов могут служить соединения: Na2O, ZnO, P2O5, Mn2O7. Большинство элементов периодической системы образуют соединения с кислородом, являющиеся оксидами. Классификация оксидов. Оксиды подразделяются на солеобразующие и несолеобразующие (безразличные). Солеобразующими называют такие оксиды, которые в результате химических реакций способны образовывать соли. Несолеобразующие оксиды такой способностью не обладают. Примером несолеобразующих оксидов могут служить следующие вещества: СО, SiO, N2O, NO. Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и амфотерные. Тестовые задания: 1. Оксид, который реагирует с кислотой, образуя соль, — это 1) Р2О5 2) СuО 3) SO2 4) СО2 2. Основным и кислотным оксидами являются соответственно: 1) оксид кальция и оксид алюминия 2) оксид натрия и оксид хрома (VI) 3) оксид магния и оксид бериллия 4) оксид азота (II) и оксид углерода (IV) 3. Не взаимодействует с соляной кислотой 1) оксид азота (IV) 2) оксид меди (II) 3) оксид железа (II) 4) оксид магния 4. Реагирует и с кислотами и щелочами: 1) оксид цинка 2) оксид стронция 3) оксид бария 4) оксид серы (VI) 5. Кислотными оксидами являются все вещества в ряду: 1) MnO, FeO, CuO 2) Mn2O7 , CrO3, SO3 3) NO2, N2O, NO 4) Al2O3, MgO, CO Основания, растворимые в воде, называются щелочами. Большинство оснований в воде нерастворимы. Основания различаются по кислотности. Они бывают однокислотными и многокислотными. Кислотность оснований определяется количеством гидроксильных групп, которые могут быть замещены на кислотные остатки. Основания –сложные вещества, молекулы которых состоят из атомов металлов и гидроксо-групп, способных замещаться на металл Ме(ОН)n, n- число гидроксогрупп. По современной номенклатуре их принято называть гидроксидамиэлементов с указанием степени окисления: NaOH – гидроксид натрия, КОН – гидроксид калия, Сu(OH)2 – гидроксид меди (II). Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Тестовые задания: 1. С разбавленной азотной кислотой реагирует: 1) фосфат алюминия 3) оксид серы (VI) 2) гидроксид магния 4) хлорид натрия 2. С гидроксидом калия и серной кислотой взаимодействует: 1) нитрат меди (II) 2) карбонат натрия 3) оксид цинка 4) сульфат калия 3.Гидроксид лития нельзя получить при взаимодействии: 1)Li и H2O 2) LiCl и KOH 3) Li2O и H2O 4) Li2SO4 и Ba(OH)2 4. Гидроксид натрия реагирует в растворе с каждым веществом набора: 1) Al2O, CO, CuCl2, HCl 2) Al2O3, HNO3, SiO2, CuCl2 3) KNO3, ZnO, H2SO4, CO2 4) CaO, HNO3, SO2, ZnO Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. Общая формула кислот: НхКО, где Нх – атом водорода, а КО – кислотный остаток. Как правило, кислотные остатки образуют элементы - неметаллы. КИСЛОТЫ Бескислородсодержащие HCl, HF, HI, H2S Кислородсодержащие кислоты Бескислородсодержащие кислоты Кислородсодержащие HNO2, HNO3, H2SO3, H2SO4, H2CO3, H2SiO3 Получение кислот Кислотный оксид + SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 Неметалл+сильный P+5HNO3+2H2O=3H3PO4+5NO окислитель Cоль+ менее NaNO3+H2SO4=HNO3+NaHSO4 летучая кислота Водород+неметалл H2+Cl2=2HCl Cоль+менее NaCl+H2SO4=2HCl+NaHSO4 летучая кислота Тестовые задания: 1. Азотную кислоту можно получить по схемам: 1) KNO3(p-p) + H2SO4 (p-p) = 2) NO2 + H2O + O2 = 1. 3) NaNO3(тв) + HCl = 4) KNO3(тв) + H2SO4 (конц) = Серная кислота реагирует в растворе с каждым веществом набора: 1) Cu(OH)2, SiO2, BaCl2, MgO 2) Fe, Zn, Ag, Mg 3) Cu, BaCl2, MgO, Ba(OH)2 4) Na2CO3, Zno, Zn, Mgo Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. На схеме изображена классификация солей. Соли тесно связаны со всеми классами неорганических соединений и могут быть получены практически из любого класса. Способы получения средних солей. Средние соли образуются при взаимодействии: 1) Оснований с кислотами (реакция нейтрализации): Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2) Кислот с основными оксидами: Н2SO4 + MgO = MgSO4 + H2O 3) Солей с кислотами: MgCO3 + 2HNO3 = Mg(NO3)2 + H2O + CO2 4) Двух различных солей: AgNO3 + KCl = AgCl + KNO3 5)Солей с кислотными оксидами (кислотный оксид должен быть менее летуч, чем образующийся в ходе реакции): CaSO3 + SiO2 = CaSiO3 + SO2 6) Оснований с кислотными оксидами: 6NaOH + P2O5 = 2Na3PO4 + 3H2O 7) Оснований с солями: 3NaOH + FeCl3 = 3NaCl + Fe(OH)3↓ 8) Основных оксидов с кислотными: СаО + SiO2 = CaSiO3 9) Металлов с неметаллами: 2K + Cl2 = 2KCl 10) Металлов с кислотами: Mg + 2HCl = MgCl2 + H2 11) Металлов с солями: CuSO4 + Zn = ZnSO4 + Cu↓ 12) Амфотерных металлов с расплавами щелочей: Zn + 2NaOH = Na2ZnO2 + H2 13) Неметаллов со щелочами. Галогены(кроме фтора) и сера взаимодействуют со щелочами, образуя две соли – бескислородной и кислородсодержащей кислот: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O Cl2 + 2KOH = KCl + KClO + H2O 14) Неметаллов с солями: Cl2 +2KI = KCl + I2 15) При нагревании некоторых солей кислородсодержащих кислот образуются соли с меньшим содержанием кислорода или вообще не содержащие его: 2KNO3 = 2KNO2 + O2 t,MnO2 2KClO3 =2KCl +O2 Тестовые задания: 1. Для удаления примеси CuSO4 из раствора сульфата железа (II) следует добавить: 1)NaOH 2) H2S 3) Zn 4) BaCl2 2. Основный и кислотный оксиды образуются при термическим разложении соли: 1) NaNO3 2) KClO3 3) NH4Cl 4) MgCO3 3. К кислым солям относят: 1) H2Cr2O7 2) K2CrO4 3) CsH2PO4 4) Sn(OH)Cl Домашнее задание: повторить генетическую связь между основными классами неорганических соединений, развязать цепочку превращений: А) Сu → CuO → CuCl2→Cu(OH)2→CuSO4 → CuCl2 →Cu(OH)2→CuO→Cu Б) P → P2O5 → H3PO4 → K3PO4 Выучить §1,2 Ответы присылайте по адресу: [email protected] Для Халанской Г.Н. Консультации в школе с 8.00 до 12.00 по вторникам и четвергам
