Лекция «Циклоалканы
реклама

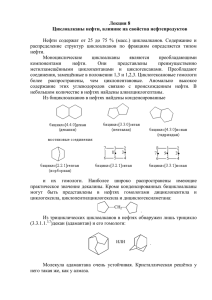
Лекция № 7 Циклоалканы. 1. Определение В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан. Циклопропан Циклобутан Циклопентан Циклогексан Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами 2. Физические свойства Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице. Таблица. Физические свойства некоторых циклоалканов Соединение t°пл., °С t°кип., °С Циклопропан -126,9 -33 Метилциклопропан -177,2 0,7 Циклобутан - 80 13 Метилциклобутан -149,3 36,8 Циклопентан - 94,4 49,3 Метилциклопентан -142,2 71,9 Циклогексан 6,5 80,7 1 3. Изомерия циклоалканов Для циклоалканов характерны как структурная, так и пространственная изомерия. Структурная изомеpия 1. Изомерия углеродного скелета: а) кольца б) боковых цепей 2. Изомерия положения заместителей в кольце: 3. Межклассовая изомерия с алкенами: Пространственная изомерия 1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные 2 2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение 4. Особенности строения циклоалканов Теория Байера - теория «напряжения» -разная прочность циклов. Для циклоалканов характерны следующие виды напряжений: 1) торсионное (Питцеровское) напряжение — связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях; 2) напряжение Ван-дер-Ваальса — обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их вандерваальсовых радиусов; 3) угловое (Байеровское) напряжение — присуще отдельным циклоалканам и связано с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения. Теория напряжения циклов была предложена немецким химиком-органиком А. Байером в 1885 г. Согласно этой теории циклоалканы представляют собой плоские многоугольники. Единственным фактором, определяющим прочность цикла, считалось напряжение, вызванное отклонением внутренних валентных углов цикла по сравнению с тетраэдрическим углом. Малые циклы. Если рассматривать форму циклоалканов в виде простых геометрических фигур, имеющих плоское строение, то можно отметить, что при переходе от одного никла к другому происходит изменение валентного угла. Чем значительнее отклонение, тем выше угловое напряжение и менее устойчив цикл. В соответствии с вышеприведенным, трехчленный цикл менее устойчив, чем четырехчленный, а последний — менее устойчив, чем пятичленный. Эти представления подтверждались накопленным к тому времени экспериментальным материалом. 3 Обычные циклы. Однако для шестичленного цикла экспериментальные данные вступали в противоречия с теорией. Шестичленные циклы (внутренний угол 120º). имеющие значительное отклонение валентных углов, оказались устойчивее пятичленных, в которых внутренние углы наиболее близки к тетраэдрическим. При изучении пространственного строения циклогексана было установлено, что молекула циклогексана существует в 2-х конформациях «кресло» и «ванна». «кресло» «ванна» В конформации «кресло» два типа связей С—Н, одни шесть С—Н-связей расположены вдоль оси симметрии молекулы, а другие шесть — под углом 109° 28'. Двенадцать связей C-H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e - связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a - связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три - в другую (имеется чередование: вверх-вниз). Взаимопревращения в циклогексане протекают настолько быстро, что все атомы водорода циклогексана становятся эквивалентными. Для незамещенного циклогексана обе конформации равноценны. Если же в кольце появляется заместитель, то наиболее энергетически выгодной является конформация с экваториальным положением заместителя. Аксиальное положение заместителя для циклогексана менее выгодно, так как возникает стерическое отталкивание, обусловленное взаимодействием заместителя с аксиально расположенными атомами водорода в положении 3 и 5. экваториальная конформация 4 5. Получение В промышленности 1) Из нефти (пяти- и шестичленных) Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7. 2) Из ароматических углеводородов – каталитическое гидрирование: В лаборатории (циклизация) 1) Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца): Br-CH2-CH2-CH2-Br + Mg - t → MgBr2 + C3H6 или Cl-CH2-CH2-CH2-CH2-Cl + 2Na → 2NaCl + C4H8 2) При действии цинка в этиловом спирте на соответствующее дигалогенпроизводное, цепь углеродных атомов замыкается, приводя к образованию циклоалкана. 6. Химические свойства Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. 5 Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения. 1. Реакции горения: CnH2n + 3n/2O2 - t → nCO2 + nH2O +Q 2. Галогенирование: C3H6 + Br2 → C3H6Br2 циклопропан 1,3-дибромпропан t C6H12 + Br2 - → C6H11Br + HBr бромциклогексан 3. Гидрирование: C4H8 + H2 - t,Ni или Pt → C4H10 циклобутан бутан 300ºС, C6H12 + Н2 ᴾᵗ → C6H14 гексан 4. Гидрогалогенирование (по правилу Марковникова): C3H6 + HI → CH3-CH2-CH2I 1- йодпропан 5. Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского): C6H12 - t=300˚С ,Pt,Pd→ C6H6 + 3H2 бензол 7. Применение Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства. 6