Тематика заданий
реклама
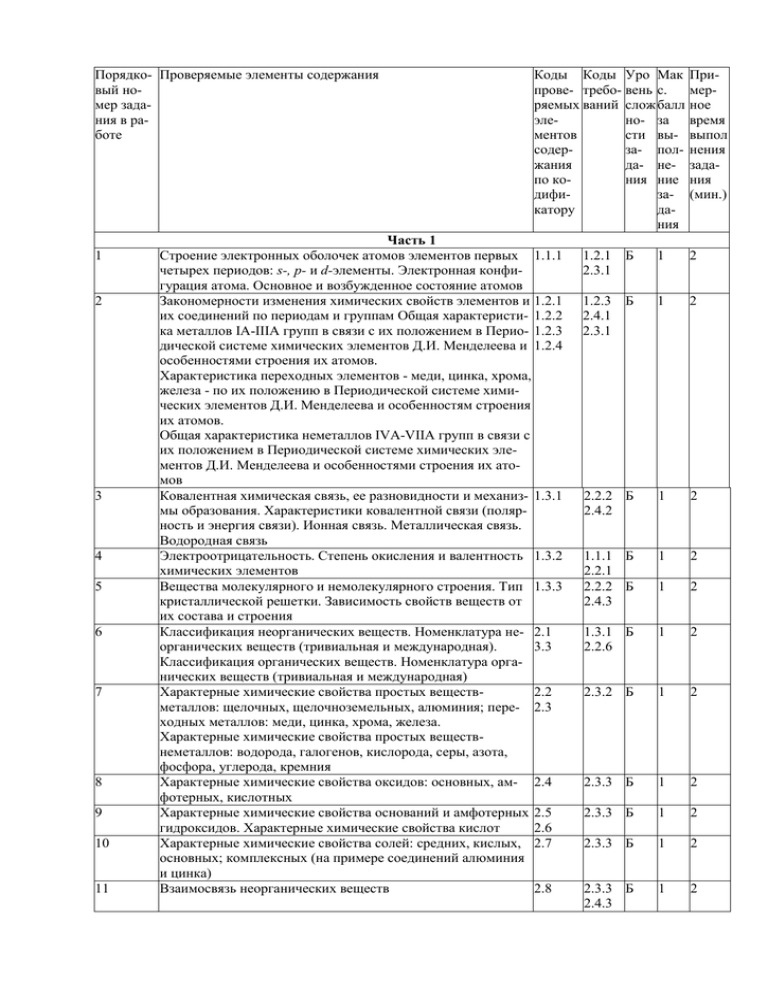
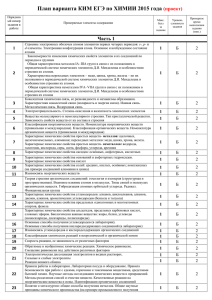
Порядко- Проверяемые элементы содержания вый номер задания в работе 1 2 3 4 5 6 7 8 9 10 11 Коды Коды Уро Мак прове- требо- вень с. ряемых ваний слож балл элено- за ментов сти высодерза- полжания да- непо кония ние дифизакатору дания Часть 1 Строение электронных оболочек атомов элементов первых 1.1.1 четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов Закономерности изменения химических свойств элементов и 1.2.1 их соединений по периодам и группам Общая характеристи- 1.2.2 ка металлов IA-IIIA групп в связи с их положением в Перио- 1.2.3 дической системе химических элементов Д.И. Менделеева и 1.2.4 особенностями строения их атомов. Характеристика переходных элементов - меди, цинка, хрома, железа - по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVA-VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов Ковалентная химическая связь, ее разновидности и механиз- 1.3.1 мы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь Электроотрицательность. Степень окисления и валентность 1.3.2 химических элементов Вещества молекулярного и немолекулярного строения. Тип 1.3.3 кристаллической решетки. Зависимость свойств веществ от их состава и строения Классификация неорганических веществ. Номенклатура не- 2.1 органических веществ (тривиальная и международная). 3.3 Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) Характерные химические свойства простых веществ2.2 металлов: щелочных, щелочноземельных, алюминия; пере- 2.3 ходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществнеметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния Характерные химические свойства оксидов: основных, ам- 2.4 фотерных, кислотных Характерные химические свойства оснований и амфотерных 2.5 гидроксидов. Характерные химические свойства кислот 2.6 Характерные химические свойства солей: средних, кислых, 2.7 основных; комплексных (на примере соединений алюминия и цинка) Взаимосвязь неорганических веществ 2.8 Примерное время выпол нения задания (мин.) 1.2.1 Б 2.3.1 1 2 1.2.3 Б 2.4.1 2.3.1 1 2 2.2.2 Б 2.4.2 1 2 1.1.1 Б 2.2.1 2.2.2 Б 2.4.3 1 2 1 2 1.3.1 Б 2.2.6 1 2 2.3.2 Б 1 2 2.3.3 Б 1 2 2.3.3 Б 1 2 2.3.3 Б 1 2 2.3.3 Б 2.4.3 1 2 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Классификация химических реакций в неорганической и ор- 1.4.1 ганической химии Скорость реакции, ее зависимость от различных факторов 1.4.3 2.2.8 Б 1 2 2.4.5 Б 1 2 Обратимые и необратимые химические реакции. Химиче1.4.4 ское равновесие. Смещение равновесия под действием различных факторов Электролитическая диссоциация электролитов в водных рас- 1.4.5 творах. Сильные и слабые электролиты. Реакции ионного 1.4.6 обмена 2.4.5 Б 1 2 1.1.1 Б 1 2 Правила работы в лаборатории. Лабораторная посуда и обо- 4.1.1 рудование. Правила безопасности при работе с едкими, го- 4.1.2 рючими и токсичными веществами, средствами бытовой хи- 4.1.4 мии. Научные методы исследования химических веществ и 4.1.5 превращений. Методы разделения смесей и очистки веществ. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений Понятие о металлургии: общие способы получения метал- 4.2.1 лов. Общие научные принципы химического производства 4.2.2 (на примере промышленного получения аммиака, серной 4.2.3 кислоты, метанола). Химическое загрязнение окружающей 4.2.4 среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки Вычисление массы растворенного вещества, содержащегося 4.3.1 в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе Расчеты объемных отношений газов при химических реак- 4.3.2 циях. Тепловой эффект химической реакции. Термохимиче- 4.3.4 ские уравнения. Расчеты теплового эффекта реакции Расчеты массы вещества или объема газов по известному 4.3.3 количеству вещества, массе или объему одного из участвующих в реакции веществ Классификация неорганических веществ. Классификация и 2.1 номенклатура органических соединений 3.3 Электроотрицательность. Степень окисления и валентность 1.3.2 химических элементов. 1.4.8 Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее Электролиз расплавов и растворов (солей, щелочей, кислот) 1.4.9 1.2.1 1.3.2 Б 2.2.4 2.4.4 2.5.1 1 2 1.3.3 Б 1.3.4 1 2 2.5.2 П 1 5-7 2.5.2 Б 1 2 2.5.2 П 1 5-7 2.2.8 П 2 5-7 2.2.1 П 2.2.5 2 5-7 1.1.3 П 2.2.5 2.2.4 П 2 5-7 2 5-7 2.3.3 П 2 5-7 Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная Характерные химические свойства неорганических веществ: простых веществ - металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа); простых веществ - неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; оксидов: основных, амфотерных, кислотных; оснований и амфотерных гидроксидов; кислот; солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) 1.4.7 2.2 2.3 2.4 2.5 1.1.2 2.3 2.7 2