V Турнир решения задач
реклама
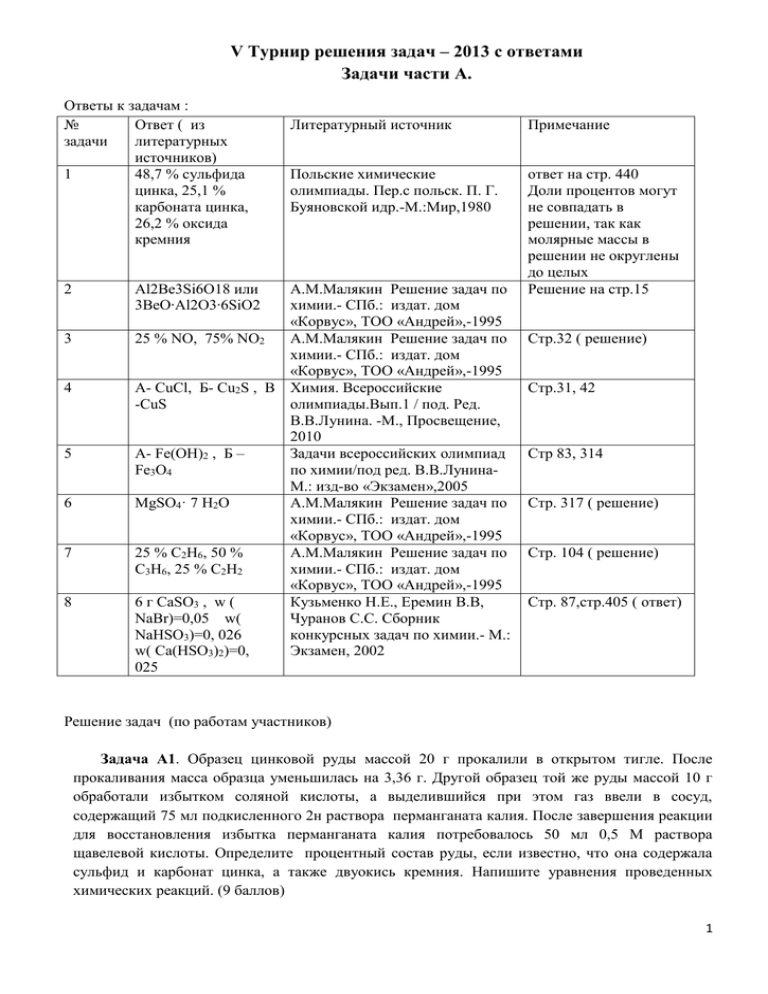
V Турнир решения задач – 2013 с ответами Задачи части А. Ответы к задачам : № Ответ ( из задачи литературных источников) 1 48,7 % сульфида цинка, 25,1 % карбоната цинка, 26,2 % оксида кремния 2 3 4 5 6 7 8 Литературный источник Примечание Польские химические олимпиады. Пер.с польск. П. Г. Буяновской идр.-М.:Мир,1980 ответ на стр. 440 Доли процентов могут не совпадать в решении, так как молярные массы в решении не округлены до целых Решение на стр.15 Al2Be3Si6O18 или 3BeO∙Al2O3∙6SiO2 А.М.Малякин Решение задач по химии.- СПб.: издат. дом «Корвус», ТОО «Андрей»,-1995 25 % NO, 75% NO2 А.М.Малякин Решение задач по химии.- СПб.: издат. дом «Корвус», ТОО «Андрей»,-1995 А- СuCl, Б- Cu2S , В Химия. Всероссийские -CuS олимпиады.Вып.1 / под. Ред. В.В.Лунина. -М., Просвещение, 2010 А- Fe(OH)2 , Б – Задачи всероссийских олимпиад Fe3O4 по химии/под ред. В.В.ЛунинаМ.: изд-во «Экзамен»,2005 MgSO4· 7 Н2О А.М.Малякин Решение задач по химии.- СПб.: издат. дом «Корвус», ТОО «Андрей»,-1995 25 % С2Н6, 50 % А.М.Малякин Решение задач по С3Н6, 25 % С2Н2 химии.- СПб.: издат. дом «Корвус», ТОО «Андрей»,-1995 6 г СаSO3 , w ( Кузьменко Н.Е., Еремин В.В, NaBr)=0,05 w( Чуранов С.С. Сборник NaHSO3)=0, 026 конкурсных задач по химии.- М.: w( Ca(HSO3)2)=0, Экзамен, 2002 025 Стр.32 ( решение) Стр.31, 42 Стр 83, 314 Стр. 317 ( решение) Стр. 104 ( решение) Стр. 87,стр.405 ( ответ) Решение задач (по работам участников) Задача А1. Образец цинковой руды массой 20 г прокалили в открытом тигле. После прокаливания масса образца уменьшилась на 3,36 г. Другой образец той же руды массой 10 г обработали избытком соляной кислоты, а выделившийся при этом газ ввели в сосуд, содержащий 75 мл подкисленного 2н раствора перманганата калия. После завершения реакции для восстановления избытка перманганата калия потребовалось 50 мл 0,5 М раствора щавелевой кислоты. Определите процентный состав руды, если известно, что она содержала сульфид и карбонат цинка, а также двуокись кремния. Напишите уравнения проведенных химических реакций. (9 баллов) 1 Задачу полностью решили только 5 участников. Некоторые ошибочно посчитали, что при прокаливании руды в открытом тигле не будет происходить реакции с сульфидом цинка, и потерю массы при прокаливании посчитали как массу углекислого газа. Привожу решение этой задачи, присланное Какеновым Ауелханом Смаиловичем. А1. Решение: Уравнение реакции сульфида и карбоната цинка, содержащегося в руде с соляной кислотой: ZnCO3+2HCl=ZnCl2+H2O+CO2(1) ZnS+2HCl= ZnCl2+H2S (2) вычислим число г-экв. перманганата калия, вступившего в реакцию с сероводородом : 2KMnO4+5H2S+3H2SO4=2 MnSO4+5S+K2SO4+8H2O (3) В 1000 мл. 2 н. раствора содержится 2 г-экв. KMnO4 75 мл. 2н. раствора ------------------ х г-экв. KMnO4 Откуда х=0,15 г-экв. KMnO4-это первоначальное количество KMnO4 Определим избыток перманганата калия ,вступившего в реакцию с щавелевой кислотой: 5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O(4) В 1000 мл раствора содержится 0,5 моль щавелевой кислоты В 50 мл раствора содержится х моль щавелевой кислоты Х=0,025 моль или 0,05 г-экв. H2C2O4,соответственно в реакцию вступило 0,05 г-экв. KMnO4 Значит, в реакцию с сероводородом вступило 0,15-0,05=0,1 г-экв. KMnO4 Что соответствует 0,1 г-экв.ZnS или 0,05 моль ZnS, таким образом в первоначальном образце содержалось 2 ×0,05 моль=0,1 моль ZnS, а в образце руды массой 20 г содержалось 0,1 ×97=9,7 г.ZnS. При прокаливании руды в открытом тигле происходят реакции: 2ZnS +3O2=2 ZnO+2 SO2 (5) ZnCO3=ZnO+CO2 (6) Из уравнения (5) следует, что 0,1 моль .ZnS даёт 0,1 моль ZnO или 8,1 г.ZnO, т.е в результате окисления сульфида цинка масса образца должна уменьшиться на следующую величину: 9,7-8,1=1,6 г., однако по условию задачи масса образца уменьшилась на 3,36 г., значит при протекании реакции(6) происходит дополнительная убыль массы, в виде углекислого газа, масса которого составит: 3,36-1,6=1,76 г., что составляет 0,04 моль CO2 и соответственно уравнению (6),такое же число молей 0,04 моль ZnCO3 или 125×0,04=5 г. Таким образов в руде массой 20 г. содержалось 9,7 г.ZnS, 5 г. ZnCO3 и 5,3 г.SiO2,что в процентном содержании составит : W (ZnS)=9,7/20×100 %=48,5 % W (ZnCO3)=5/20 ×100 %=25 % W(SiO2)=5,3/20×100 %=26,5 % Возможна также при обжиге реакция образования силиката цинка: ZnO+SiO2=ZnSiO3 Однако это не влияет на ход решения задачи. Задача А2. Минерал берилл содержит 31,3 % кремния, 53,6 % кислорода, алюминий и бериллий. Вывести формулу берилла. (4 балла) Большинство участников полностью справились с решением данной, не самой сложной задачи. Предлагалось несколько вариантов решения, вот одно из них, присланное Давыдовой Натальей Борисовной : Пусть ω (Be) – x%, тогда ω (Al) – 100% - 31,3% - 53,6% - x% = (15,1-х)% 2 ν (Al) : ν (Be) : ν (Si) : ν (O) = 15,1−х 27 : х 9 : 31.3 28 : 53,6 16 = 15,1−х 27 : х 9 : 1,1178 : 3,35 Найдем массовую долю бериллия через степени окисления элементов: (+3) 15,1−х 45.3−3х 27 27 + 2х 9 + (+2) х 9 + (+4) 1,1178 + (-2) 3,35 = 0 + 4,4712 - 6,7 = 0 45,3 – 3х + 6х + 120,7224 – 180,9 = 0 3х = 14,8776 х = 4,9592 ν (Al) : ν (Be) : ν (Si) : ν (O) = 10,14 27 : 5 9 : 31.3 28 : 53,6 16 = 0,3736 : 0,5551 : 1,1178 : 3,35 = 1 : 1,49 : 3 : 9 = 2 : 3 : 6 : 18 Следовательно, молекулярная формула берилла Al2Be3Si6O18 или 3BeO∙Al2O3∙6SiO2 Задача А3. При растворении цинка в растворе азотной кислоты неизвестной концентрации образовалась смесь двух газов, которая при низкой температуре ( -5оС) может быть полностью поглощена раствором гидроксида натрия. 1,12 л полученной смеси газов (в пересчете на нормальные условия) растворили в 20 % -ном растворе щелочи при -5оС. Полученный раствор выпарили досуха и остаток прокалили при 500оС , при этом масса остатка уменьшилась на 0,2 г вследствие выделения простого газообразного вещества. Определите состав газовой смеси в % по объему и напишите уравнения проведенных реакций. (6 баллов) С этой задачей полностью справились только три участника. Основная ошибка была в том, что участники не приняли во внимание взаимодействие между оксидами азота. Решение задачи А3. (на основе решения Давыдовой Натальи Борисовны) При взаимодействии цинка с раствором азотной кислоты могут образоваться следующие газообразные продукты: NH3, N2, N2O, NO, NO2. Аммиак в присутствии азотной кислоты образует нитрат аммония. Азот не реагирует со щёлочью. Оксид азота (I) – несолеобразующий оксид. 3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO↑ + 4H2O (1) Zn + 4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O (2) Смесь NO и NO2 при охлаждении до -360С образует азотистый ангидрид, который устойчив только при низких температурах: NO +NO2 ⇄ N2O3 (3) N2O3 +2NaOH = 2NaNO2 + H2O (4) Но нитрит натрия при температуре не разлагается, значит, в состав смеси входит оксид азота (IV), который при взаимодействии со щелочью образует нитрат натрия: 2NO2 +2NaOH = NaNO3 +NaNO2 + H2O (5) Нитрат натрия разлагается при нагревании: 2NaNO3 = 2NaNO2 + O2↑ (6) Масса остатка уменьшилась на 0,2 г вследствие выделения простого газообразного вещества - кислорода. ν(О2) = 0,2 / 32 = 0,00625 моль ν(NaNO3) в 6 реакции = 2· ν(О2) = 0,00625 · 2 = 0,0125 моль ν(NО2) в 5 реакции =2· ν(NaNO3) = 0,0125· 2 = 0,025 моль ν (газовой смеси NO и NO2 )= 1,12 / 22,4 = 0,05 моль ν (NO и NO2 ) в 3 реакции = 0,05 – 0,025 = 0,025 моль Т.к. соотношение газов в 3 реакции 1:1, то ν(NО2) = ν(NО) = 0,0125 моль ν(NО2)общ. = 0,0125 + 0,025 = 0,0375 моль, V(NО2)общ. = 0,0375 · 22,4 = 0,84 л, φ (NO2) = 0,84 / 1,12 = 0,75; 75% V(NО) = 0,0125 · 22,4 = 0,28 л, φ (NO) = 0,28 / 1,12 = 0,25; 25% Ответ: , φ (NO2) = 75%, φ (NO) = 25% 3 А4. При растворении навески 1,4850 г галогенида А ( содержит 64,19 % масс. металла Х) в избытке концентрированного раствора аммиака получили бесцветный раствор, верхняя часть которого быстро посинела на воздухе. Через полученный раствор пропустили избыток сероводорода. Из раствора выпал осадок смеси бинарных соединений Б и В ( содержание металла Х в соединении Б 79,85 % по массе). Осадок отфильтровали, промыли водой, высушили и взвесили. Его масса составила 1,2419 г. Определите формулы веществ А, Б, В. Ответы подтвердите расчетами. Напишите уравнения описанных реакций. Рассчитайте количественный состав (в % по массе) осадка, выпавшего при пропускании сероводорода. Предложите способ получения галогенида А из металла Х (уравнения реакций с указанием условий их проведения). Будут ли растворяться осадки Б и В в концентрированной а) соляной кислоте, б) азотной кислоте? Если да, напишите уравнения соответствующих реакций. (10 баллов) С этой задачей справились лишь часть участников. Большинство решало задачу методом подбора или основываясь на окраске раствора, выдвигая гипотезы и подтверждая их. Много было предложено способов получения хлорида меди (I ). Привожу решение задачи на основе решения Какенова А. С и авторов этой задачи : А4 Решение: 1). При пропускании H2S через раствор скорее всего выпали в осадок сульфиды. То есть бинарные соединения Б и В - сульфиды металла Х. ω(Ме) = 79,85%. Если общая формула сульфидов Ме2Sn, где n – валентность металла, то: 2М(Ме) 0,7985 = 2М(𝑀𝑒)+32𝑛 , откуда Ar(Me) = 63,4n Пусть n = 1, тогда металл – медь. ( Х) х 2). Определим теперь галоген в соединении CuГх 63,4 0,6419 = 63,4+𝑥∙М(Г) , откуда Ar(Г) = 35,4∙ х Пусть х = 1, тогда Г – хлор. Значит, вещество А – это CuCl. При растворении хлорида меди ( I) в избытке концентрированного раствора аммиака образуется амминокомплекс меди (I), который легко окисляется на воздухе до амминокомплекса меди (II) , что сопровождается изменением окраски раствора. При этом идут следующие реакции: CuCl +2NH3 = [Cu(NH3)2]Cl(1) 4[Cu(NH3)2]Cl + O2 + 8NH3 +2H2O = 4[Cu(NH3)4]ClOH(2) При пропускании сероводорода через полученный раствор, происходят следующие реакции: 2[Cu(NH3)2]Cl + 3H2S = Cu2S + 2NH4HS + 2NH4Cl(3) [Cu(NH3)4]ClOH + 4H2S = CuS + NH4Cl + H2O + 3NH4HS(4) По условию в соединении Б содержится 79,85 %~80% по массе, что совпадает с содержание меди в сульфиде меди(I): ω(Cu в Cu2S) = 128/160 = 0,8 (80%) значит вещество Б-это сульфид меди (I),а вещество В-сульфид меди(II) Теперь рассчитаем массовые доли сульфидов в смеси бинарных соединений. Пусть х — массовая доля Cu2S в смеси сульфидов, тогда (1–х) — доля CuS в смеси Решаем алгебраическое уравнение: 1,2419х•128/160 + 1,2419•(1–х)•64/96 = 1,485•0,6419 0,99352x + 0,827933 – 0,827933x = 0,9532215 x ≈ 0.76 , (1–x) ≈ 0.24 4 состав смеси: ω(Cu2S) = 76,0%, ω(CuS) = 24,0%. Один из способов получения CuCl: 1). Cu + Cl2 = CuCl2 (комн. темп., влага), 2). 2CuCl2 + Na2SO3 + 2NaOH = 2CuCl↓ + Na2SO4 + 2NaCl + H2O(5) Реакции с концентрированной азотной кислотой: Cu2S + 12HNO3(к. t°) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O(6) CuS + 8HNO3(к. t°) = CuSO4 + 8NO2 + 4H2O (7) Сульфиды меди из-за их малорастворимости в кислотах -неокислителях ( соляной кислоте) растворяться не будут. Задача А5. При прокаливании гидроксида А неизвестного металла Э в вакууме был получен твердый бинарный остаток Б (содержит 27,6 % кислорода по массе) и газовая смесь с плотностью по водороду 6,3. Рассчитайте состав газовой смеси в объемных и массовых процентах. Определите формулы А и Б. Ответ подтвердите расчетом. Напишите уравнение протекающей реакции.(7 баллов) С этой задачей справились полностью 10 человек. Многие участники решали задачу подбором, а некоторые предлагали сразу верные вещества, никак это не объясняя. Решение на основе присланного Сысковой Риной Фанировной : Средняя молекулярная масса газовой смеси М (ср) = 6,3 ∙2=12,6 Это меньше молекулярной массы воды, следовательно, газовая смесь содержит легкий газ – водород. Пусть объемная доля воды равна x, водорода - (1-x), тогда: 18x + 2(1-x)=12,6 отсюда x=0,67 в смеси 67% воды по объему, 33% водорода. Уравнение реакции в общем виде: Э(ОН)x = ЭOy +(x-y)H2O +(y-x/2)H2 Учитывая состав газовой смеси: (x-y)/y-x/2)= ɸ (H2O)/ ɸ (H2)=0,67/0,33=2, y=2x/3. Известно содержание кислорода в составе оксида w(O)=16∙(2x/3)/16∙(2x/3)+M(Э) = 0,276, тогда M(Э) =28x, при x=2, M(Э)=56, что соответствует железу. Таким образом, неизвестный гидроксид - это гидроксид железа(II),уравнение разложения которого при прокаливании будет иметь следующий вид: 3Fe(OH)2=Fe3O4+2H2O+H2 Содержание железа в Fe3O4 составляет 64/232•100 %=27,6 %,что соответствует условию задачи. Таким образом вещество: А= Fe(OH)2-гидроксид железа(II) , а Б = Fe3O4(FeO•Fe2O3)-оксид железа(II,III) Задача А6. К 100 г насыщенного при 20о С раствора сульфата магния добавили 1,00 г безводного сульфата магния. В осадок выпал кристаллогидрат, содержащий 1,58 г безводной соли. Определите состав кристаллогидрата, если растворимость сульфата магния при 20оС составляет 35, 1 г безводной соли на 100 г воды.(4 балла) С этой задачей справились многие участники турнира. Предлагались разные способы решения. Один из вариантов: Решение: Определим массовую долю сульфата магния в насыщенном растворе: ω = 35,1/(35,1 + 100) =0,2598 определим массу безводного сульфата магния в 100 г.насыщенного раствора: 5 m (MgSO4) = 100∙0,2598 = 25,98 г. молярная масса кристаллогидрата равна: M(MgSO4∙nH2O) = 120 + 18n Массовая доля безводного сульфата магния в кристаллогидрате: ω(MgSO4) = 120/(120 + 18n) масса кристаллогидрата: m(к.г. ) = (120 + 18n)∙1,58/120 масса безводного сульфата магния после выпадения кристаллогидрата: m(MgSO4) = 25,98 + 1 – 1,58 =25,4 г масса раствора после выпадения кристаллогидрата: m(раствора) = 25,4/0,2598 = 100 + 1 – (120 + 18n)∙1,58/120 101 – 97,7675 – 1,58 = 0,237n; n = 7 Формула кристаллогидрата: MgSO4∙7H2O Задача А7. Смесь этана, пропена и ацетилена занимает объем 448 мл ( н. у. ) и может обесцветить 40 мл 5%-ного раствора брома в четыреххлористом углероде (плотность 1,6 г/ мл). Минимальный объем раствора гидроксида калия (содержащего в 1 л раствора один моль гидроксида калия), которым можно поглотить весь углекислый газ, образовавшийся при полном сгорании исходной смеси, равен 50 мл. Определите объемную долю газов в исходной смеси. (8 баллов) С этой задачей справились многие участники. Те, кто ошибся, в основном брали вместо кислой соли среднюю . Решение: 1)Введём условные обозначения для углеводородов в смеси: х моль- C2H6, у моль C3H6 - у моль, C2H2 -z моль число молей смеси ν(смеси)=0,448/22,4=0,02моль х+у+z=0.02 (1) 2) Количество брома , вступившего в реакцию с пропеном и ацетиленом: ν(Br2)=V • ρ•w/M=40•1,6•0,05/160=0,02 моль рассчитаем число молей брома , вступившего в реакцию с пропеном: у моль у моль C3H6 + Br2 = C3H6Br2 а также ацетиленом: zмоль 2z моль C2H2 + 2Br2 = C2H2Br4 у+2z=0.02(2) 3) Определим количество гидроксида калия, поглотившего углекислый газ от сжигания углеводородов: ν(KOH)=0,05л.•1моль/1л.=0,05 моль из уравнения горения смеси получаем: x моль 2x моль 2C2H6+7O2=4CO2+6H2O y моль 3y моль 2C3H6+9O2=6CO2+6H2O z моль 2z моль 2C2H2+5O2=4CO2+2H2O Поскольку в условии говорится о минимальном объёме растворе гидроксида калия, то при поглощении углекислого газа образуется кислая соль (гидрокарбонат калия): 6 2x+3y+2z моль 0,05 моль CO2 + KOH = KHCO3 Из мольного соотношении 1:1, составляем математическое уравнение: 2x+3y+2z=0.05(3) получаем систему из трех уравнений(1),(2),(3): х+у+z=0,02 у+2z=0,02 2x+3y+2z=0,05 X=0,005 моль C2H6, y =0,01 моль C3H6 и z =0,005 моль C2H2 Объёмные доли компонентов в исходной смеси посчитаем, исходя из того, что для газов объёмные доли равны мольным долям: φ(C2H6)=0,005/0,02=0,25 φ(C3H6)=0,01/0,02=0,5 φ(C2H2)= 0,005/0,02=0,25 Задача А8. К 400 г 5 %-ного раствора бромида кальция добавили 18,9 г сульфита натрия. Через образовавшуюся смесь пропустили при перемешивании 2,24 л оксида серы (IV) (н.у.). Определите массу полученного осадка и массовые доли веществ в образовавшемся растворе. (7 баллов). Типичной ошибкой при решении данной задачи было то, что ряд участников не учли взаимодействие избытка сульфита натрия с оксидом серы, оксида серы с сульфитом кальция. Некоторые участники писали только реакцию с сульфитом кальция, были и арифметические ошибки. Решение : А8 CaBr2 + Na2SO3 = 2NaBr + CaSO3 (1) ν(Na2SO3) = ν(СaBr2) = 18,9 = 0,15 моль – избыток 126 400∙0,05 200 = 0,1 моль ν(СaBr2) : ν(Na2SO3) = 1:1 по (1): νост.(Na2SO3) = 0,15 – 0,1 = 0,05 моль СaSO3 + SO2 + H2O = Ca(HSO3)2 (2) Na2SO3 + SO2 + H2O = 2NaHSO3 (3) SO2 реагирует с оставшимся в растворе Na2SO3 , а потом и с CaSO3 2,24 ν(SO2) = 22,4 = 0,1 моль ν(Na2SO3) = ν(SO2) = 0,05 моль ν(SO2) = 0,1 – 0,05 = 0,05 моль прореагировало с CaSO3 по (3): ν(CaSO3) = ν(SO2) = 0,05 моль осталось в осадке: 0,1 – 0,05 = 0,05 моль CaSO3 mост.(CaSO3) = 0,05∙ 120 = 6 г В конечном растворе находится : 0,2 моль NaBr (0,2∙ 103 = 20,6 г ) 0,05 моль Ca(HSO3)2 (0,05∙202 = 10,1 г) 0,1 моль NaHSO3 (0,1∙ 104 = 10,4 г) mраствора = 400 + 18,9 + 0,1∙ 64 − 6 = 419,3 г 𝟐𝟎,𝟔 ω(NaBr) = 𝟒𝟏𝟗,𝟑 ∙ 𝟏𝟎𝟎% = 𝟒, 𝟗% 𝟏𝟎,𝟒 ω(NaHSO3) = 𝟒𝟏𝟗,𝟑 ∙ 𝟏𝟎𝟎% = 𝟐, 𝟒𝟖% 𝟏𝟎,𝟏 ω(Ca(HSO3)2) = 𝟒𝟏𝟗,𝟑 ∙ 𝟏𝟎𝟎% = 𝟐, 𝟒𝟏% Спасибо всем участникам турнира! 7





