АОО «Назарбаев Интеллектуальные школы» Экзаменационная (письменная) работа по химии
реклама
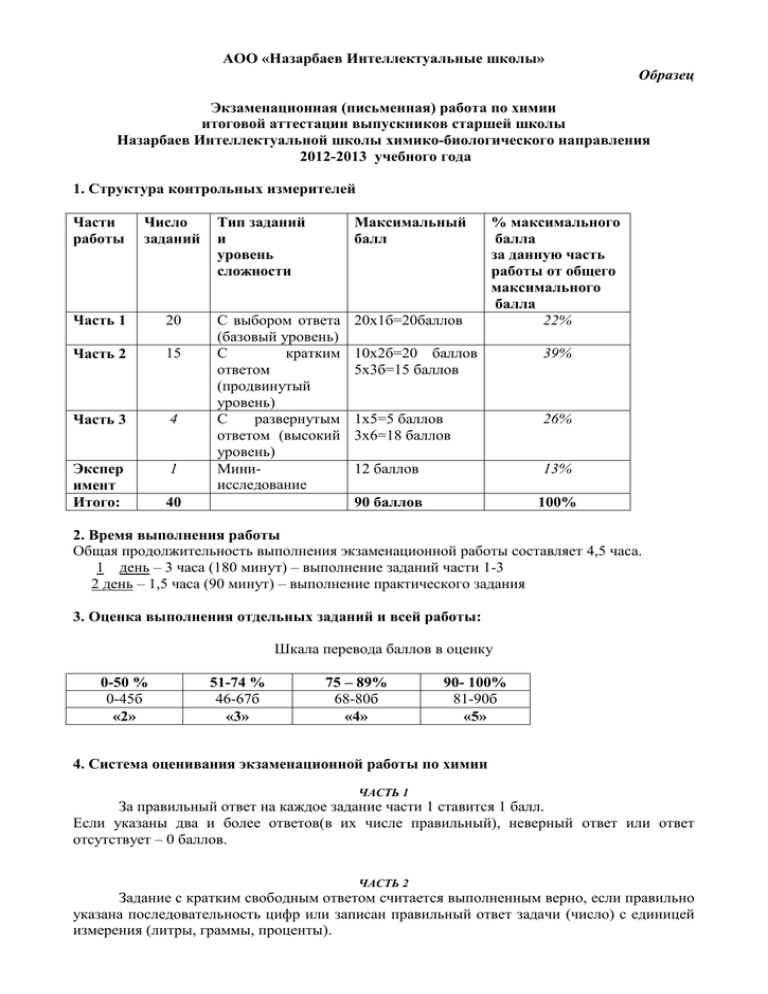
АОО «Назарбаев Интеллектуальные школы» Образец Экзаменационная (письменная) работа по химии итоговой аттестации выпускников старшей школы Назарбаев Интеллектуальной школы химико-биологического направления 2012-2013 учебного года 1. Структура контрольных измерителей Части работы Число заданий Часть 1 20 Часть 2 15 Часть 3 4 Экспер имент Итого: 1 Тип заданий и уровень сложности Максимальный балл С выбором ответа (базовый уровень) С кратким ответом (продвинутый уровень) С развернутым ответом (высокий уровень) Миниисследование 20х1б=20баллов 40 % максимального балла за данную часть работы от общего максимального балла 22% 10х2б=20 баллов 5х3б=15 баллов 39% 1х5=5 баллов 3х6=18 баллов 26% 12 баллов 13% 90 баллов 100% 2. Время выполнения работы Общая продолжительность выполнения экзаменационной работы составляет 4,5 часа. 1 день – 3 часа (180 минут) – выполнение заданий части 1-3 2 день – 1,5 часа (90 минут) – выполнение практического задания 3. Оценка выполнения отдельных заданий и всей работы: Шкала перевода баллов в оценку 0-50 % 0-45б «2» 51-74 % 46-67б «3» 75 – 89% 68-80б «4» 90- 100% 81-90б «5» 4. Система оценивания экзаменационной работы по химии ЧАСТЬ 1 За правильный ответ на каждое задание части 1 ставится 1 балл. Если указаны два и более ответов(в их числе правильный), неверный ответ или ответ отсутствует – 0 баллов. ЧАСТЬ 2 Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр или записан правильный ответ задачи (число) с единицей измерения (литры, граммы, проценты). - За полный правильный ответ в заданиях второй частина установление соответствия позиций ставится по 2 балла, допущена одна ошибка – 1 балл, за неверный ответ или его отсутствие – 0 баллов. - За полный правильный ответ в заданиях второй частина решение простых расчетных задач ставится по 2 балла, если ответ правильный, но нет единиц измерения – 1 балл, за неверный ответ или его отсутствие – 0 баллов. - За полный ответ в заданиях 22, 23, 26, 32, 34 на установление последовательности позиций ставится по 3 балла, допущена одна ошибка 2 балла, две ошибки – 1 балл, за неверный ответ или его отсутствие – 0 баллов. Часть 3 Критерии проверки и оценки выполнения заданий с развернутым ответом № Содержание верного ответа и указания по Баллы задания оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Правильно определил степени окисления атомов 1 36 элементов Выписал элементы, у которых изменились степени 1 окисления в ходе реакции, составил электронные уравнения, указав число отданных и принятых электронов Правильно составил уравнения электронного 1 баланса Правильно определил процессы окисления и 1 восстановления, определил окислитель и восстановитель Правильно расставил коэффициенты перед 1 формулами веществ, составить уравнение реакции Правильно составил и записал первое уравнение 1 37 реакции ,указал условия протекания Правильно составил и записал второе уравнение 1 реакции ,указал условия протекания Правильно составил и записал третье уравнение 1 реакции, указал условия протекания Правильно составил и записал четвертое уравнение 1 реакции, указал условия протекания Правильно составил и записал пятое уравнение 1 реакции Правильно составил и записал шестое уравнение 1 реакции Вычислить массы растворов по объёму и плотности 1 38 растворов Вычислить массы растворенных веществ в 1 растворах Рассчитать мольный фактор веществ 1 Составить пропорцию по уравнению реакции 1 Определить , какое из исходных веществ взято в 1 избытке и его массу Определить массу продукта реакции 1 Записать краткое условие задачи 1 39 Определить массы углерода по объёму углекислого 1 газа Определить массу водорода по массе воды 1 Максимальный балл 5 баллов 6 баллов 6 баллов 6 баллов Вычислить массу кислорода в веществе Определить количества углерода , водорода и кислорода в веществе. Определить простейшую формулу вещества Определил молекулярную массу и молекулярную формулу вещества 1 1 1 5. Дополнительные материалы и оборудование К каждому варианту экзаменационной работы прилагаются следующие материалы: − Периодическая система химических элементов Д.И. Менделеева; − Таблица растворимости солей, кислот и оснований в воде; − Электрохимический ряд напряжений металлов. Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор. Перед выполнением практического задания необходимо провести инструктаж по технике безопасности. Названный перечень дополнительных материалов утверждается АОО «НИШ». 1 Вариант 1 2 3 4 5 6 Часть 1 (№1-20 - задания с выбором ответа) В молекуле пропана С-Н связи образуются с участием A) s-электронов B) p-электронов C) sp2-гибридных орбиталей D) sp- гибридных орбиталей E) sp3- гибридных орбиталей Какие вещества являются изомерами? A) н-пентан и пропан B) 2-метилпропан и пропан C) бензол и циклогексан D) бутен-1 и бутин-1 E) гексан и 2,3-диметилбутан При пропускании этилена через склянку с бромной водой масса склянки увеличилась на 5,6 граммов. Рассчитайте объём этилена (н.у.) и массу брома. A) 4,48 л и 32 г B) 4,48 л и 16 г C) 2,24 л и 32 г D) 2,24 л и 16 г E) 3,36 л и 32 г В молекуле толуола число σ- связей составляет: A) 15 B) 10 C) 13 D) 16 E) 14 Нехимические процессы переработки нефти: A) перегонка нефти B) каталитический крекинг нефти C) риформинг нефти D) пиролиз нефтепродуктов E) термический крекинг нефти Спирт, который образуется при гидратации бутена-1: A) первичный 7 8 9 B) вторичный C) третичный D) четвертичный E) двухатомный Вещество, у которого кислотные свойства наиболее ярко выражены: A) этанол B) этандиол C) глицерин D) уксусная кислота E) пропанол При окислении 74 г бутанола образовалось 50,4 г альдегида. Массовая доля выхода продукта (%): A) 40 B) 50 C) 56 D) 70 E) 56 Различие между α-и ß-формами глюкозы заключается в том ,что A) первая форма имеет линейную, вторая -циклическую структуру B) в молекулах содержится разное число гидроксильных групп C) в молекулах содержится разное число атомов углерода в цикле D) первая форма содержит альдегидную группу, а вторая- не содержит E) гидроксильные группы, содержащиеся в их молекулах, расположены поразному H2 3Br2 10 Вещество Z в превращениях :С6Н6HNO3 → Х→ У→ Z A) бромид фениламмония B) нитробензол C) 4-броманилин D) 2,4,6-триброманилин E) 2-броманилин 11 После заполнения 5р-подуровня в атомах элементов заполняется: A) 5d- подуровень B) 7s- подуровень C) 6s- подуровень D) 4d - подуровень E) 4f - подуровень 12 Элемент с с порядковым номером 15 имеет электронную формулу внешнего энергетического уровня: A) 3s13p4 B) 3s33p2 C) 3s23p3 D) 3s03p5 E) 3s43p1 13 Молекула ССl4 содержит связи: A) 1σ и 1π B) 2σ и 2π C) 3σ и 1π D) 4σ E) 4π 14 В какой реакции сера является восстановителем: A) Сu +Н2SO4(конц) → CuSO4 + SO2 + H2O B) H2 + S → H2S C) SO2 + O2 → SO3 D) Н2SO4(раствор) +Zn → ZnSO4 + H2 E) Н2SO4 + CuO → CuSO4 + H2O 15 Cокращённое ионное уравнение 2H+ + CO2-3→H2O + CO2 соответствует реакции между: A) карбонатом кальция и раствором соляной кислоты B) растворами карбоната натрия и гидроксида кальция C) растворами карбоната натрия и соляной кислоты D) растворами соляной и угольной кислот E) растворами гидрокарбоната натрия и соляной кислоты 16 Объём хлора (н.у), необходимый для реакции с 28 г железа : A) 22,4 л B) 16,8 л C) 11,2 л D) 5,6 л E) 33,6 л 17 В цепочке превращений ZnS→ZnO→X→ZnCl2 определите вещество X A) Н2ZnО2 B) ZnSO4 C) Zn(OH)2 D) Zn(NO3)2 E) Zn3(РО4)2 18 Характерные химические свойства карбонатов: взаимодействие с: 1) солями; 2) основаниями; 3) кислотами; 4) основными оксидами; 5) гидролиз в растворе с образованием щелочной среды; 6) гидролиз в растворе с образованием кислой среды. Какие из этих свойств соответствуют действительности? A) 1, 2, 3, 4 B) 1,3,5 C) 2,3, 5, 6 D) 3,4,5,6 E) 1,3,4,5 19 В растворе объёмом 500 мл находится вещество массой 0,588 г с молярной концентрацией 0,012 моль/л. Укажите молярную массу вещества A) 40 B) 56 C) 98 D) 106 E) 74 20 Чтобы сместить равновесие реакции N2 + 3H2↔ 2NH3 +𝑄 вправо, нужно: A) понизить температуру B) понизить температуру и давление C) повысить температуру и давление D) понизить температуру и повысить давление E) понизить давление Ключи правильных ответов № задания 1 2 3 4 5 6 7 Ответ Е Е А А А В D № задания 11 12 13 14 15 16 17 Ответ С С D С С В В D Е D 8 9 10 В С D 18 19 20 Часть 2 (№ 21-35) – задания с кратким ответом 21. Установите соответствие между названием гомологического ряда, к которому оно принадлежит НАЗВАНИЯ ВЕЩЕСТВА A) пропаналь B) бутанол C)масляная кислота D)пентан соединения и общей формулой ОБЩАЯ ФОРМУЛА 1) CnH2n+2 2) CnH2nО2 3) CnH2n+1ОН 4) CnH2n+1 СОН 5) CnH2n-6 Ответ: А В С D 22 Для этана характерны: 1) реакция гидрирования 2) тетраэдрическая форма молекулы 3) в молекуле есть π- связь 4) у атома углерода в молекуле sp3-гибридизация 5) неустойчив к окислению Ответ : ___________________ (запишите цифры в порядке возрастания) 23 Какие из ниже приведенных реакций протекают согласно правилу Марковникова? 1) nCH2= CH2 → (-CH2-CH2-)n 2) CH2=CH2 + H2 → CH3-CH3 3) CH3-C=CH2 + HBr → CH3-CBr – CH3 │ │ CH3 CH3 4) C2H6 + Cl2 → C2H5Cl + HCl 5) CH3 – CH=CH2 + HBr → CH3-CHBr-CH3 Ответ : ___________________ (запишите цифры в порядке возрастания) 24 Для толуола характерны реакции: 1) не окисляется 2) окисляется с образованием бензойной кислоты 3) реагируя с азотной кислотой образует ТНТ (тринитротолуол) 4) при взаимодействии с хлором образует гексахлоран 5) не горит Ответ : ___________________ (запишите цифры в порядке возрастания) 25 Вычислите объём кислорода ( при н.у.), необходимый для сжигания 1 м3 природного газа (в его составе 95% метана) Ответ: _______________. 26 С какими из ниже перечисленных веществ будет регагировать этиленгликоль? 1) свежеприготовленный гидроксид меди (II) 2) вода 3) металлический натрий 4) гидроксид железа (III) 5) бензол 6) муравьиная кислота Ответ : ___________________. (запишите цифры в порядке возрастания) 27 Установите соответствие между углеводами и их принадлежностью к определенному классу: УГЛЕВОДЫ КЛАССЫ A) глюкоза 1) полисахарид B) рибоза 2) дисахарид C) сахароза 3) гексоза D)целлюлоза 4) тетраоза 5) пентоза Ответ: А В С D 28 Укажите соответствие между формулой соединения и его названием: ФОРМУЛА НАЗВАНИЯ A) CH2-COOH 1) анилин │ 2) глицерин NH2 3) каболовая кислота B) C6H5-NH2 4) масляная кислота C) CH2─ CH─ CH2 5) аминоуксусная │ │ │ кислота OH OH OH D) C6H5-OH E) CH3-CH2-CH2-СOOH Ответ: А В С D Е 29 Укажите соответствие между формулой и электронной конфигурацией частицы: ФОРМУЛА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ A) N-3 1) 1s1 + B)К 2) 1s22s22p63s23p6 C) S 3)1s22s22p0 D) Н 4)1s22s22p6 5)1s22s22p63s23p4 Ответ: А В С D 30 Установите соответствие между соединением и типом химической связи в нем. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту СОЕДИНЕНИЕ ТИП СВЯЗИ A) KCl 1) ковалентная полярная B) MgSO4 2) ковалентная неполярная C) NH4NO3 3) ионная D) Mg 4) металлическая E) O3 Ответ : А В С D Е 31 Укажите соответствие между между веществами, с которыми реагирует железо и формулами продуктов реакций. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту. ВЕЩЕСТВА ФОРМУЛА A) Сера 1) FeCl2 B) Кислород 2) FeCl3 C) Хлор 3) FeS D) Хлороводородная 4) Fe2S3 кислота 5) FeO 6) Fe3O4 Ответ: А В С D 32 Определите вещества А, B,С, D в схеме превращений: О2 К 𝐻2 𝑂 Н2 𝑆𝑂4 К− → A − →B − → C → D Среди нижеперечисленных соединений выбери правильную последовательность веществА, B,С, D: 1) сульфит калия 5) сульфат калия 2)оксид калияі 6) гидроксид калия 3) карбонат калия 4) пероксид калия Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту Ответ: ____________________________. 33 Смешали50 г раствора гидроксида натрия с массовой долей 15% и 40 г 10% - ного раствора того же вещества. Массовая доля вещества в полученном растворе равна ___________________. (округлите до целого цисла) 34 Химическая реакция с температурным коэффициентом равным двум при температуре 60оС идет 32 минуты. Установите соответствие между температурой проведения этой реакции и времени, за которые реакция закончитс при этой температуре. Ответ дайте в виде последовательности цифры соответствующих буквам по алфавиту. ТЕМПЕРАТУРА ВРЕМЯ РЕАКЦИИ A) 40оС B) 80оС C) 50оС D) 100оС 1) 2минуты 2) 8минут 3) 16минут 4) 64минуты 5) 128минут Ответ: А В С D 35 Сколько алюминия ( в тоннах) можно получить из 1 т боксита, в составе которого 65% оксида алюминия Ответ _________. № задания 21 Ответ 22 А В С D 4 3 2 1 2, 4 23 3,5 № задания 29 30 31 Ответ А В С D 4 2 5 1 А В С D Е 3 1,3 1,3 4 2 А В С D 24 25 26 2,3 1900 л 1,3,6 32 33 34 А В С D 3 5 2 1 А В С D 5 1 2 3 27 28 3 6 А-4, В-2, 13% А В 5 2 0,34 т 35 2 1 С-6, D-5 С 4 D 1 Е 4 Часть 3 (36-39 задания.Задания с развернутым ответом ) 36 Расставьте коэффициенты в схеме окислительно-восстановительной реакции методом электронного баланса: FeSO4+HNO3→Fe(NO3)3+NO+H2SO4+H2O 37 Напишите уравнения реакций для осуществления следующих превращений. С →СН4 → СН3СL → NaОН →Na2CO3 →NaHCO3 ↓ C2H2 38 К раствору соляной кислоты объемом 200мл плотностью 1,098г/мл и массовой долей 20% прибавили 300мл гидроксида калия плотностью 1,09 г/мл массовой долей 10%. Вычислите массу полученной соли и массу неизрасходованного исходного вещества. 39 При сгорении 6 гнеизвестного органического вещества образовалось 6,72 л углекислого газа (н.у.) и 7,2 г воды.Относительная плотность паров спирта по воздуху равна 2,067. Найдите формулу неизвестного вещества. Решения заданий с развернутым ответом № 36 FeSO4+HNO3→Fe(NO3)3+NO+H2SO4+H2O Определить степени окисления элементов и проставить их над знаками химических элементов +2 +6-2 +1 +5 -2 +3 +5-2 +2-2 +1 +6 -2 1 +1 -2 FeSO4+HNO3→Fe(NO3)3+NO+H2SO4+H2O Выписать элементы, у которых изменились степени окисления элементов и составить электронные уравнения с указанием числа отданных и принятых электронов: +2 Баллы 1 +3 Fe -1e→Fe +5 +2 N + 3e→N Составить уравнения электронного баланса: +2 +3 +2 Fe -1e→Fe +5 +2 +3 3Fe -3e→3Fe 3 +5 +2 N + 3e→N N + 3e→N Указать окислитель, восстановитель, процессы окисления и восстановления: 3 +2 +3 Fe -1e→Fe +5 +2 1 3Fe -3e→3Fe 3 вос-ль окисление 1 Максимальное количество баллов 5 баллов N + 3e→N N + 3e→N окис-ль восст-ние Поставить найденные коэфициентыперед формулами веществ, составить уравнение реакции: +2 №37 № 38 +5 +3 1 +2 3FeSO4+10 HNO3→3Fe(NO3)3+NO+3H2SO4+2H2O Напишите уравнения реакций для осуществления 6 баллов следующих превращений. С → CH4→ СН3СL → NaCl →Na OH→NaHCO3 ↓ C2H2 Указать условия протекания и правильно составить 1 первое уравнение реакцииі: С + 2Н2 t= СН4 Указать условия протекания и правильно составить 1 второе уравнение реакции : 2СН4 1500 С С2Н2 + 3Н2 Указать условия протекания и правильно составить 1 третье уравнение реакции: СН4+ Cl2 h ν CH3Cl + HCl Указать условия протекания и правильно составить 1 четвёртое уравнение реакции : CH3Cl + 2Na + CH3Cl = 2NaCl + C2H6 Указать условия протекания и правильно составить 1 пятое уравнение реакции: 2NaCl + 2H2O электролиз 2NaOH + H2 + Cl2 Указать условия протекания и правильно составить 1 шестое уравнение реакции: NaOH + H2CO3 = NaHCO3 + H2O К раствору соляной кислоты объемом 200мл 6 баллов плотностью 1,098г/мл и массовой долей 20% прибавили 300мл гидроксида калия плотностью 1,09 г/мл массовой долей 10%. Вычислите массу полученной соли и массу неизрасходованного исходного вещества. (43,5 ;1, 29 ) Дано : Решение: V(р-раHCl) = 200 мл 𝑚(вещ−ва) 𝜔(вещ − ва) = 𝑚(р−ра) • 100% ρ(р-раHCl) = 1,098 ω(HCl) = 20% 𝜔(вещ − ва) • 𝑚 (р − ра) V(р-раKOH) = 300 мл (. вещ − ва) = 𝑚 Ρ(р-раKOH) = 1,09 г/мл 100% ω(KOH) = 10% m(р-ра) = V (р-ра) •ρ(р-ра) Найти: m(KCl) =? m(неизрасх вещ-ва ) = ? Вычисляем массы растворов веществ, используя 1 объём и плотность растворов, m(р-раHCl) = V (р-ра HCl) •ρ(р-раHCl) m(р-ра HCl) = 200 • 1,098 = 219,6 г m(р-раКОН) = V(р-раКОН) •ρ(р-раКОН ) m(р-раКОН) = 300 •1,09 = 327 г Вычисляем массы веществ в растворах: 1 𝜔(𝐻𝐶𝑙ер. з) • 𝑚 (𝐻𝐶𝑙ер − ді) 𝑚 (𝐻𝐶𝑙ер. з) = 100% 𝑚 (𝐻𝐶𝑙ер. з) = 20%•219,6 100% = 43,92 г 10%•327 𝑚 (𝐾𝑂𝐻ер. з) = 100% = 65,4 г Составляем уравнение реакции и находим мольный фактор: 43,92 г ν, моль М , г/ моль m,г 65,4 г Х,г HCl + KOH = KCl + H2O 1 1 1 36,5 56 74,5 36,5 56 74,5 43,92 M(f) HCl = 36,5 = 1,2 65,4 №39 M(f)KOH = 56 = 1,17 M(f) HCl >M(f) KOH Вычисляем массу продукта реакции: 56 г KOH ------ 74,5 г KCl 65,4 г KOH ------ X г KCl X = 87 X = m(KCl) = 87 г Вычисляем массу вступившегов реакцию вещества, взятого в избытке 56 г KOH ---- 36,5 г HCl 65,4 г KOH ---- X1 г HCl X1 = m(HCl) = 42,63 г Вычисляем массу неизрасходованного вещества m(HCl) = 43,92 – 42,63 = 1,29 г При сгорении 6 гнеизвестного органического вещества образовалось 6,72 л углекислого газа (н.у.) и 7,2 г воды.Относительная плотность паров спирта по воздуху равна 2,067. Найдите формулу неизвестного вещества. Краткая запись условия задачи: Дано: Решение: m(вещ-ва) = 6 г V(CO2) = 6,72 л m(H2O) = 7,2 г D(по воздуху) = 2,067 Найти: CxHy CxHyОz Находим массу углерода по объёму выделившегося углекислого газа: M(CO2) = 23+32 =44 22,4 л CO2 содер ----- 12 г С 6,72 л CO2 содер ----- x г С x = m(C) = 6,72•12 / 22,4 = 3,6г Находим массу водорода по массе полученной воды: M(H2O)= 2+16 = 18 18 г H2O содер ----- 2 г H 7,2 г содер ----- у г Н y = m(Н) = 7,2 •2 / 18 = 0,8г Сложив массы углерода и водорода,выясняем наличие или отсутствие третьего элемента в 1 1 1 6 баллов 1 1 1 1 исходном веществе: m(CxHy) = m(C)+ m(Н) = 3,6 г + 0,8 г = 4,4 г в исходном веществе есть третий элемент.Это кислород, т.к. в продуктах сгорания есть кислород (значит, в исходном веществе также есть кислород). Значит формула вещества CxHyОz. Масса кислорода m(O)= m(CxHyОz) – (m(C) + m(H)) = 6- 4,4 = 1,6 г Находим количества ( молей) углерода, водорода и кислорода: 3,6 0,8 1,6 ν(C) : ν(H) : ν (O) = 12 : 1 : 16 = 0,3 : 0,8 : 0,1 = 3:8:1 C3H8O По относительной плотности находим молярную массу вещества и молекулярную формулу вещества: D(возд) = M(CxHyОz)/M(возд) M(CxHyОz) = D(возд)• M(возд) = 2,067 •29 = 60 M(C3H8O) = 60 г/ моль Ответ: C3H8O 1 1 Практическое задание В шести пронумерованных пробирках находятся 0,5 M растворы хлорида железа (II), соляной кислоты,нитрата серебра, гидроксида натрия, карбоната натрия и хлорида бария. Не используя другие вещества, определите каждое из веществ в пронумерованных пробирках. Спецификация прктической работы № Прверяемый элемент задания 40 Знание цели прктической работы Правильно составленная теоретическая матрица Правильно составленная практическая матрица Правильно составленные молекулярные, полные ионные и сокращенные ионные уравнения реакций. Правильно записанный вывод и правильно определённые вещества. Всего Количество баллов за выполненную работу 1 1 1 3 6*1=6 12 Ответы практического задания Цель: На основании химических свойств веществ определить каждое из веществ в пронумерованных прбирках, не используя другие вещества. Необходимые реактивы и оборудование : 0,5 M растворы хлорида железа (II), соляной кислоты,нитрата серебра, гидроксида натрия, карбоната натрия и хлорида бария. , пробирки с растворами веществ, чистые прбирки и штатив для побирок. Теоретическая матрица FeCl2 HCl FeCl2 HCl AgNO3 NaOH Na2CO3 BaCl2 - - AgCl↓ (белый твор.) AgCl↓ Fe(OH)2↓ (зелёный) Q FeCO3 - CO2↑ - - (белый твор.) AgNO3 NaOH Na2CO3 AgCl↓ (белый твор.) Fe(OH)2↓ (зелёный) FeCO3 AgCl↓ (белый твор.) Q CO2↑ BaCl2 - AgOH↓ (чёрный) AgOH↓ (чёрный) Ag2CO3 ↓ (светложёлтые кристаллы) AgCl↓ (белый твор.) - Ag2CO3 ↓ (светло-жёлтые кристаллы) - AgCl↓ (белый твор.) - - BaCO3↓ BaCO3↓ - 1. 2AgNO3 + FeCl2 = 2AgCl↓ + Fe(NO3)2 2Ag ++ 2NO3- + Fe2+ +2Cl- = 2AgCl↓ +2NO32Ag ++ 2Cl- = 2AgCl↓ Ag ++ Cl- = AgCl↓ 2. AgNO3 + HCl = AgCl↓ +HNO3 Ag ++ NO3- + H+ + Cl- = AgCl↓+NO3- + H+ Ag ++ Cl- = AgCl↓ 3. FeCl2 +2NaOH = Fe(OH)2 ↓+ 2NaCl Fe2+ +2Cl- +2Na++2OH- = Fe(OH)2 ↓+2Cl- +2Na+ Fe2+ +2OH- = Fe(OH)2 ↓ 4. NaOH + HCl = NaCl + H2O +Q Na++ OH- + H+ + Cl- = Na++ Cl- + H2O Na++ Cl- = H2O 5. FeCl2 + Na2CO3 = FeCO3↓ + 2 NaCl Fe2+ +2Cl- + 2Na++ CO32- = FeCO3↓+2Cl- + 2Na+ Fe2+ + CO32- = FeCO3↓ 6. Na2CO3 + 2HCl = 2NaCl + CO2 ↑+ H2O 2Na++ CO32- + 2 H+ + 2Cl- = CO2 ↑+ H2O+ 2Cl- + 2Na+ CO32 + 2 H+ = CO2 ↑+ H2O 7. Na2CO3 + 2AgNO3 = Ag2CO3↓ + 2NaNO3 2Na++ CO32- +Ag ++ NO3- = Ag2CO3↓ + 2NO3- +2Na+ CO32 +Ag += Ag2CO3↓ 8. 2AgNO3 +BaCl2 = 2AgCl↓ + Ba(NO3)2 2Ag ++ 2NO3- +Ba2+ + 2Cl- = 2AgCl↓ + 2NO3- +Ba2+ 2Ag ++ 2Cl- = 2AgCl↓ 9. BaCl2+ Na2CO3 = BaCO3 ↓+ 2NaCl Ba2+ + 2Cl- + 2Na++ CO32- = BaCO3 ↓+2Cl- + 2Na+ Ba2+ + CO32- = BaCO3 ↓ Практическая матрица(учащиеся заполняют в ходе выполнения задания) №2 зелёный↓ №3 - №4 Q №5 №1 №1 - №6 чёрный↓ №2 зелёный↓ - ↓ - - белый творож↓ ↓ - газ↑ белые мелкие кристаллы↓ светло-жёлтые кристаллы↓ №3 №4 №5 Q №6 чёрный ↓ газ↑ белые мелкие кристаллы светложёлтые кристаллы↓ - белый творож↓ белый творож↓ белый творож↓ - Если практическая матрица будет именно такой , то надо сделать выводы , определить содержимое пробирок и написать уравнения реакций. 1) №1+ №2 выпал зелёный осадок №1+ №4 выделилось тепло, цвет не изменился № 1 +№ 6 выпал чёрный мелкий осадок; значит в пробирке № 1-щёлочь. 2) № 2 + № 1 выпал зелёный осадок ; № 2 + № 3 выпал осадок. Значит в пробирке № 2 - FeCl2 3) № 3 + № 4 выделился газ № 4 + № 1 выделилось тепло, значит в пробирке № 4-HCl 4) № 6 + № 2,4, 5 выпал творожистый белый осадок № 6 + № 3 выпали светло-жёлтые кристаллы , № 1 +№ 6 выпал чёрный осадок, значит, в пробирке № 6- AgNO3 5) № 5 + №3 выпали светло-жёлтые кристаллы № 5+ №6 выпал белый осадокақ,в пробирке №5 -BaCl2 6) № 3 + № 4 выделился газ, значит в пробирке №4 - HCl, а в пробирке №3- Na2CO3 В пронумерованных пробирках находятся растворы веществ № 1 NaOH №2 FeCl2 №3 Na2CO3 №4 HCl №5 BaCl2 №6 AgNO3