основные принципы расчета энергоэффективности протезов
реклама

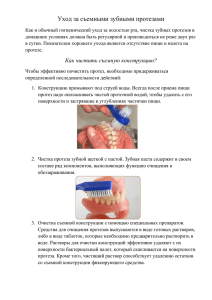
УДК 616.12-089:616-77 Р.И. ДЖАФАРОВ, А.С. БЯКИНА, М.И. ЗЕМСКОВА ОСНОВНЫЕ ПРИНЦИПЫ РАСЧЕТА ЭНЕРГОЭФФЕКТИВНОСТИ ПРОТЕЗОВ КЛАПАНОВ СЕРДЦА IN VIVO Актуальность. В патогенезе острой сердечной недостаточности в раннем и прогрессирования хронической в позднем послеоперационных периодах играет основную роль высокое гидродинамическое сопротивление клапанных протезов сердца, на преодоление которого сердцем затрачивается значительная энергия [4;5]. Причем, антеградные энергопотери, т.е. энергопотери фазы прямого тока крови через клапан, наиболее существенны в возникновении причин клапанных дисфункций, серьезных протезных осложнений, репротезирований и летальных исходов [1]. Как известно, с течением времени градиент давления на протезе, а следовательно и сопротивление току крови, растут, что связано с наростом биомассы на протезе (эндотелизация, тромбы, паннус и т.п.), нередко приводящие к его обструкции [1; 2; 3]. В связи с этим имеется интерес к прямому определению энергопотерь на протезе в зависимости от времени функционирования его в организме человека. Необходимо подчеркнуть, что общие, антеградные (прямые) и ретроградные (запорного тока и тока утечки) энергопотери учитываются при стендовых испытаниях протезов их изобретателями и фирмами изготовителями [6]. Однако по данным литературы, которой мы располагаем, в живом организме исследования подобного рода ранее не проводились. Цель: провести впервые в кардиохирургической практике сравнительную оценку абсолютных и удельных потерь энергии прямого потока крови на отечественных протезах двустворчатых МЕДИНЖ-2 (ЗАО «МЕДИНЖ», г. Пенза) и РОСКАРДИКС (ООО «РОСКАРДИОИНВЕСТ», г. Москва) типов и моностворчатого МИКС-2 (ООО «РОСКАРДИОИНВЕСТ», г. Москва) типа, имплантированных в митральную позицию, на протяжении 7 лет постимплантационного периода. Материал и методы исследования. Наблюдали 173 пациента в возрасте 46,9±0,9 лет (мужчин – 119, женщин – 54), которым произведены протезирования митрального клапана в Кардиохирургическом центре ГБУЗ Республики Мордовия «Республиканская клиническая больница № 4» г. Саранска. Причиной порока сердца у большинства была хроническая ревматическая болезнь сердца (87,9 %). Стеноз митрального клапана имел место в 12,1 %, недостаточность — в 16,2 %, их комбинация — в 74,6 % случаях. II ФК по NYHA до протезирования имели 17,9 %, III — 68,2 % и IV — 13,9 % больных. В I группе в митральную позицию супрааннулярно имплантировано 37 протезов МЕДИНЖ-2 (МИ-2), во II — 61 имплант РОСКАРДИКС (РК), в III — 75 протезов МИКС-2 (МК-2). Протезирование митрального клапана осуществляли стернотомным доступом с применением гипотермического искусственного кровообращения и фармако-холодовой кардиоплегии. До и после операции в течение последующих 7 лет эхокардиографически на аппарате экспертного класса Vivid-7 (USA) в соответствии с протоколом U. Wilkenshoff и I. Kruck [8] оперделяли среднюю скорость трансмитрального потока крови (υ mid), которую рассчитывали исходя из среднего градиента давления на митральном протезе (∆Рmid) по модифицированной формуле Бернулли, а так же площадь эффективного отверстия протеза (Sef), которую рассчитывали по времени полуспада градиента давления (РНТ) на митральном клапане [7]. На основании указанных показателей рассчитали прямые энергопотери на митральном клапане (∆Е+). В основу расчёта легла известная формула, применяемая для определения затрат энергии в гидродинамике: ∆Е+ = ∆Р * Q, где ∆Р — средний градиент давления на гидроустройстве, а Q — расход жидкости через него. При этом, исходя из модифицированной формулы Бернулли для крови, имеем: ∆Р (Н/м2) = К1* *4 υ mid 2 (м/с), а Q (м3/с) = К2* Sef (cм2) * υ mid (м/с), где υ mid — средняя линейная скорость прямого тока крови через клапан (для митрального клапана — среднелинейная скорость диастолического потока, для аортального — систолического) в м/с, Sef — площадь эффективного отверстия в см2, К1 и К2 — коэффициенты пересчёта в систему СИ. При расчёте обнаружено, что К1* К2 = 8. Исходя из вышеизложенного имеем: ∆Е+ (мДж/мин) = 24*υ mid 3 (м/с)* Sef (cм2). Учитывая тот факт, что протезы выпускаются различных размеров, были рассчитаны удельные потери энергии, т.е. потери энергии в перерасчете на единицу эффективной площади протеза. Этот показатель независимо от размера протеза показывает роль конструкции импланта в создании сопротивления прямому току крови. Таким образом, ∆Е(S) (мДж/мин*см2) =∆Е+ (мДж/мин) / Sef (см2) или ∆Е(S) (мДж/мин*см2) = 24*υ mid 3 (м/с). Полученный расчётным путем показатель удельных потерь энергии на протезе, в отличие от общепринятого показателя транспротезного градиента давления, минимально зависит от размеров протеза, состояния миокарда и характера ритма сердца, а зависит, главным образом, от двух факторов: изначально — от энергоэффективности конструкции, в дальнейшем — от энергоэффективности конструкции и степени обструкции протеза биомассой. Достоверность изменений показателей определяли по t-критерию Стьюдента и соответствующему ему показателю достоверности р(t). Различия считали достоверными при р(t)≤0,05. Результаты исследования и их обсуждение. До протезирования средняя линейная скорость трансклапанного тока (υ mid) у пациентов, которым впоследствии имплантировали МИ-2 и МК-2 была одинаково высокой — 2,11±0,13 м/с и 2,04±0,10 м/с соответственно. При этом у пациентов, которым имплантировали РК — чуть меньше (1,75±0,10 м/с). После протезирования наблюдали синфазное снижение средних линейных скоростей кровотока на протезах РК и МК-2 до 1,29±0,05 м/с и до 1,30±0,04 м/с соответственно, в то время как на МИ-2 она была достоверно ниже — 1,09±0,06 м/с (p(t)<0,05), но нормализации (ниже 0,55– 0,60 м/с) не достигла. На протезах МИ-2 до 3 лет средние линейные скорости сохранялись на более низком уровне, чем на протезах РК и МК-2, лишь в полгода наблюдали рост среднелинейной трансмитральной скорости потока на МИ-2 до 1,31±0,04 м/с, что приблизило характер потока МИ-2 к характеру потока на РК и МК-2 — 1,39±0,06 м/с и 1,32±0,04 м/с в этот период соответственно. Лишь после 3-х летнего периода среднелинейные скорости кровотока на всех протезах выравниваются, не отличаются друг от друга и находятся в пределе 1,3–1,4 м/с. Измерение РНТ в миллисекундах (мс) произведено по допплер-кривой скорости трансмитрального потока на ультразвуковом сканнере в режиме РW-допплера. До протезирования на нативных пораженных клапанах время полуспада градиента давления у больных, которым впоследствии протезировали МИ-2 и МК-2 было выше, чем у пациентов, которым протезировали РК: 193,3±12,8 мс и 191,9±9,35 мс на в первой и третьей группах соответственно, против 164,8±8,99 мс (p(t)<0,05) во второй группе. Это свидетельствует о значительной тяжести состояния пациентов, которым впоследствии имплантировали МИ-2 и МК-2, хотя критического уровня (220 мс) достигнуто ни в одной из групп не было. После имплантации обнаружено, что РНТ на протезах РК и МК-2 снизилось до 123,9±3,72 мс и 122,1±3,72 мм рт. ст. соответственно, в то время как на МИ-2 оно было значительно меньше — 102,6±5,21 мм рт. ст. (p(t)<0,01). На протезах МИ в течение 3 лет сохранялось меньшее время полуспада градиента давления, чем на протезах РК и МК-2. Так, через полгода после имплантации РНТ на МИ-2 было 108,0±15,9 мс (p(t)<0,01), в то время как на РК и МК-2 — 130,3±5,38 мс и 124,1±3,37 мс соответственно, через 1 год РНТ на МИ-2 — 111,9±6,98 мс (p(t)<0,05), в то время как на РК и МК-2 — 130,7±5,88 мс и 126,1±2,77 мс соответственно. Лишь после 3-х летнего периода средние РНТ уравниваются в группах и не отличаются друг от друга, находясь в пределе 124–129 мс в три года и 131–135 мс в пять-семь лет соответственно. Непосредственно после имплантации ∆Е(S) на интактном протезе МИ-2 был самый минимальный — 36,5±5,36 мДж/мин*см2 (p(t)<0,01), в то время как на интактных протезах РК и МК-2 — 57,8±5,05 мДж/мин*см2 и 54,4±4,90 мДж/мин*см2, что свидетельствовало о том, что конструкция протеза МИ-2 более энергоэффективна, чем конструкции РК и МК-2. При этом не обнаружено отличий по энергоэффективности конструкций РК и МК-2. К полугоду постимплантационного периода удельные потери энергии антеградного тока на протезах возросли, причем более всего на МИ-2 — до 58,0±6,16 мДж/мин*см2, сравнявшись с ∆Е(S) на протезах МК-2 и РК, однако к году ∆Е(S) МИ-2 вновь снизились до 44,7±4,8 мДж/мин*см2 (p(t)<0,01), что вновь дало достоверные отличия от ∆Е(S) МК-2 и ∆ЕА(S) РК. После 3-х лет постимплантационного периода удельные потери энергии на всех протезах достоверно не различались, но претерпевали тенденцию к дальнейшему росту. Указанные изменения связаны с минимальной фрагментацией и латерализацией потока у МК-2 и механизмом вращения створок у МИ-2, а так же с минимальной гемодинамической значимостью роста биомассы на МК-2 до полугода. К полугоду происходит рост потери энергии на всех протезах, но более значительно на МИ-2, что, вероятно, связано с потерей свойства вращения его створок к этому сроку за счет прироста биомассы на нем [1;3]. В период от полугода до трех лет наименьшие удельные потери энергии оказались именно у этого протеза, в то время как к этому сроку МК-2 и РК имели более высокие удельные потери энергии и не различались между собой по этому показателю. Примечательно, что после трех лет постимплантационного периода не выявлено преимуществ по энергоэффективности у отдельных конструкций. Это свидетельствует о низкой способности к противостоянию росту паннуса у всех современных конструкций механических протезов в сроки после трех лет. Заключение. Таким образом, протез МЕДИНЖ-2 более энергоэффективен в митральной позиции в течение трех лет послеоперационного периода, чем РОСКАРДИКС и МИКС-2. После трехлетнего срока энергоэффективность всех типов протезов уравнивается. При этом наблюдается рост энергопотерь на всех типах протезов в эти сроки за счет роста биомассы. Путь к повышению энергоэффективности искусственных клапанов сердца лежит в создании центральнопотоковых конструкций типа трехстворчатых ТРИКАРДИКС и КОРБИТ или типа двустворчатого МЕДИНЖ-ST, на которых рост биомассы может иметь меньшую гемодинамичская значимость. СПИСОК ЛИТЕРАТУРЫ 1. Орловский П.И., Гриценко В.В., Юхнев А.Д., Евдокимов С.В., Гавриленков В.И. Искусственные клапаны сердца / Под ред. академика РАМН Ю.Л. Шевченко. –С-Пб.: ЗАО «ОЛМА Медиа Групп», 2007. – 448 с. 2. Караськов А.М., Назаров В.М., Железнев С.И. и др. Дисфункции искусственных клапанов сердца / Под ред. член-корр. РАМН А.М. Караськова. – Новосибирск: Академическое издательство «Гео», 2008. – 251 с. 3. Назаров В.М. Дисфункция искусственных клапанов сердца. Автореф. дис. …доктора мед. наук. – Новосибирск, 2003. – 42 с. 4. Немченко Е.В., Степанов С.С., Новиков В.К. Десятилетний опыт использования отечественного искусственного клапана «МЕДИНЖ» при митральном протезировании // Вестник С-Петербургского университета. – 2006. – Серия 11, Вып. 2. – С. 86–95. 5. Немченко Е.В. Современная стратегия хирургической коррекции митральных пороков сердца с позиции анализа отдаленных результатов. Автореф. дис. … доктора мед. наук. – М., 2008. – 42 с. 6. Нехорошев Б.К. Кузьмина Н.Б., Моисеенков Г.В., Барбараш Л.С. Влияние протезов митрального клапана на структуру потока жидкости в полости левого желудочка сердца // Грудная и сердечно-сосудистая хирургия. – 1988. – № 3. – С. 38. 7. Baldwin J.T., Campbell A., Luck C. Fluid dynamic of Carbomedics kinetic bileaflet prosthetic heart valve // Eur. J. Cardiothorac. Surg. – 1997. – Vol. 11. – Р. 287–292. 8. Wilkenshoff U., Kruck I. Handbuch der Echokardiographie. – Berlin: Blackwell Verlag: GmbH, 2007. – 240 p. АВТОРСКАЯ СПРАВКА 1. Джафаров Руслан Идрисович — очный аспирант кафедры госпитальной хирургии ФГБОУ ВПО «МГУ им. Н.П. Огарева», 2. Бякина Анастасия Сергеевна — студентка 6-го курса медицинского института ФГБОУ ВПО «МГУ им. Н.П. Огарева», 3. Земскова Мария Игоревна — студентка 6-го курса медицинского института ФГБОУ ВПО «МГУ им. Н.П. Огарева», [email protected], тел.: +79510517905. Научный руководитель — профессор кафедры госпитальной хирургии ФГБОУ ВПО «МГУ им. Н.П. Огарева» доктор медицинских наук профессор С.П. Бякин, [email protected], тел.: +79050095117.