Тема урока: Хлор, строение атома
реклама

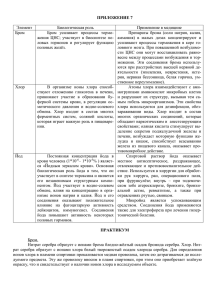
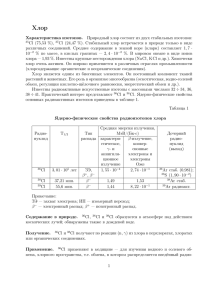
Тема урока: Хлор, строение атома. Физические и химические свойства хлора. Цели урока: Дать представление о составе и строении хлора, выяснить причину невозможности существования хлора в свободном виде. На основе положения хлора в Периодической системе химических элементов рассмотреть физические и химические свойства хлора, развивая у школьников логическое мышление и прогнозирующие качества, умения выдвигать гипотезу, положительной и отрицательной роли этого газа, соединениях хлора и их значении. Развивать умения работы с дополнительной литературой, отбирать необходимый материал, составлять сценарий урока. Формировать умения работы в коллективе. Развивать актерские способности. Оборудование и реактивы: Цинк, оксид меди (II), гидроксид меди (II), нитрат серебра, соляная кислота, хлороводород, яичная скорлупа, индикаторы. Плакаты, освещающие применение хлора и его соединений, костюмы для участников судебного процесса. Компьютер, мультимедийный проектор, компьютерные презентации по применению хлора. Тип урока: Ролевая игра – суд. Участники судебного заседания: судья, секретарь суда, подсудимый хлор, адвокат, прокурор, представитель химической лаборатории, эксперты – эколог, биолог, химик, химик-технолог, судмедэксперт, два свидетеля, два журналиста. Время проведения: 1 час ХОД УРОКА Секретарь суда: Встать! Суд идее! Прошу всех сесть, прошу доложить явку ответчиков, истцов, пострадавших, свидетелей, экспертов. Секретарь суда: Присутствуют все, начинаем судебное заседание. Слово судье. (Называет ФИО ученика, исполняющего роль судьи). Судья: Сегодня в этом зале вершится суд над хлором – газом зеленоватожёлтого цвета с очень резким запахом. Вдыхание его даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистой оболочки. Более значительное количество хлора может вызвать тяжёлое отравление и даже смерть. Хлор хорошо растворяется в воде, взаимодействует с металлами: 2Na + Cl2 = 2NaCl с водородом: H2 + Cl2 = 2HCl с водой H2O + Cl2 = HCO + HCl со щелочью: 2NaOH + Cl2 = NaCl + NaClO + H2O Хлор обвиняется в нанесении вреда всем живым существам – от едва различимых под микроскопом бактерий до крупных животных и человека. Вступает с соединение почти со всеми химическими элементами, в том числе со многими металлами, убивает их. Не даёт возможности существовать в свободном виде, наносит вред окружающей среде. Суду необходимо: - определить состав преступления, выслушав прокурора; - подтвердить преступную деятельность показаниями свидетелей; - выслушать показания обвиняемого хлора; - познакомиться с показаниями защитников обвиняемого; - принять справедливое решение. Слово по составу преступления предоставляется прокурору. Прокурор: Гражданин хлор и его производные действительно загрязняют атмосферу и делают её неблагоприятной для жизни человека и животных. Гражданин хлор виновен в массовом убийстве людей на войне и в мирное время. Хлор агрессивен, нападает на вещества, и они перестают существовать в свободном виде. Всё это означает, что нужно судить гражданина хлора по всей строгости закона и изолировать его от общества. Судья: Суд выслушал обвинение, выдвинутое в адрес гражданина хлора и приступает к слушанию свидетельских показаний. Приглашается первый свидетель. Первый свидетель: В первую мировую войну хлор нашёл неожиданное применение как оружие массового уничтожения. Послушаем отрывок из романа М. Шолохова «Тихий Дон», где описывается зелёно-жёлтый газ, который стал убийцей многих тысяч людей: «На рассвете 3 октября немцы, употребив удушливый газ, отравили три батальона 256-го полка и заняли первую линию … Валет, клацнув зубами, отпрыгнул, и на то место, где секунду назад стояли его ноги, спиленным деревом упал стоящий под сосной человек. Они перевернули его лицом вверх и тут только догадались, что под сосной нашёл себе последний приют этот отравленный газами, бежавший от смерти, которую нёс в своих лёгких, солдат одного из трёх батальонов 256-го полка. Рослый широкоплечий парень, он лежал, вольно откинув голову, с лицом, измазанным при падении клейкой грязью, изъеденным газом, разжиженными глазами, из стиснутых зубов его черным глянцевидным бруском торчал пухлый мясистый язык. - Пойдём. Пойдём, ради бога! Пусть он себе лежит, - шепнул товарищ, дёргая Валета за руку. Они пошли и сейчас же наткнулись на второй труп. Мёртвые стали попадаться чаще. В нескольких местах отравленные лежали копешками, иные застыли сидя на корточках, некоторые стояли на четвереньках - будто паслись, а один, у самого хода сообщения, ведущую во вторую линию окопов, лежал, скрючившись калачиком, засунув в рот искусанную от боли руку». Судья: Слово по этому факту предоставляется судмедэксперту. Судмедэксперт: Действительно, хлор очень токсичен. Он раздражает слизистые оболочки глаз и дыхательных путей. Острое отравление развивается почти немедленно. При выдыхании хлора отмечаются стеснение и боль в груди, сухой кашель, учащенное дыхание, резь в глазах, слёзотечение, повышение содержания лейкоцитов в крови и температуры тела. Возможны бронхопневмония, токсический отёк лёгких, депрессивное состояние, судороги. В лёгких случаях отравления выздоровление наступает через 3 – 7 суток. Судья: Спасибо, слово предоставляется следующему свидетелю. 1. Второй свидетель: Вскоре после хлора был применён другой удушливый газ – фосген. Это соединение хлора с оксидом углерода (II) CO + Cl2 = COCl2 В 1917 году массовое применение нашел иприт, который тоже содержал в себе хлор. К концу войны применялось более 50- ти различных отравляющих веществ (ОВ), 95 % которых – производные хлора. Чтобы судить об эффективности ОВ на полях войны, достаточно указать, что в одной только английской армии, занимавшей среди воюющих государств пятое место по своей численности, с июля 1917 года по ноябрь 1918 года ОВ вывели из строя более 160 тысяч человек. Английский поэт Уилфред Оуэн, погибший в сражениях Первой мировой войны, оставил такие строки: Газ! Газ! Скорей! – неловкие движенья, Напяливание масок в едкой мгле! Один замешкался, давясь и спотыкаясь, Барахтаясь, как в огненной смоле, В просветах мутного зеленого тумана. Бессильный как во сне, вмешаться и помочь, Я видел только – вот он зашатался, Рванулся и поник – бороться уж невмочь. Судья: Спасибо, теперь всё понятно. Но хлор имеет сообщников, он нашёл их в среде неметаллов. Например, водород на свету активно взаимодействует с хлором, да ещё со взрывом. Второй свидетель: Уважаемые судьи! Я и сам не понимаю, как у такого почтенного родителя, как водород, мог родиться этот бесцветный газ с резким запахом. При вдыхании раздражает дыхательные пути и вызывает удушье. Он в 1,3 раза тяжелее воздуха, очень быстро растворяется в воде, в одном объёме воды растворяется 500 объёмов хлороводорода. Раствор называется соляной или хлороводородной кислотой. Судья: Спасибо, для дачи показаний приглашается представитель химической лаборатории. Представитель химической лаборатории: Соляная кислота – бесцветная жидкость. Концентрированная кислота содержит до 37 % хлороводорода и на воздухе «дымит». Будучи сильной кислотой, она обладает всеми свойствами кислот. Многие металлы, основные оксиды, основания, некоторые соли и газы взаимодействуют с соляной кислотой (лабораторные опыты, выполняют сами учащиеся): Zn + 2HCl = ZnCl2 + H2 CuO + 2HCl = CuCl2 + H2O Cu(OH)2 + 2HCl = CuCl2 + 2H2O AgNO3 + HCl = AgCl + HNO3 NH3 + HCl = NH4Cl А нитрат серебра от соляной кислоты без ума, при её появлении у него мутнеет рассудок. Судья: Спасибо. В зал суда приглашается для дачи показаний эколог. Что вы можете сказать об участии хлороводорода и соляной кислоты в образовании кислотных дождей? Эколог: Впервые кислотные дожди были отмечены в Скандинавии. Потом появились на северо-востоке США. Сейчас проблема, связанная с кислотными дождями. Существует во всём индустриальном мире. Рыба исчезла из многих озёр. Поверхность каменных и бетонных домов, мраморных статуй разъедена. Сельскохозяйственные культуры замедлили темп роста, леса умирают. Новая Зеландия и Скандинавия – наиболее пострадавшие от кислотных дождей, но последние в настоящее время распространились по всему миру. Судья: По вопросу кислотных дождей прошу пригласить эксперта-химика. Химик: Я могу показать, как кислотные дожди влияют на скорлупу яйца. (Демонстрирует опыт: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑) Вы видите, что скорлупа яйца растворяется. Аналогично кислотные дожди действуют и на мраморные статуи. Судья: Итак, заслушав показания свидетелей и экспертов, переходим к судебным прениям. Слово предоставляется защите. Адвокат: Уважаемый суд! Из показаний свидетелей и экспертов ясно, что у хлора наряду с недостатками существуют и достоинства. Впервые хлор был использован в медицине. Раствор хлора в воде – хлорная известь рекомендовался как дезинфицирующее средство врачам и студентаммедикам при работе в моргах. С помощью соединений, содержащих хлор, отбеливают хлопчатобумажные, льняные ткани и целлюлозу, соответственно в текстильной и бумажной отраслях промышленности. Ведь до появления этих соединений в некоторых европейских, особенно северных, странах весенней порой поля и луга устилали льняными тканями, которые под действием солнечных лучей и других природных факторов приобретали необходимую белизну, Для лугового отбеливания ткани из Англии отправляли даже в Голландию, а купцы из французского города Бордо вывозили ткани на африканское побережье. За последние десятилетия широкое распространение получило хлорирование воды – обеззараживание. Введение в водопроводную воду газообразного хлора в количествах, безопасных для человеческого организма, приводит к уничтожению в воде болезнетворных микробов, устранению неприятных привкусов и запахов. В цветной металлургии хлорированием руд извлекают из них некоторые металлы (титан, ниобий, тантал). В химии высокомолекулярных соединений хлор используется для получения пластмасс, синтетических волокон, каучука, соляной кислоты и т.д. В сельском хозяйстве используются соединения хлора для борьбы с сорняками и такими вредителями растений как саранча, проволочный червь. Саранча ежегодно наносит огромный ущерб сельскому хозяйству, уничтожая целые поля пшеницы и других злаковых и овощных культур. Хлор действительно токсичен, за ним нужен глаз да глаз. Единственное, что он требует – это соблюдение техники безопасности. Защита просит пригласить для дачи показаний биолога. Судья: Слово биологу. Биолог: Хлор – один из биогенных элементов, постоянный компонент тканей растений и животных. Суточная потребность взрослого человека в хлоре 2 – 4 г и покрывается за счет пищевых продуктов. С пищей хлор поступает в организм в виде хлорида натрия и хлорида калия. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме хлор играет большую роль в водно-солевом обмене, способствует удержанию тканями воды. Судья: Спасибо. Слово предоставляется защите. Защитник: Я хочу сказать, что активность хлора «убила» его самого. В природе в свободном состоянии он не встречается. Если в редких случаях и происходит его выделение (например, при извержении подводных морских вулканов), то в очень небольших количествах, и хлор тотчас же исчезает, взаимодействуя с окружающими веществами. Хлор входит в состав поваренной соли – вещества, необходимого для организмов животных и человека. В организме человека содержится около 200 г соли. Важное значение соли и в организмах наземных животных. Близкие значения соотношения между солью и другими соединениями хлора, находящимися в крови наземных животных и морской воде дают ученым возможность говорить о происхождении наземных животных из морских организмов. Прошу дать слово эксперту-биологу Судья: Разрешаю. Эксперт-биолог: Соль участвует в важнейших физиологических процессах организма человека и животных. Она содержится в слюне, желудочном соке, желчи и лимфе. Наличие хлорида натрия в крови обеспечивает осмотическое давление, от которого зависит нормальная жизнедеятельность клеток. Почти все нужные нашему организму минеральные соли содержатся в обычной пище. Только хлорида натрия в ней не хватает. Для поддержания жизни человек должен ежедневно получать 20 – 25 г соли. Каждый человек потребляет в год 6 – 8 кг соли. Адвокат: Для защиты прошу предоставить слово эксперту химикутехнологу. Судья: Слово предоставляется химику-технологу. Химик-технолог: Ныне мировая добыча поваренной соли составляет 100 млн. тонн в год. На пищевые нужды расходуется всего лишь около четвертой ее части. Куда же идет остальная часть? Поваренная соль необходима при производстве мясных и рыбных консервов, в металлургической отрасли, при обработке сыромятных кож, при варке мыла, в медицине. Но главный потребитель поваренной соли – химическая отрасль промышленности. И трудно сказать, каким отраслям народного хозяйства она ещё не понадобится. Но и сейчас в движении атомных подводных лодок, в полетах космических кораблей. В создании огромного количества окружающих нас минералов участвует хлорид натрия – «соль земли» Судья: А теперь последнее слово предоставляется подсудимому. Подсудимый: Уважаемый суд! Я обращаюсь к вам со своим последним словом. Учтите, пожалуйста, что в свободном виде в природе я встречаюсь только в экстремальных ситуациях. Человек сам получает хлор и по своему усмотрению им распоряжается, нарушая технологию и используя его против человечества. Я себя виновным не считаю. Судья: Итак, мы заслушали свидетелей, экспертов, защитников и подсудимого. Приступаем к прениям. Прокурор, предоставляю слово вам. Прокурор: Учитывая в совокупности все показания свидетелей, экспертов и защитников, я отказываюсь от поддержания обвинения в суде. Судья: Суд удаляется для вынесения приговора. Секретарь суда: Встать! Суд удаляется для вынесения приговора. Секретарь суда: Внимание! В зале заседаний суда работают журналисты радио и телевидения. Они хотят побеседовать с вами – участниками данного судебного заседания. Журналисты начинают работу, направленную на закрепление сведений, полученных на уроке, задают вопросы и заслушивают ответы. Журналисты: 1. Какое впечатление произвел на вас подсудимый? Какие черты личности вам особенно запомнились? 2. Кто за то, чтобы его осудили? Поднимите, пожалуйста, руки. Почему вы за осуждение хлора? 3. Назовите, пожалуйста, факты, свидетельствующие в пользу хлора. 4. Как вы в целом оцениваете всё происходящее в этом зале? (Вопрос гостям, присутствующим на уроке) 5. У кого есть чувство жалости и сострадания к подсудимому? Почему вы ему сочувствуете? 6. Как вы оцениваете других участников этого судебного процесса – судьи, прокурора, адвоката, свидетелей, защитников? Как они справились со своими ролями? 7. Хотите ли вы сами участвовать в подобном действии в дальнейшем? Секретарь суда: Встать! Суд идет. Судья: Прошу всех сесть. Заслушав и обсудив показания свидетелей, обвиняемого, экспертов, защитников, суд сделал следующие выводы: - Благодаря хлору существует огромное многообразие химических веществ, имеющих большое практическое значение; - Хлор обеззараживает воду, спасает людей от инфекции и сохраняет им здоровье; - Суд считает необходимым оправдать хлор, так как в природе в свободном виде он не встречается; - Суд осуждает человека за то, что он производит вещества, убивающие людей, нарушает технологии, не заботится в полной мере об окружающей среде. На этом заседание суда закрыто. Московская область Серпуховский район МОУ «Туровская основная общеобразовательная школа» Суд над хлором Урок в 8 классе по теме «Хлор, физические и химические свойства» Учитель химии Бульбас Нина Александровна с. Турово