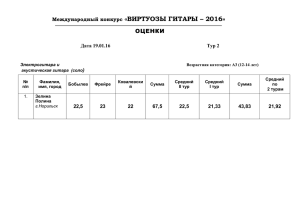
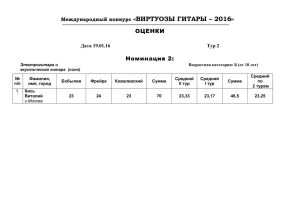
Брянский государственный университет имени академика И.Г.Петровского
реклама

Брянский государственный университет имени академика И.Г.Петровского Четвертая Брянская корпоративная региональная олимпиада учащейся молодежи ХИМИЯ Заочный тур 2012 г. Особенности проведения корпоративной олимпиады по химии 1. Олимпиада проводится в два тура. 2. Первый тур проходит в форме заочного письменного задания. 3. В каждом классе учащимся для решения предлагается по восемь заданий, из которых одно представляет собой домашний эксперимент, который необходимо выполнить, описать наблюдаемые явления и предложить им объяснение. 4. Общая сумма баллов: «40» – в 8 классе, «42» – в 9 классе, «44» – в 10 классе, «42» – в 11 классе. 5. Ответы на задания предоставляются в печатном или письменном виде (почерк четкий и понятный). 6. Второй тур проводится на базе Брянского государственного университета. 7. Ко второму туру допускаются до 15 участников первого тура, превысивших квалификационный минимум (не менее 50 % от общего числа баллов) и набравших наибольшее количество баллов. 8. Второй тур проводится в один этап. 9. Абитуриенты выполняют пять заданий со свободным ответом. Общая сумма баллов – 30. 10. На выполнение работы участникам отводится 150 минут. 11. Выявляются лучшие участники в ряде номинаций. 12. Победителями и призерами олимпиады считаются участники, набравшие наибольшее суммарное количество баллов и награждаются дипломами 1, 2 и 3 степени. Количество победителей не может превышать 45 % от количества участников второго тура. Брянский государственный университет имени академика И.Г.Петровского Четвертая Брянская корпоративная региональная олимпиада учащейся молодежи ХИМИЯ Заочный тур. 2012 г. 8 класс 8-1. ...Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте... (М. В. Ломоносов «Рассуждение о твердости и жидкости тел» 1760 г.) Юный химик взял навеску вещества, прокалил в пробирке на пламени спиртовки. Вещество изменило окраску. После охлаждения полученного продукта реакции, его масса оказалась больше массы исходного вещества. Тогда юный химик взял навеску другого вещества, прокалил его в пробирке на пламени спиртовки. Вещество изменило окраску, а его масса после охлаждения уменьшилась. «Закон сохранения массы веществ в химических реакциях неверен» - сделал опрометчивый вывод юный химик. а. Какие вещества мог взять юный химик для своих экспериментов? б. Почему наблюдалось в одном случае увеличение, а в другом уменьшение массы продукта в ходе прокаливания? в. Как следовало провести опыты, чтобы подтвердить истинность закона сохранения массы веществ? (6 баллов) 8-2 О том, что молекулы некоторых простых веществ двухатомны, вам известно со слов учителя или из учебника химии. В истории химии установить этот факт смог в начале XIX века итальянский физик Амедео Авогадро. Авогадро были известны соотношения объёмов газов в некоторых реакциях, например: 2 объёма водорода реагируют с 1 объёмом кислорода с образованием 2 объёмов воды. 3 объёма водорода реагируют с 1 объёмом азота с образованием 2 объёмов аммиака. Опираясь на эти данные и открытый им закон, он смог доказать двухатомность молекул кислорода, водорода, азота. а. Сформулируйте закон Авогадро. б. Объясните, как Авогадро доказал двухатомность данных молекул. в. Перечислите все простые вещества, молекулы которых двухатомны при нормальных условиях. (8 баллов) 8-3 У Вас на кухне имеется уксусная эссенция (раствор с массовой долей уксусной кислоты 70 % и плотностью 1,0733 г/мл). Какой объём этого раствора необходимо взять, чтобы приготовить 500 мл раствора с массовой долей уксусной кислоты 3 % и плотностью 1,0037 г/мл? (4 балла) 8-4 Массовая доля серебра в минерале аргентите 48%. Каково содержание сульфида серебра (I) в этом минерале и какова массовая доля пустой породы? (4 балла) 8-5 Для чего современные оружейные заводы широко используют свинец, почему же тогда в древности люди не применяли свинец для изготовления оружия. (3 балла) 8-6 Как правило, сплавы более тугоплавки, чем металл, а есть ли сплавы более легкоплавкие, чем металлы, из которых они состоят? Где это используется? (4 балла) 8-7 Журнал "Химия и жизнь" неоднократно знакомил читателей со способами получения кристаллического йода, в том числе из йодной настойки. Один из них, предложенный учеником 9 класса школы №177 города Киева, оказался особенно интересен для юных химиков, так как не требовал для своего исполнения дорогих реактивов. Для получения йода достаточно было иметь спиртовую настойку йода и воду. Предложите методику получения йода, имея в своём распоряжении воду и спиртовую настойку йода, которая продаётся в аптеках. Опробуйте её экспериментально, опишите наблюдаемые явления. Объясните, на чём основан этот способ получения йода. (5 баллов) 8-8 8 г оксида меди (II) некоторое время восстанавливали в токе водорода. Полученный твёрдый остаток обработали раствором серной кислоты. Масса полученной соли составила 8 г. Вычислите массу не растворившегося в кислоте вещества. (6 баллов)