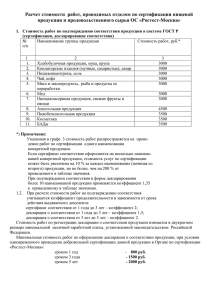
1) Кто может принимать декларацию о соответствии лекарственных средств?
реклама

1) Кто может принимать декларацию о соответствии лекарственных средств? Декларацию о соответствии лекарственного средства вправе принимать зарегистрированные в соответствии с законодательством Российской Федерации на ее территории юридическое лицо или физическое лицо в качестве индивидуального предпринимателя, являющееся изготовителем (продавцом) или выполняющее функции иностранного изготовителя на основании договора с ним в части обеспечения соответствия поставляемой продукции установленным требованиям и в части ответственности за несоответствие поставляемой продукции установленным требованиям (далее - декларант). 2) Что является основанием для принятия декларации о соответствии лекарственных средств? Декларация о соответствии лекарственного средства принимается декларантом на основании собственных доказательств и доказательств, полученных с участием третьей стороны. В качестве доказательств, полученных с участием третьей стороны, принимаются: протоколы испытаний, проведенных в аккредитованной испытательной лаборатории (центре), имеющей в области аккредитации испытания лекарственных средств, кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции) ИЛИ сертификаты соответствия на производство или систему качества Системы сертификации ГОСТ Р. 1 3) Как проводится декларирование? Принятая декларантом декларация о соответствии регистрируется органом по сертификации (см. ссылку на предыдущей странице), в область аккредитации которого включены лекарственные средства, идентифицируемые кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). Принятая декларация о соответствии считается зарегистрированной с даты ее внесения в реестр зарегистрированных деклараций органа по сертификации и имеет юридическую силу на всей территории Российской Федерации. Обращение лекарственного средства на фармацевтическом рынке Российской Федерации осуществляется только после регистрации декларации о соответствии лекарственного средства на требования нормативным документам (общим фармакопейным статьям, фармакопейным статьям, фармакопейным статьям предприятий, нормативным документам на лекарственные средства зарубежного производства). При декларировании соответствия лекарственных средств подтверждается их соответствие требованиям нормативным документам (общим фармакопейным статьям, фармакопейным статьям, фармакопейным статьям предприятий, нормативным документам на лекарственные средства зарубежного производства). Декларация о соответствии лекарственных средств может быть принята на конкретную серию (партию) лекарственного средства. Изготовитель (продавец) лекарственных средств принимает декларацию о соответствии в отношении серии (партии) лекарственного средства на основании собственных доказательств соответствия и протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), имеющей область аккредитации, идентифицируемую кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). В качестве собственных доказательств соответствия используются в совокупности: паспорт (протокол анализа) производителя (для отечественных лекарственных средств) или сертификат качества (анализа) фирмы (для зарубежных лекарственных средств); - документ, подтверждающий происхождение лекарственного средства; протоколы входного контроля (испытаний) и сертификаты на сырье, полупродукты, субстанции и материалы, используемые в производстве лекарственного средства; В качестве доказательств соответствия лекарственного средства, полученных с участием аккредитованной испытательной лаборатории (центра), используются протоколы испытаний, проведенных по всем показателям качества, установленным в нормативной документации на данное лекарственное средство. 2 В качестве доказательств соответствия лекарственного средства, полученных с участием органа по сертификации, используются сертификаты соответствия на производство или систему качества Системы сертификации ГОСТ Р, или в системе, признанной в установленном порядке в Системе сертификации ГОСТ Р, другие документы, прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Срок действия декларации о соответствии устанавливается декларантом. При этом срок действия декларации о соответствии серии (партии) лекарственного средства не должен превышать срока его годности. Декларацию о соответствии оформляют на листах формата А4 машинописным способом. Декларация о соответствии подписывается руководителем организации – изготовителя (продавца) уполномоченным им лицом или индивидуальным предпринимателем. Принятая декларация о соответствии с комплектом документов, содержащим доказательственные материалы, предоставляется для регистрации в орган по сертификации, аккредитованный в установленном порядке, в область аккредитации которого включены лекарственные средства, идентифицируемые по кодам подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). В случае выявления Федеральной службы по надзору в сфере здравоохранения и социального развития случаев несоответствия лекарственного средства, на которое принята и зарегистрирована декларация о соответствии, установленным требованиям, декларант уведомляет о прекращении действия декларации в 3дневный срок орган по сертификации, проводивший регистрацию данной декларации. Повторное принятие декларации о соответствии на данное лекарственное средство возможно только после устранения выявленных органом государственного надзора несоответствий и уведомления об этом органа государственного надзора и органа по сертификации. Повторная регистрация декларации о соответствии в этом случае осуществляется тем же органом по сертификации, который проводил первичную регистрацию декларации о соответствии. 3 4) Форма декларации о соответствии ДЕКЛАРАЦИЯ О СООТВЕТСТВИИ ________________________________________________________________________ наименование организации или фамилия, имя, отчество индивидуального предпринимателя, принявшего декларацию о соответствии ________________________________________________________________________ сведения о регистрации организации или индивидуального предпринимателя (наименование регистрирующего органа, дата регистрации, регистрационный номер) ________________________________________________________________________ адрес, телефон, факс в лице _______________________________________________________________________ должность, фамилия, имя, отчество руководителя организации, от имени которой принимается декларация заявляет, что _______________________________________________________________________ наименование продукции (лекарственного средства), на которую распространяется декларация, код ОК 005-93 и (или) ТН ВЭД , сведения о серийном (постоянном) выпуске или партии (серии - номер серии, дата выпуска серии, реквизиты договора /контракта/, накладная, наименование изготовителя, страны и т.п.) __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ соответствует требованиям __________________________________________________________________________ обозначение нормативных документов, соответствие которым подтверждено данной декларацией, содержащих требования для данной продукции __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ 4 Декларация принята на основании __________________________________________________________________ информация о документах, являющихся основанием для принятия декларации __________________________________________________________________ Дата принятия декларации _______________ Декларация о соответствии действительна до М.П. ________________ подпись ___________________ инициалы, фамилия Сведения о регистрации декларации о соответствии _________________________________________________________________ наименование и адрес органа по сертификации, зарегистрировавшего декларацию _________________________________________________________________ _________________________________________________________________ дата регистрации и регистрационный номер декларации М.П. ____________________________________________________________ подпись, инициалы, фамилия руководителя органа по сертификации 5 5) Как правильно заполнить декларацию о соответствии? ДЕКЛАРАЦИЯ О СООТВЕТСТВИИ (1)________________________________________________________________________ наименование организации или фамилия, имя, отчество индивидуального предпринимателя, принявшего декларацию о соответствии (2)________________________________________________________________________ сведения о регистрации организации или индивидуального предпринимателя (наименование регистрирующего органа, дата регистрации, регистрационный номер) (3)________________________________________________________________________ адрес, телефон, факс (4) в лице _______________________________________________________________________ должность, фамилия, имя, отчество руководителя организации, от имени которой принимается декларация заявляет, что (5) _______________________________________________________________________ наименование продукции (лекарственного средства), на которую распространяется декларация, код ОК 005-93 и (или) ТН ВЭД , сведения о серийном (постоянном) выпуске или партии (серии - номер серии, дата выпуска серии, реквизиты договора /контракта/, накладная, наименование изготовителя, страны и т.п.) __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ (6) соответствует требованиям __________________________________________________________________________ обозначение нормативных документов, соответствие которым подтверждено данной декларацией, содержащих требования для данной продукции __________________________________________________________________________ __________________________________________________________________________ (7) Декларация принята на основании __________________________________________________________________ информация о документах, являющихся основанием для принятия декларации __________________________________________________________________ (8) Дата принятия декларации _______________ (9) Декларация о соответствии действительна до М.П. ________________ подпись ___________________ инициалы, фамилия 6 (продолжение формы декларации о соответствии) Сведения о регистрации декларации о соответствии (10) _________________________________________________________________ наименование и адрес органа по сертификации, зарегистрировавшего декларацию _________________________________________________________________ _________________________________________________________________ дата регистрации и регистрационный номер декларации (11) М.П. ____________________________________________________________ подпись, инициалы, фамилия руководителя органа по сертификации Правила заполнения декларации о соответствии лекарственного средства Позиция 1. Приводится наименование организации (полное и сокращенное) или фамилия, имя, отчество индивидуального предпринимателя, принявшего декларацию о соответствии. Позиция 2. Запись начинается словами «зарегистрирован» или «зарегистрирована», далее указывается наименование органа, зарегистрировавшего организацию в качестве юридического лица или гражданина в качестве индивидуального предпринимателя, приводится дата регистрации и регистрационный номер. Позиция 3. Приводится юридический адрес, телефон, факс (при наличии) организации или индивидуального предпринимателя. При необходимости приводят дополнительно адрес, телефон, факс фактического местонахождения и адреса производства в соответствии с лицензией на право производства декларируемого лекарственного средства. Позиция 4. Заполняется только для организации. Указывается руководитель организации или лицо, назначенное приказом по организации для принятия декларации. Позиция 5. Указываются наименование лекарственного средства, и документ, по которому продукция выпускается (промышленный технологический регламент). Далее указывают: «серия» и «партия» (количество). Контракт для импортера или накладная для продавца. Далее указывается код продукции (6 разрядов с пробелом после первых двух) по Общероссийскому классификатору продукции ОК 005-93 (ОКП) или 10-разрядный код продукции по классификатору товарной номенклатуры внешней экономической деятельности (ТН ВЭД России для импортируемой продукции). Позиция 6. Обозначение нормативных документов, на требования которых проведено подтверждение соответствия данной продукции. Если декларацией 7 подтверждено соответствие всем требованиям нормативного документа, то разделы (пункты) не указываются. Позиция 7. Документы, на основании которых принята декларация о соответствии, например: - документ о государственной регистрации лекарственного средства; - протокол испытаний, проведенных в аккредитованной испытательной лаборатории (центре), с указанием номера и даты выдачи, наименования организации и регистрационного номера аккредитованной испытательной лаборатории при принятии декларации на партию (серию); - сертификат соответствия на систему качества (производство) с указанием номера и даты выдачи, наименования организации и регистрационного номера аккредитованного органа по сертификации при принятии декларации на серийно (постоянно) выпускаемое лекарственное средство; - протоколы входного контроля (испытаний) на сырье, материалы; - другие документы, прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Если декларацию о соответствии принимает поставщик (продавец), то он может привести в декларации о соответствии, кроме документов, предусмотренных для данной продукции соответствующими федеральными законами, другие указанные выше документы, полученные от изготовителя или протоколы испытаний, проведенных им или по его поручению, сертификаты на систему качества продавца, декларации о соответствии или сертификаты, полученные от изготовителя, сведения о маркировании зарубежными знаками соответствия. Позиция 8. Приводится дата принятия декларации о соответствии (дата подписания). Позиция 9. Приводится предельный срок действия декларации о соответствии, установленный производителем (поставщиком, продавцом), принявшим декларацию о соответствии, на основании сведений о сроке годности лекарственного средства, сроках действия регистрационного удостоверения и нормативной документации. Позиция 10, 11. Заполняется органом по сертификации. Приводятся регистрационный номер органа по сертификации – по Государственному реестру, его наименование – в соответствии с аттестатом аккредитации, адрес. Далее приводится дата и регистрационный номер зарегистрированной в реестре декларации о соответствии, подпись, инициалы, фамилия руководителя органа по сертификации. Ставится печать органа по сертификации или организации, аккредитованной в качестве органа по сертификации (если системой сертификации не предусмотрена печать органа по сертификации). 8 6) Как проводится регистрация декларации о соответствии? Декларация о соответствии лекарственного средства с необходимыми документами направляется на регистрацию только в один орган по сертификации по выбору декларанта из числа органов, в области аккредитации которых включены лекарственные средства, идентифицируемые кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). Регистрация декларации о соответствии лекарственного средства осуществляется на основании заявления декларанта на проведение регистрации декларации. Форма заявления на регистрацию декларации о соответствии ___________________________ наименование органа по сертификации ___________________________________ адрес ЗАЯВЛЕНИЕ на проведение регистрации декларации о соответствии лекарственного средства _________________________________________________________________ наименование организации-изготовителя, продавца _______________________________________________________________________________________ или индивидуального предпринимателя Юридический адрес_________________________________________ _________________________________________________________________ Банковские реквизиты______________________________________________ _________________________________________________________________ Телефон ____________________Факс _________________ Телекс_________ просит провести регистрацию декларации о соответствии лекарственного средства ________________________________________________________ наименование _______________________________________________________________________________________ серийный (постоянный) выпуск, или партия (серия) определенного объема Оплата работ по регистрации гарантируется. Заявление на регистрацию данной декларации о соответствии в другие органы по сертификации не подавалось. Приложения: 1. Декларация о соответствии. 2. Копии документов, предусмотренных для данной продукции соответствующими федеральными законами, и выданные уполномоченными на то органами и организациями в 1 экз. _______________________________________________________________ наименование документов 3. Другие копии документов, подтверждающих соответствие продукции установленным требованиям и (или) правомочность принятия декларации о соответствии _______________________________________________________________ 9 наименование документов Руководитель организации _________________ _______________ подпись инициалы, фамилия Главный бухгалтер _________________ подпись ______________ М.П. _______________________ инициалы, фамилия Дата Регистрация декларации о соответствии лекарственного средства осуществляется путем присвоения декларации регистрационного номера, содержащего идентификационное обозначение (код) органа по сертификации и порядковый номер декларации по реестру, который ведет орган по сертификации. В реестр зарегистрированных деклараций о соответствии вносятся наименование организации или фамилия, инициалы индивидуального предпринимателя, принявших декларацию о соответствии, адрес, регистрационный номер декларации, наименование лекарственного средства (с указанием реквизитов серии и ее объема в случае регистрации декларации на серию лекарственного средства), срок действия декларации о соответствии. При регистрации орган по сертификации вносит в соответствующие реквизиты (строки) декларации о соответствии сведения об органе, проводившем регистрацию (наименование и адрес органа по сертификации), дату регистрации, регистрационный номер. В декларацию вносится подпись руководителя и ставится печать органа по сертификации. 10 7) Какие документы представляются для регистрации декларации о соответствии? Для регистрации декларации о соответствии серии (партии) лекарственного средства в орган по сертификации представляются: копия документа, подтверждающего факт внесения сведений о создании или реорганизации юридического лица в Единый государственный реестр юридических лиц или сведений о приобретении физическим лицом статуса индивидуального предпринимателя в Единый государственный реестр индивидуальных предпринимателей; копия документа о государственной регистрации лекарственного средства; копия лицензии на производство (фармацевтическую деятельность) лекарственных средств, заверенная нотариально; копия контракта (договора) на поставку (для продавца); копия документа, выданного компетентным органом в стране происхождения продукции, о соответствии условий производства лекарственных средств, требованиям GMP, заверенная нотариально и имеющая апостилированный перевод (для зарубежных производителей лекарственных средств); документ, подтверждающий право юридического или физического лица, зарегистрированных в соответствии с законодательством Российской Федерации на ее территории, выполнять функции иностранного изготовителя (договор с этим изготовителем в части обеспечения поставляемой продукции установленным требованиям и в части ответственности за несоответствие поставляемой продукции установленным требованиям, либо доверенность, нотариально заверенная изготовителем в стране происхождения продукции и имеющая апостилированный перевод); копия разрешения на ввоз лекарственного средства и копия лицензии на ввоз лекарственного средства (для зарубежного лекарственного средства); копия документа, подтверждающего происхождение лекарственного средства (товарно-транспортной накладной и (или) инвойса, представляемых для таможенного оформления); копия паспорта (протокола анализа) производителя (для отечественных лекарственных средств) или копия сертификата качества (анализа) фирмы (для зарубежных лекарственных средств) с указанием расшифровки подписи уполномоченного лица, его подписавшего; копии протоколов входного контроля (испытаний) и сертификатов на сырье, полупродукты, фармацевтические субстанции и материалы, используемые в производстве лекарственного средства (для отечественных лекарственных средств) и документов, подтверждающих происхождение фармацевтических субстанций используемых в производстве данного лекарственного средства (товарнотранспортных накладных и (или) инвойсов с отметкой таможенного органа); 11 копия протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), заверенная испытательной лабораторией или сертификат соответствия на систему качества Системы сертификации ГОСТ Р, или системы, признанной в установленном порядке в Системе сертификации ГОСТ Р; другие документы прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Копии документов (кроме копии лицензии на право производства лекарственных средств и копии протокола испытаний) заверяются печатью декларанта. Полученные за пределами территории Российской Федерации документы о подтверждении соответствия, знаки соответствия, протоколы исследований (испытаний) должны иметь апостилированный перевод на русском языке или перевод, заверенный юридическим или физическим лицами, исполняющими функции иностранного производителя. 8) Где зарегистрировать декларацию о соответствии? Принятая декларантом декларация о соответствии регистрируется органом по сертификации (см. далее перечень органов по сертификации), в область аккредитации которого включены лекарственные средства, идентифицируемые кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 по ОК 005-93 (в том числе группы, подгруппы, виды продукции). Перечень органов по сертификации, аккредитованных для проведения работ по регистрации деклараций о соответствии лекарственных средств по состоянию на 15 декабря 2007 года Федеральн ый округ Центральн ый федеральн ый округ Регистрационный номер и период действия аттестата аккредитации РОСС RU.0001.11ФМ01 31.10.200531.10.2008 Наименовани е аккредитован ного органа по сертификации Орган по сертификации продукции ФГУ "ЦЭККМП" Росздравнадзо ра Адрес и телефон/факс аккредитованного органа по сертификации ФИО руководителя 101000, Москва, Кривоколенный Куликова пер., 12, стр. 3 Клара Тел.: (495) 621-21- Ивановна 49, 621-21-19 12 Центральн ый федеральн ый округ СевероЗападный федеральн ый округ Сибирский федеральн ый округ Уральский федеральн ый округ РОСС RU.0001.11ФМ02 12.10.200512.10.2008 РОСС RU.0001.11ФМ03 01.11.200501.11.2008 РОСС RU.0001.11ФМ04 28.11.200528.11.2008 РОСС RU.0001.11ФМ05 02.12.200502.12.2008 Приволжск ий федеральн ый округ РОСС RU.0001.11ФМ06 05.12.200505.12.2008 Южный федеральн ый округ РОСС RU.0001.11ФМ07 02.12.200502.12.2008 Орган по сертификации продукции ОАО "Межрегиона льный центр сертификации " Орган по сертификации продукции ООО "Окружной центр сертификации Северо-Запад" Орган по сертификации лекарственны х средств ООО "Окружной центр сертификации " Орган по сертификации лекарственны х средств ООО "Окружной центр сертификации " Орган по сертификации продукции ООО "Окружной центр сертификации " Орган по сертификации продукции ООО "Окружной центр сертификации " 109044, Москва, ул. Динамовская, 1А Тел/факс: (495) 781-47-48, 781-4749, тел.: (495) 67657-54, 105-76-95, 105-76-96 194156, СанктПетербург, Светлановский пр., 2, офисы 503, 505 Тел/факс: (812) 380-06-34 630559, Новосибирская обл., п. Кольцово, здание АТС, а/я 168 Тел/факс: (383) 336-67-65 Ерофеев Андрей Витальевич (зам. рук. ОС - Гвильдис Маргарита Владленовна, Щекалев Андрей Борисович) Рогачева Елена Геннадьевна Кривошеена Рита Николаевна 620043, г. Екатеринбург, Первушкин ул. Репина, 103/2, Владислав офис 200 Андреевич Тел.: (343) 378-3171 603001, г. Нижний Новгород, Дурнова ул. Почаинский Маргарита овраг, 2/1 Анатольевна Тел.: (8312) 39-7820, факс: (8312) 34-09-39 344103, г. Ростовна-Дону, пр. Зорге, 66 Тел/факс: (863) 278-69-21 Змияк Наталья Витальевна 13 Дальневост очный федеральн ый округ РОСС RU.0001.11ФМ08 14.02.200614.02.2009 Орган по сертификации лекарственны х средств ООО "Окружной центр сертификации " 680033, г. Хабаровск, ул. Тихоокеанская, 204 офис 707 тел.: (4212) 22-5363 факс: (4212) 7601-73 Лысенко Татьяна Сергеевна Регистрация декларации о соответствии лекарственного средства осуществляется на основании заявления декларанта на проведение регистрации декларации. Форма заявления на регистрацию декларации о соответствии ___________________________ наименование органа по сертификации ___________________________________ адрес ЗАЯВЛЕНИЕ на проведение регистрации декларации о соответствии лекарственного средства _________________________________________________________________ наименование организации-изготовителя, продавца _______________________________________________________________________________________ или индивидуального предпринимателя Юридический адрес_________________________________________ _________________________________________________________________ Банковские реквизиты______________________________________________ _________________________________________________________________ Телефон ____________________Факс _________________ Телекс_________ просит провести регистрацию декларации о соответствии лекарственного средства ________________________________________________________ наименование _______________________________________________________________________________________ серийный (постоянный) выпуск, или партия (серия) определенного объема Оплата работ по регистрации гарантируется. Заявление на регистрацию данной декларации о соответствии в другие органы по сертификации не подавалось. Приложения: 4. Декларация о соответствии. 5. Копии документов, предусмотренных для данной продукции соответствующими федеральными законами, и выданные уполномоченными на то органами и организациями в 1 экз. _______________________________________________________________ наименование документов 6. Другие копии документов, подтверждающих соответствие продукции установленным требованиям и (или) правомочность принятия декларации о соответствии 14 _______________________________________________________________ наименование документов Руководитель организации _________________ _______________ подпись инициалы, фамилия Главный бухгалтер _________________ подпись М.П. _______________________ ______________ инициалы, фамилия Дата Для регистрации декларации о соответствии серии (партии) лекарственного средства в орган по сертификации представляются: копия документа, подтверждающего факт внесения сведений о создании или реорганизации юридического лица в Единый государственный реестр юридических лиц или сведений о приобретении физическим лицом статуса индивидуального предпринимателя в Единый государственный реестр индивидуальных предпринимателей; копия документа о государственной регистрации лекарственного средства; копия лицензии на производство (фармацевтическую деятельность) лекарственных средств, заверенная нотариально; копия контракта (договора) на поставку (для продавца); копия документа, выданного компетентным органом в стране происхождения продукции, о соответствии условий производства лекарственных средств, требованиям GMP, заверенная нотариально и имеющая апостилированный перевод (для зарубежных производителей лекарственных средств); документ, подтверждающий право юридического или физического лица, зарегистрированных в соответствии с законодательством Российской Федерации на ее территории, выполнять функции иностранного изготовителя (договор с этим изготовителем в части обеспечения поставляемой продукции установленным требованиям и в части ответственности за несоответствие поставляемой продукции установленным требованиям, либо доверенность, нотариально заверенная изготовителем в стране происхождения продукции и имеющая апостилированный перевод); копия разрешения на ввоз лекарственного средства и копия лицензии на ввоз лекарственного средства (для зарубежного лекарственного средства); копия документа, подтверждающего происхождение лекарственного средства (товарно-транспортной накладной и (или) инвойса, представляемых для таможенного оформления); копия паспорта (протокола анализа) производителя (для отечественных лекарственных средств) или копия сертификата качества (анализа) фирмы (для зарубежных лекарственных средств) с указанием расшифровки подписи уполномоченного лица, его подписавшего; 15 копии протоколов входного контроля (испытаний) и сертификатов на сырье, полупродукты, фармацевтические субстанции и материалы, используемые в производстве лекарственного средства (для отечественных лекарственных средств) и документов, подтверждающих происхождение фармацевтических субстанций используемых в производстве данного лекарственного средства (товарнотранспортных накладных и (или) инвойсов с отметкой таможенного органа); копия протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), заверенная испытательной лабораторией или сертификат соответствия на систему качества Системы сертификации ГОСТ Р, или системы, признанной в установленном порядке в Системе сертификации ГОСТ Р; другие документы прямо или косвенно подтверждающие соответствие продукции установленным требованиям. Копии документов (кроме копии лицензии на право производства лекарственных средств и копии протокола испытаний) заверяются печатью декларанта. Полученные за пределами территории Российской Федерации документы о подтверждении соответствия, знаки соответствия, протоколы исследований (испытаний) должны иметь апостилированный перевод на русском языке или перевод, заверенный юридическим или физическим лицами, исполняющими функции иностранного производителя. При этом в случае, если декларацию о соответствии принимает продавец, к ней должны быть приложены документы на поставку лекарственного средства. При проверке правильности установления срока действия декларации следует проверить его соответствие сроку годности лекарственного средства, сроку действия регистрационного удостоверения и нормативной документации, на основании которой принимается декларация. 16 9) Что проверяет орган по сертификации при проведении работ по регистрации декларации о соответствии? При регистрации декларации о соответствии лекарственного средства орган по сертификации в течение 7 дней проверяет: наличие декларируемого лекарственного средства в Перечне продукции, подлежащей декларированию соответствия, утвержденном постановлением Правительства Российской Федерации от 07.07.99г. № 766 (в редакции постановлений Правительства Российской Федерации от 29.04.2002г. № 287, от 10.02.2004г. № 72); правомочность изготовителя (продавца) принимать декларацию о соответствии лекарственного средства; полноту и правильность указания нормативных документов, устанавливающих требования к данному лекарственному средству; наличие копий документов, подтверждающих соответствие лекарственного средства установленным требованиям, полученных с участием третьей стороны, и заверенных в установленном порядке; правильность заполнения декларации о соответствии. До регистрации декларации о соответствии декларируемого лекарственного средства, орган по сертификации проверяет: внесено ли данное лекарственное средство в Государственный реестр лекарственных средств; правильность идентификации лекарственного средства, проведенной декларантом, в части отнесения лекарственного средства к коду по Общероссийскому классификатору продукции ОК 005-93. При проверке правомочности заявителя принимать декларацию о соответствии лекарственного средства орган по сертификации проверяет: зарегистрирован ли декларант на территории Российской Федерации в качестве юридического лица или индивидуального предпринимателя; в случае если декларация соответствия лекарственного средства принимается от лица зарубежного производителя, дополнительно проверяется наличие договора о выполнении декларантом функций иностранного изготовителя в части обеспечения соответствия поставляемых лекарственных средств установленным требованиям и в части ответственности декларанта за несоответствие поставляемой продукции установленным требованиям. При проверке полноты и правильности указания нормативных документов, устанавливающих требования к данному лекарственному средству, орган по сертификации проверяет правильность указания фармакопейной статьи (временной фармакопейной статьи, фармакопейной статьи предприятий, нормативного документа на лекарственные средства зарубежного производства), в тексте декларации о соответствии, сроки действия нормативных документов. 17 При проверке наличия копий всех документов, выданных уполномоченными на то органами и организациями, орган по сертификации проверяет, представлены ли копии: копия документа, подтверждающего факт внесения сведений о создании или реорганизации юридического лица в Единый государственный реестр юридических лиц или сведений о приобретении физическим лицом статуса индивидуального предпринимателя в Единый государственный реестр индивидуальных предпринимателей; копия документа о государственной регистрации лекарственного средства; копия лицензии на право производства (реализации) лекарственных средств, заверенная нотариально; копия контракта (договора) на поставку (для поставщика или продавца); копия разрешения на ввоз лекарственного средства и копия лицензии на ввоз лекарственного средства (для зарубежного лекарственного средства); копии документов, подтверждающего происхождение лекарственного средства: документированные сведения о количестве лекарственного средства, произведенного отечественным изготовителем, или объеме партии зарубежного лекарственного средства, ввозимого на территорию Российской Федерации (продавцом); копия паспорта (протокола анализа) производителя (для отечественных лекарственных средств) или копия сертификата качества (анализа) фирмы и его перевод (для зарубежных лекарственных средств) с указанием расшифровки подписи уполномоченного лица, его подписавшего; копии протоколов входного контроля (испытаний) и сертификатов на сырье, полупродукты, субстанции и материалы, используемые в производстве лекарственного средства; копии документов подтверждающих происхождение сырья используемого в производстве данного лекарственного средства; копия протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), заверенная испытательной лабораторией. При проверке наличия копий документов, подтверждающих соответствие лекарственного средства установленным требованиям, полученных с участием третьей стороны, орган по сертификации проверяет наличие: копия протокола испытаний, проведенных в аккредитованной испытательной лаборатории (центре), заверенная испытательной лабораторией; или сертификат соответствия на систему качества Системы сертификации ГОСТ Р, или системы, признанной в установленном порядке в Системе сертификации ГОСТ Р. При проверке правильности заполнения декларации о соответствии орган по сертификации проверяет правильность ее оформления в соответствии с формой и правилами заполнения декларации о соответствии. 18 При этом в случае, если декларацию о соответствии принимает продавец, к ней должны быть приложены документы на поставку лекарственного средства. При проверке правильности установления срока действия декларации следует проверить его соответствие сроку годности лекарственного средства, сроку действия регистрационного удостоверения и нормативной документации, на основании которой принимается декларация. В случае, если по всем критериям проверки получены положительные результаты, орган по сертификации регистрирует декларацию о соответствии лекарственного средства. Если в ходе проверки получены отрицательные результаты, орган по сертификации информирует заявителя о необходимости устранения выявленных несоответствий. После устранения этих несоответствий декларант направляет заявление о регистрации декларации о соответствии повторно в орган по сертификации, проводивший проверку. 19 10) В какой испытательной лаборатории можно провести испытания лекарственных средств для целей декларирования ее соответствия? В качестве доказательств соответствия лекарственного средства, полученных с участием аккредитованной испытательной лаборатории (центра), используются протоколы испытаний, проведенных по всем показателям качества, установленным в нормативной документации на данное лекарственное средство. Перечень технически компетентных и независимых испытательных лабораторий (центров), аккредитованных на проведение испытаний лекарственных средств для целей декларирования их соответствия, на 15 декабря 2006 г. Регистрационны й номер Наименование аккредитованного объекта РОСС RU.0001.21ФМ8 8 Испытательная лаборатория ГУ "Центр контроля качества и сертификации лекарственных средств Республики Саха (Якутия)" Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных Дата регистрации аттестата Дата окончания действия аттестата Почто -вый индек с Адрес аккредитованного объекта ФИО руководителя Телефон / телефакс Дальневосточный федеральный округ РОСС RU.0001.22ФМ0 7 14.09.2006 14.09.2009 67700 5 г. Якутск, ул. П.Алексеева, 91 Попова Любовь Егоровна (4112) 448788, 370254/(4112) 448788 01.06.2006 01.06.2009 68001 1 г. Хабаровск, ул. Советская, 34 Булгакова Надежда Вячеславовна (4212) 348911, 348853/348776 20 средств" министерства здравоохранения Хабаровского края Приволжский федеральный округ РОСС RU.0001.21ФМ3 6 РОСС RU.0001.21ФМ0 1 РОСС RU.0001.21ФМ8 3 Испытательная лаборатория ГУ здравоохранения "Центр по сертификации и контролю качества лекарственных средств Кировской области" Испытательная лаборатория НОЦККСЛС 31.08.2006 31.08.2009 13.01.2006 13.01.2009 Испытательная 11.09.2006 контрольноаналитическая лаборатория ГУЗ "Оренбургский информационнометодический центр по экспертизе, учету и анализу обращения средств медицинского применения" 27.02.2009 61004 2 46004 7 г. Киров, ул. Березниковская, 24 Пескичева Евгения Юрьевна (8332) 24-2111/24-35-11 603600, г. Нижний Новгород, ГСП858, ул. Геологов, 6 г. Оренбург, ул. Салмышская, д. 13 Усанова Ангелина Сергеевна тел.: (8312) 66-0424/ Морозова Светлана Вячеславовна (3532) 31-48-12, 98-50-86/(3532) 31-48-12, 98-50-86 21 РОСС RU.0001.21ФМ3 0 РОСС RU.0001.21ФМ2 1 РОСС RU.0001.21ФМ4 1 Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" Министерства здравоохранения и социального развития Пензенской области Испытательная контрольноаналитическая лаборатория ГУ здравоохранения "Пермский областной центр контроля качества и сертификации лекарственных средств" Региональный испытательный центр "Фарматест" ГОУ ВПО "Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному 26.06.2006 26.06.2009 44006 0 г. Пенза, проспект Строителей, 35 Кирсанова Галина Григорьевна (8412)435811, 433379/ 05.07.2006 28.02.2009 61400 0 г. Пермь, ул. Кирова, 22 Клоц Елена Владимировна (342) 2125344/2127347 28.02.2006 28.02.2009 61407 0 г. Пермь, ул. Крупской, 46 Малкова Тамара Леонидовна (3422) 481675/ 22 развитию" РОСС RU.0001.21ФМ7 3 РОСС RU.0001.21ФМ2 4 РОСС RU.0001.21ФМ6 8 Испытательная лаборатория лекарственных средств ООО "Пермская испытательная аналитическая лаборатория" Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" Испытательная лаборатория "Региональный центр контроля качества лекарственных средств" ГОУ ВПО "Башкирский государственный медицинский университет Министерства 16.05.2005 16.05.2008 61409 0 г. Пермь, ул. Лодыгина, 57 Ольхина Светлана Сергеевна (3422)696949, 695215/699098 28.02.2006 28.02.2009 45010 6 Республика Башкортостан, г. Уфа, ул. Батырская, 39, корп. В Курамшина Ольга Аркадьевна (3472) 554503/554557 01.03.2004 01.03.2007 45000 0 Республика Башкортостан, г. Уфа, ул. Ленина, 3 Катаев Валерий Алексеевич (3472) 226295/ 23 здравоохранения Российской Федерации" РОСС RU.0001.21ФМ5 9 Испытательная лаборатория ГУЗ "МРЦККСЛС" 27.11.2006 27.11.2009 43003 3 РОСС RU.0001.22ФМ0 9 Испытательная лаборатория ГУ "Центр контроля качества и сертификации лекарственных средств Республики Татарстан" Испытательная лаборатория ГУ здравоохранения "Центр контроля качества лекарственных средств Самарской области" Испытательная лаборатория ГУ ЦККиСЛС в Саратовской области 30.03.2006 30.03.2009 42008 7 03.07.2006 03.07.2009 22.05.2006 22.05.2009 РОСС RU.0001.21ФМ1 9 РОСС RU.0001.22ФМ1 7 Республика Мордовия, г. Саранск, ул. Ярославская, 12 Республика Татарстан, г.Казань, ул.Комарова, 10 Ососкова Галина Николаевна (8342) 550705/(8342) 550766 Писарева Светлана Николаевна (843) 2984912, 2984760, 2988521/2984913 44307 0 г. Самара, ул. Партизанская, 33 Демидова Галина Анатольевна (8462) 689982/689982 41060 0 г. Саратов, ул. Астраханская, 43 Коробкова Мария Григорьевна (8452) 524679/524678 24 РОСС RU.0001.21ФМ7 9 РОСС RU.0001.21ФМ1 6 РОСС RU.0001.21ФМ8 6 Испытательная 16.11.2005 контрольноаналитическая лаборатория ГУ "Центр контроля качества лекарственных средств Министерства здравоохранения Удмуртской Республики" Испытательная 28.07.2006 лаборатория Центра контроля качества и сертификации лекарственных средств ОГУ "Информационнометодический центр по экспертизе, анализу и маркетингу" Испытательная 04.08.2006 лаборатория ГУЗ "Информационнометодический центр по экспертизе, учету и анализу обращения средств медицинского применения" Минздравсоцразвит ия Чувашской Республики 16.11.2008 42603 9 Удмуртская Республика, г. Ижевск, ул. Дзержинского, 3 Братухина Светлана Михайловна (3412) 442088/453800 28.07.2009 43270 0 г. Ульяновск, пр. Нариманова, 15 Семенова Ирина Ефимовна (8422) 462764, 464229/462764, 464229 04.08.2009 42801 8 Чувашская Республика, г. Чебоксары, ул.Магницкого, 2 Васильева Татьяна Валентиновна (8352) 562854,/562824, 266414 Северо-Западный федеральный округ 25 РОСС RU.0001.21ФМ7 2 РОСС RU.0001.21ФМ1 8 РОСС RU.0001.21ФМ4 5 РОСС RU.0001.21ФМ7 1 РОСС RU.0001.21ФМ7 6 Испытательная контрольноаналитическая лаборатория ГУ здравоохранения "Вологодский областной центр контроля качества и сертификации лекарственных средств" Испытательная лаборатория СПб ГУЗ "СЗЦККиСЛ" Испытательная лаборатория (Центр контроля качества лекарственных средств) ГОУ ВПО "СанктПетербургская государственная химикофармацевтическая академия Федерального агентства по здравоохранению и социальному развитию" Испытательный центр ООО "Эксперт Био" Испытательная лаборатория ЛОГУЗ "Лаборатория" 06.04.2005 06.04.2008 16000 2 г. Вологда, ул. Лечебная, 30 Марсов Николай Григорьевич (8172) 532590, 533081/536956 23.01.2006 23.01.2009 19821 6 03.10.2009 19737 6 Смирнова Ирина Геннадьевна Слепнев Михаил Владимирович (812) 3769273/ 03.10.2006 Санкт-Петербург, Ленинский пр., д. 140 Санкт-Петербург, ул. Профессора Попова, 14 197376, СанктПетербург, ул. Казанская, 12 11.01.2005 11.01.2008 19402 1 08.09.2008 19101 4 Александрова Оксана Алексеевна Наконечная Людмила Борисовна (812)5916959/591 6966 08.09.2005 Санкт-Петербург, Институтский пр., 21, корп. 2 Санкт-Петербург, ул. Некрасова, 33 (812) 2340713/(812) 2340713 (812) 5791846, 2793849/ 26 РОСС RU.0001.22ФМ4 8 РОСС RU.0001.22ФМ7 0 РОСС RU.0001.21ФМ3 5 РОСС RU.0001.21ФМ6 7 Испытательная лаборатория - отдел контроля качества лекарственных средств Учреждения Министерства обороны Российской Федерации "649 Центр контроля качества и сертификации лекарственных средств" Испытательная лаборатория ООО "Еврофарм" Контрольноаналитическая лаборатория по контролю качества лекарственных средств ФГУ "Мурманский центр стандартизации, метрологии и сертификации Контрольноаналитическая лаборатория ГУЗ "Центр сертификации и контроля качества лекарственных средств" 28.02.2006 28.02.2009 19404 4 Санкт-Петербург, ул. Лебедева, 6 Голубенко Светлана Алексеевна (812) 2483405/5418373 15.10.2004 15.10.2007 19608 4 01.08.2009 18300 1 Михайличенко Ирина Александровна Панченко Светлана Ивановна (812) 3886975, 3886595/ 01.08.2006 Санкт-Петербург, ул. Цветочная, д. 18 г. Мурманск, ул. Фестивальная, д. 25 27.01.2004 27.01.2007 17300 1 Г. Великий Ильина Ирина Новгород, ул. Б. Викторовна СанктПетербургская, 14, а/я 42 (8152) 28-68-89, 28-67-66, 28-6639/(8152) 28-71-51 (81622) 74635, 73255/ 27 РОСС RU.0001.22ФМ6 6 Испытательная лаборатория ГУЗ "ЦККСЛС Псковской области" 22.01.2004 22.01.2007 18000 2 г. Псков, ул. Госпитальная, 3 Шабанова Вера Родионовна (8112) 468805, 724116/468805, 724116 Сибирский федеральный округ РОСС RU.0001.21ФМ5 0 РОСС RU.0001.22ФМ3 3 РОСС RU.0001.21ФМ2 5 Испытательная лаборатория ГУ "Алтайский краевой центр по сертификации и контролю качества лекарственных средств" Испытательный центр лекарственных средств Комитета по фармацевтической деятельности и производству лекарств администрации Иркутской области Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" 07.09.2006 07.09.2009 65605 6 г. Барнаул, ул. Ползунова, 23 Ковалева Светлана Геннадьевна (3852) 633883, 631843/633883 03.07.2006 03.07.2009 66404 0 г. Иркутск, ул. Тухачевского, 3 Окунь Тамара Васильевна (3952) 441426, 445583/ 01.08.2006 01.08.2009 65005 5 г. Кемерово, ул. СибиряковГвардейцев 13а Коновалова Наталья Моисеевна (3842) 289766/289600 28 РОСС RU.0001.21ФМ3 1 РОСС RU.0001.21ФМ3 1 РОСС RU.0001.21ФМ6 1 Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" (Новокузнецкий филиал) Испытательная лаборатория ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" (Новокузнецкий филиал) Испытательная лаборатория ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития" Красноярский филиал) 01.08.2006 01.08.2009 65005 5 г. Новокузнецк, пр. Октябрьский, 12 Дьяченко Галина Геннадьевна (3843) 770065, 770697/770697 20.10.2004 16.08.2006 65404 1 г. Новокузнецк, пр. Октябрьский, 12 Шелопугина Ольга Афанасьевна (3843) 476156/471997 25.09.2006 25.09.2009 66002 1 г. Красноярск, пр. Мира, 132 Струщенко Наталья Ивановна (3912) 218293/211128 29 РОСС RU.0001.21ФМ2 0 РОСС RU.0001.21ФМ2 3 РОСС RU.0001.21ФМ1 4 РОСС RU.0001.21ФМ8 1 РОСС RU.0001.21ФМ7 7 Контрольноаналитическая лаборатория ОГУЗ "Центр контроля качества лекарственных средств" Испытательная лаборатория ООО "Окружной центр сертификации" Испытательная лаборатория ГУ Омской области "Территориальный центр по сертификации и контролю качества лекарственных средств Омской области" Испытательная лаборатория ГУЗ "ЦСККЛС МЗ РБ" 28.07.2006 28.07.2009 63008 2 г. Новосибирск, ул. Дуси Ковальчук, 77 Шанаурова Тамара Николаевна (383) 2250482/2250482 20.12.2005 20.12.2008 63055 9 Терещенко Ирина Николаевна (3832) 366133, 366500/ 14.04.2006 14.04.2009 64401 2 Новосибирская область, п. Кольцово, здание АТС г. Омск, Башенный переулок, 2 Романчук Юлия Федоровна (3812) 236153, 257355/236153 12.01.2006 12.01.2009 67000 0 Будажапова Туяна Эрдэмовна (3012) 217853, 217859/(3012) 212366 Контрольноаналитическая лаборатория ГУ здравоохранения "Центр сертификации и контроля качества лекарственных средств" 09.09.2005 09.09.2008 66700 7 Республика Бурятия, г. УланУдэ, ул. Ленина, 29 Республика Тыва, г. Кызыл, ул. Оюна Курседи, 71 Маадыр Валентина Доржуевна (39422) 13724/(39422) 13725 30 РОСС RU.0001.21ФМ5 5 Испытательная лаборатория Областного ГУ здравоохранения "Центр по сертификации и контролю качества лекарственных средств Томской области" 30.08.2006 30.08.2009 63405 0 г. Томск, пр.Ленина, д.54 Рахлина Елена Федоровна (3822) 513721/512024 Уральский федеральный округ РОСС RU.0001.21ФМ0 8 РОСС RU.0001.22ФМ0 6 Испытательная 18.04.2006 лаборатория ГУ "Курганский областной центр сертификации и контроля качества лекарственных средств" Испытательная 14.04.2006 лаборатория ГУ здравоохранения "Свердловский центр сертификации и качества лекарственных средств" 18.04.2009 64002 7 г. Курган, ул.Дзержинского, 56. Глазунова Татьяна Владимировна (3522) 576649/575595 14.04.2009 62010 0 г. Екатеринбург, Сибирский тракт, 49, 5-й километр Морозова Татьяна Васильевна (343) 3793441, 3793442, 2546398/3793441 31 РОСС RU.0001.22ФМ7 5 РОСС RU.0001.21ФМ4 7 Испытательная лаборатория ГУ здравоохранения "Центр сертификации и контроля качества лекарственных средств в ЯмалоНенецком автономном округе" Испытательная лаборатория ГУ здравоохранения "Областной центр сертификации и контроля качества лекарственных средств" 25.08.2005 25.08.2008 62900 7 Ямало-Ненецкий автономный округ, г.Салехард. ул.Свердлова, 19 Ганина Марина Михайловна (34922) 47690/ 16.01.2006 16.01.2009 45400 6 г. Челябинск, ул. Российская, 63-а Федотова Светлана Ивановна (3512) 617091, 644477/617091 Центральный федеральный округ РОСС RU.0001.21ФМ6 0 РОСС RU.0001.21ФМ5 8 Испытательная контрольноаналитическая лаборатория Областного ГУ здравоохранения "Центр контроля качества и сертификации лекарственных средств" Контрольноаналитическая лаборатория ГУЗ "БЦКК И СЛС" 21.09.2006 21.09.2009 30802 3, г. Белгород, ул. Студенческая, 38 Павлик Игорь Петрович (4722) 341402/(4722) 341402 08.09.2006 08.09.2009 24101 1 г. Брянск, ул. Луначарского, 9а Маневич Владимир Исаакович (4832) 644599/(4832) 662444 32 РОСС RU.0001.21ФМ3 9 РОСС RU.0001.21ФМ2 8 РОСС RU.0001.21ФМ0 2 РОСС RU.0001.21ФМ0 4 РОСС RU.0001.21ФМ0 5 РОСС RU.0001.21ФМ1 2 Испытательная лаборатория ГУЗ ВО "Контрольноаналитическая лаборатория" Испытательная лаборатория ГУЗ "Воронежский ЦКК и СЛС Испытательная лаборатория ООО "Центр контроля качества лекарственных средств "Центр ЭКОФАРМ" Испытательный центр ООО "ИЦЛС "Биотехнология" Испытательная лаборатория ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития (Курский филиал) Испытательная лаборатория ООО "КоАЛ Фарманализ" 05.09.2005 05.09.2008 60002 8 г. Владимир, ул. Лакина, 153 Б Бугрова Неля Дмитриевна (4922) 338622/ 19.05.2006 19.05.2009 39405 1 г. Воронеж, ул. Писателя Маршака, 1 Чусова Татьяна Валентиновна (4732) 256658/639141 10.03.2006 10.03.2009 11799 7 Москва, ул. Саморы Машела, 3/7 Соколова Татьяна Михайловна (495) 9192938, 7980863/ 02.03.2006 02.03.2009 11540 4 12.01.2006 12.01.2009 30504 0 Москва, ул. 6-я Радиальная, 24, стр. 14 г. Курск, ул. 50 лет Октября, 122 Симонова Татьяна Григорьевна Мануйлова Ирина Николаевна (495) 3223650, 3221614, 3276257/ (495) 3221614 (4721) 517043/ 25.04.2006 25.04.2009 12928 2 Москва, ул. Чермянская, 2, стр. 1 Елизарова Татьяна Евгеньевна (495) 3630812/(495) 4735089 33 РОСС RU.0001.21ФМ2 9 Испытательный центр ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития 24.10.2006 РОСС RU.0001.21ФМ3 4 Испытательная лаборатория лекарственных средств ФГУ "Центр контроля качества лекарственных средств и медицинских измерений" Управления делами Президента Российской Федерации 11.09.2006 11.09.2009 12147 1 Москва, ул. Рябиновая, 43 РОСС RU.0001.21ФМ4 2 Испытательный центр ГУ Всероссийский научноисследовательский институт лекарственных и ароматических 11.09.2006 11.09.2009 11721 6 24.10.2009 11724 6 12318 2 Москва, Научный проезд, 14а; Багирова Валерия Леонидовна (495) 1282632, 1206097, 2346104/1282632, 1903320 Шепелев Борис Николаевич (495) 4482030/(495) 4480590 Москва, ул. Грина, Сокольская 7 Татьяна Александровна (495) 3885509/(495) 3888518 Москва, ул. Щукинская, 6 34 растений ("ВИЛАР") Российской академии сельскохозяйственн ых наук РОСС RU.0001.21ФМ6 5 РОСС RU.0001.21ФМ6 9 РОСС RU.0001.21ФМ7 4 РОСС RU.0001.22ФМ8 2 Испытательная лаборатория ГУЗ "ЦС и ККЛ ДЗ г. Москвы" Испытательная лаборатория ООО "ЦКК ОНЦ им. Блохина РАМН" Испытательная лаборатория ЗАО "Контрольноаналитическая лаборатория Академии медикотехнических наук" Испытательная лаборатория отдела государственного контроля и изучения качества, эффективности, безопасности средств трансфузионной и инфузионной терапии ГУ гематологического научного центра 13.01.2004 13.01.2007 11112 3 Москва, шоссе Энтузиастов, 64 Тузова Саетлана Алексеевна (495) 1767910/ (495) 1762763 19.05.2005 07.07.2007 14229 0 Москва, Каширское шоссе, 24 Просалкова Ирина Робертовна (499) 5039605, 5039319/5039319 21.06.2005 21.06.2008 11547 8 Москва, Каширское шоссе, 24, стр. 16 Коростелев Сергей Анатольевич (495) 7283685/(495) 1873520 07.03.2006 07.03.2009 12516 7 Москва, Новозыковский проезд, 4а Карякин Александр Вадимович (495) 6124272/ (495) 6132503 35 Российской академии медицинских наук РОСС RU.0001.22ФМ8 5 РОСС RU.0001.22ФМ9 0 РОСС RU.0001.21ФМ5 1 Испытательная лаборатория ФГУП "Государственный научный центр по антибиотикам" Испытательная зональная лаборатория государственного контроля качества препаратов крови, кровезаменителей и консервирующих растворов ГУ здравоохранения города Москвы "Станция переливания крови Департамента здравоохранения города Москвы" Испытательная лаборатория ФГУ НЦЭСМП Росздравнадзора (Ивановский 10.05.2006 10.05.2009 11310 5 Москва, ул. Нагатинская, 3а Ваганова Ольга Александровна (495) 2314236/(495) 1114238 23.10.2006 23.10.2009 11551 6 Москва, ул. Бакинская, 31 Кузьмичев Вячеслав Александрович (495) 3275132/3275134 09.12.2005 09.12.2008 15304 0 г. Иваново, ул. Любимова, 5 Сидорова Ольга Владимировна (4932) 535470/ 36 филиал) РОСС RU.0001.21ФМ3 2 РОСС RU.0001.21ФМ2 6 РОСС RU.0001.21ФМ3 7 Испытательная контрольноаналитическая лаборатория ГУ здравоохранения "Центр сертификации и контроля качества лекарственных средств" Костромской области Испытательная лаборатория Областного ГУ "Центр контроля качества и сертификации лекарственных средств" Испытательная лаборатория ФГУ Министерства обороны Российской Федерации "655 Центр контроля качества и сертификации лекарственных средств" 03.07.2006 03.07.2009 15660 3 г. Кострома, Кинешемское шоссе, 6а Быкова Лариса Анатольевна (4942) 228633/(4942) 226041 25.07.2006 25.07.2009 39803 2 г. Липецк, Поперечный проезд, 4 Лунева Нина Сергеевна (4742) 341923, 355814/(4742) 341923 25.08.2006 25.08.2009 14100 4 Московская область, г. Мытищи, ул. Щорса, дом 1а Степнова Ирина Владимировна (495) 5837876/5837876 37 РОСС RU.0001.21ФМ9 1 РОСС RU.0001.22ФМ7 8 РОСС RU.0001.21ФМ1 1 РОСС RU.0001.21ФМ4 9 Испытательная лаборатория ГУП Московской области "Московский областной центр сертификации и контроля качества лекарственных средств" Испытательная лаборатория Отдела контроля качества ЗАО "НПФЦ Цитолекс" Испытательная лаборатория ГУ здравоохранения "Центра по сертификации и контролю качества лекарственных средств Рязанской области" Испытательная лаборатория Областного ГУ здравоохранения "Смоленский областной центр контроля качества и сертификации лекарственных средств" 27.11.2006 27.11.2009 11961 9, 14040 8, 14260 0 14141 1 Москва, ул. Попутная, 5; Московская область: г. Коломна, ул. Октябрьской революции, 336; г. Орехово-Зуево, ул. Ленина, 54 Залеских Ольга Владимировна (495) 2559947/4651167, 4651148 Московская область, г. Химки, ул. Рабочая, д. 2а, корпус 1 Сысоева Светлана Михайловна (495) 9953508/9953508 20.10.2005 20.10.2008 24.04.2006 24.04.2009 39004 2 г.Рязань, Крючкова ул.Октябрьская, 2а Людмила Константиновн а (4912) 387714/387715 14.09.2006 14.09.2009 21401 9 г. Смоленск, ул. Аптечная, 1 (4812) 623159/(4812) 611440 Веселова Галина Михайловна 38 РОСС RU.0001.21ФМ2 7 Испытательная лаборатория ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития (Тамбовский филиал) 26.10.2006 26.10.2009 39200 9 г. Тамбов, ул. Элеваторная, 5 а Корнеева Ирина Викторовна (4752) 725523/(4752) 711576 РОСС RU.0001.21ФМ4 6 Испытательная лаборатория ГУ здравоохранения Тверской области "Тверской Центр сертификации и контроля лекарственных средств" Испытательная лаборатория ООО "Петрофарм" 16.01.2006 16.01.2009 17000 0 г. Тверь, ул. Вокзальная, 1 Музыка Людмила Алексеевна (4822) 343325, 355719/355719 08.08.2006 08.08.2009 15213 0 Ярославская область, Ростовский район, р/п Петровское, ул. Подгорная, 40А-12 Просалкова Ирина Робертовна (48536) 40203/(48536) 40203 РОСС RU.0001.22ФМ8 7 Южный федеральный округ 39 РОСС RU.0001.21ФМ8 4 РОСС RU.0001.21ФМ8 9 РОСС RU.0001.21ФМ5 3 Испытательная 23.05.2006 лаборатория ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития (КабардиноБалкарский филиал) Испытательная 12.10.2006 лаборатория Республиканского ГУ "КарачаевоЧеркесский республиканский центр фармацевтического надзора и контроля качества лекарственных средств" Испытательная 04.09.2006 лаборатория Краевого ГУ "Центр по контролю качества и сертификации лекарственных средств Краснодарского края" 23.05.2009 36000 0 КабардиноБалкарская Республика, г. Нальчик, ул. Советская, 286 Расторгуева Светлана Александровна (8662) 425744/425744 12.10.2009 36901 2 КарачаевоЧеркесская Республика, г. Черкесск, ул. Парковая, 7 Катасонова Лариса Александровна (8782) 271461/(8782) 271461 04.09.2009 35005 8 г. Краснодар, Карасунский административны й округ, ул. Селезнева, 242, литер Г Болгова Татьяна Ивановна (8612) 341600, 341606, 343532/343532 40 РОСС RU.0001.22ФМ4 4 РОСС RU.0001.21ФМ0 3 РОСС RU.0001.22ФМ8 0 РОСС RU.0001.21ФМ1 5 Испытательная лаборатория Центра сертификации и контроля качества лекарственных средств ГУ "Аптечное Управление министерства здравоохранения Республики Дагестан" Испытательная лаборатория ГУП Ростовской области "Фармацевтический центр" Испытательная лаборатория ЗАО "Ростбалканфарм" Испытательная лаборатория ФГУ "Научный центр экспертизы средств медицинского применения" Федеральной службы по надзору в сфере здравоохранения и социального развития (Ставропольский филиал) 01.08.2006 01.08.2009 36702 7 Республика Дагестан, г. Махачкала, ул. Буганова, 10 Юсупова Нателла Юсуповна 30.03.2006 30.03.2009 34400 6 г. Ростов-на-Дону, пр. Соколова, 18 Перерва Галина (8863) 2632308, Петровна 2633245/2632308 24.11.2005 24.11.2008 34678 0 24.10.2006 24.10.2009 35500 0 Ростовская область, г. Азов, пер. Осипенко, 10 г. Ставрополь, ул. Артема, 35 Андросова Татьяна Леонидовна Баранова Светлана Стефановна (8722) 635706/635582, 637505 (86342) 64096/64097 (8652) 352516/(8652) 352516 41 РОСС RU.0001.21ФМ4 0 Испытательный центр ГОУ ВПО "Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию" 29.08.2006 29.08.2009 35750 0, г. Пятигорск, пр. Кирова, 33 Волокитин Сергей Васильевич (8793) 391927/329267 42 11) Оплата работ по регистрации декларации о соответствии Оплата работ по регистрации декларации о соответствии осуществляется заявителем (изготовителем, продавцом) в двукратном размере минимальной месячной заработной платы (два ММРОТ), установленной законодательством Российской Федерации. 12) Прекращение действия декларации о соответствии Действие регистрации декларации о соответствии может быть прекращено на основании полученной органом по сертификации от декларанта информации о выявлении органами государственного надзора факта несоответствия лекарственного средства установленным требованиям. В этом случае в реестр зарегистрированных деклараций о соответствии вносятся сведения о прекращении действия регистрации декларации о соответствии. 13) Хранение декларации о соответствии и заверение ее копии Зарегистрированная декларация о соответствии лекарственного средства вместе с документами, на основании которых она была принята, хранится у декларанта не менее 3 лет после окончания срока ее действия. Копии зарегистрированной декларации о соответствии лекарственного средства и сопроводительных документов (доказательственных материалов) хранятся в архиве органа по сертификации также в течение не менее 3 лет после окончания срока ее действия. По желанию декларанта орган по сертификации может проводить заверение копий зарегистрированных деклараций о соответствии. 14) Где применяется декларация о соответствии? Зарегистрированная декларация о соответствии лекарственного средства необходима в следующих случаях: - при представлении одновременно с таможенной декларацией в таможенные органы для помещения продукции, подлежащей обязательному подтверждению соответствия, под таможенные режимы, предусматривающие возможность 43 отчуждения или использования этой продукции в соответствии с ее назначением на таможенной территории Российской Федерации (см. Федеральный закон «О техническом регулировании» от 27.12.2002 № 184ФЗ статья 29 пункт 1). - при продаже продукции (товаров) продавец обязан довести до сведения покупателя информацию о подтверждении соответствия продукции (товаров) установленным требованиям путем ознакомления потребителя по его требованию с одним из документов, в число которых включена декларация о соответствии (см. постановление Правительства Российской Федерации от 19.01.1998 № 55 пункт 12 Приложения – Правила продажи отдельных видов товаров). 44